鸡痘病毒活疫苗污染禽网状内皮组织增生症病毒的间接免疫荧光法检测研究
2018-06-06李启红夏业才李慧姣李俊平杨承槐
孙 淼,李 岭,李启红,夏业才,李慧姣,李俊平,杨承槐
(中国兽医药品监察所,北京 100081)
禽网状内皮组织增生病是由反转录病毒科的网状内皮组织增生病病毒(Reticuloendotheliosis Virus,REV)引起的一种禽类肿瘤性疾病[1-2]。鸡痘的免疫防控主要使用鸡痘弱毒活疫苗,免疫的成功与否主要取决于疫苗的抗原效价、纯净性及特定的使用条件。外源病毒污染是目前影响我国鸡痘活疫苗质量的严峻问题。国内外已有多例关于禽用活疫苗中污染REV并造成严重损失的报道[3-4]。
目前,国内外已建立了多种用于检测REV的血清学和分子生物学方法[5-6],这些方法常用于进行REV的流行病学调查,或比较不同REV毒株间的核苷酸序列差异,分析其遗传进化规律等。也有很多研究者使用PCR的方法从禽用疫苗中检测出REV的污染[7-8]。美国CVB实验室已经建立了REV的PCR检测方法并将其作为种毒的标准检验方法,欧洲药典中则规定使用免疫染色法对种毒中是否含有REV进行检验。
根据《兽用生物制品规程》(二〇〇〇年版)[9]、《中华人民共和国兽药典》三部(二〇〇五年版)[10]规定,鸡痘活疫苗必须进行外源病毒检验,确保疫苗使用的有效性和安全性。在进行外源病毒检验时,鸡胚检查法和细胞检查法均无法有效检出REV,只有通过鸡检查法才能检测到REV污染,但鸡检查法成本高、检验周期长。李俊平等[11]在国内首次通过系统的研究建立了禽用活疫苗中污染REV的间接免疫荧光法(Indirect Immuno-influorescence Assay, IFA)检测方法,并被《中国兽药典》三部(二〇一〇年版)收录,作为禽用活疫苗检测REV污染的国家标准。为进一步确定该方法对不同疫苗产品的检测灵敏度并与传统鸡检查法进行比较,开展了鸡痘活疫苗中污染REV的IFA检测研究,以期为鸡痘活疫苗质量控制提供更有效的技术手段。
1 材料与方法
1.1 材料
1.1.1 鸡痘活疫苗 已知无外源病毒污染的样品1批;待检样品60批来源于16个生产企业。
1.1.2 REV HA9901株 山东农业大学动物科技学院家禽肿瘤病实验室惠赠。
1.1.3 SPF鸡胚 购自北京维通利华实验动物技术有限公司。
1.1.4 试剂 M199营养液、新生牛血清均购自Hyclone公司;鸡抗REV特异性血清,中国兽医药品监察所病毒制品检测室制备[12];兔抗鸡IgY荧光抗体,购自SIGMA公司。
1.2 方法
1.2.1 样品处理 取1000(或以上)羽份鸡痘活疫苗样品,用4 mL(或适量)不含血清的M199营养液溶解,使最终为500羽份/2 mL;4 ℃,12000 g离心15 min;上清液经0.8 μm、0.45 μm、0.22 μm、0.1 μm滤器各过滤1次,取滤液2 mL(相当于500羽份)用于接种鸡胚成纤维细胞(CEF)。
1.2.2 样品接种与传代 按常规方法制备CEF;将处理好的样品接种于1个25 cm2的CEF单层,置37 ℃吸附1 h,弃去接种液,用含3%牛血清的M-199培养液洗CEF单层2次,2 mL/次,每瓶细胞加7~8 mL含3%牛血清的M199培养液,37 ℃培养7 d。培养到期,按照常规方法消化,取消化后1/10的细胞用2 mL含3%新生牛血清的M199营养液悬浮,接种4孔48孔板,每孔接种0.5 mL。剩余细胞做好标记,-15 ℃以下保存备用。接种细胞的48孔板置5% CO2,37 ℃继续培养5 d。
1.2.3 荧光染色 按照常规方法进行间接免疫荧光染色,在倒置荧光显微镜下观察。
1.2.4 IFA法检测鸡痘活疫苗中污染REV的最低检出量 向每500羽份鸡痘活疫苗样品(外源病毒检测为阴性)中分别添加0 TCID50、5 TCID50、10 TCID50、20 TCID50的REV,按1.2.1、1.2.2、1.2.3步骤用IFA方法进行检测。
1.2.5 商品化鸡痘活疫苗中污染REV的检测 由16家企业生产的60批鸡痘活疫苗样品用《中国兽药典》[13]规定的IFA方法进行外源病毒REV的检测。
1.2.6 IFA法与鸡检查法的符合率比较 随机选取5批1.2.5中检测结果为阴性的样品和全部阳性样品,按照《中国兽药典》[13]规定的鸡检查法进行检验,比较两种方法的符合率。
2 结 果
2.1 IFA法检测鸡痘活疫苗中污染REV的最低检出量 表1结果显示,每500羽份鸡痘活疫苗中污染20 TCID50的REV即可检出,即IFA检测方法对鸡痘活疫苗中污染REV的最低检出量为每羽份疫苗中含0.04 TCID50的REV。
2.2 商品化鸡痘活疫苗中污染REV的检测 表2结果显示,2家企业生产的4批活疫苗样品中REV检测为阳性。
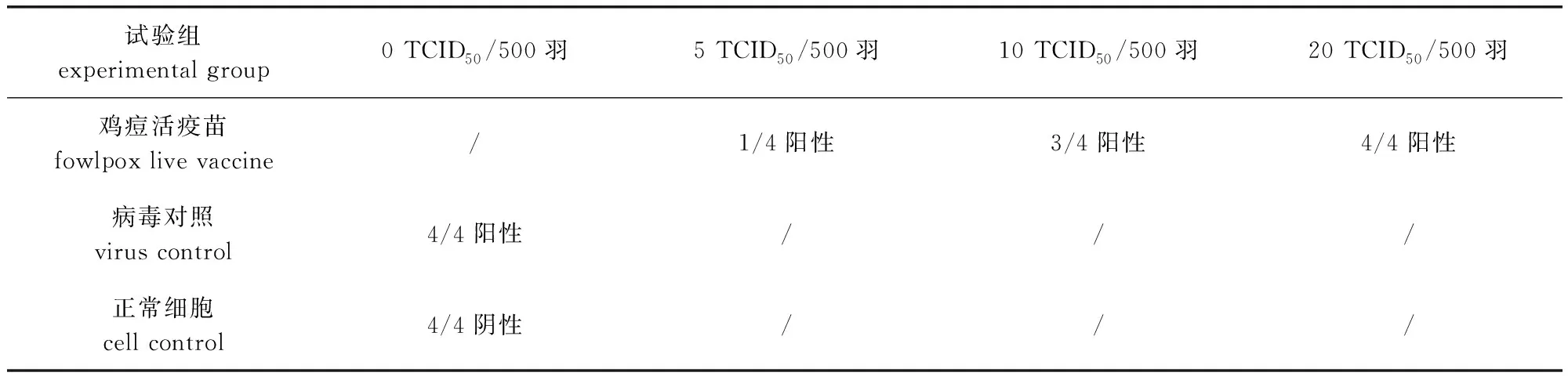
表1 鸡痘活疫苗中不同REV添加量的IFA检测结果Tab 1 Result of IFA detection of REV in fowlpox live vaccine with different dosage of REV
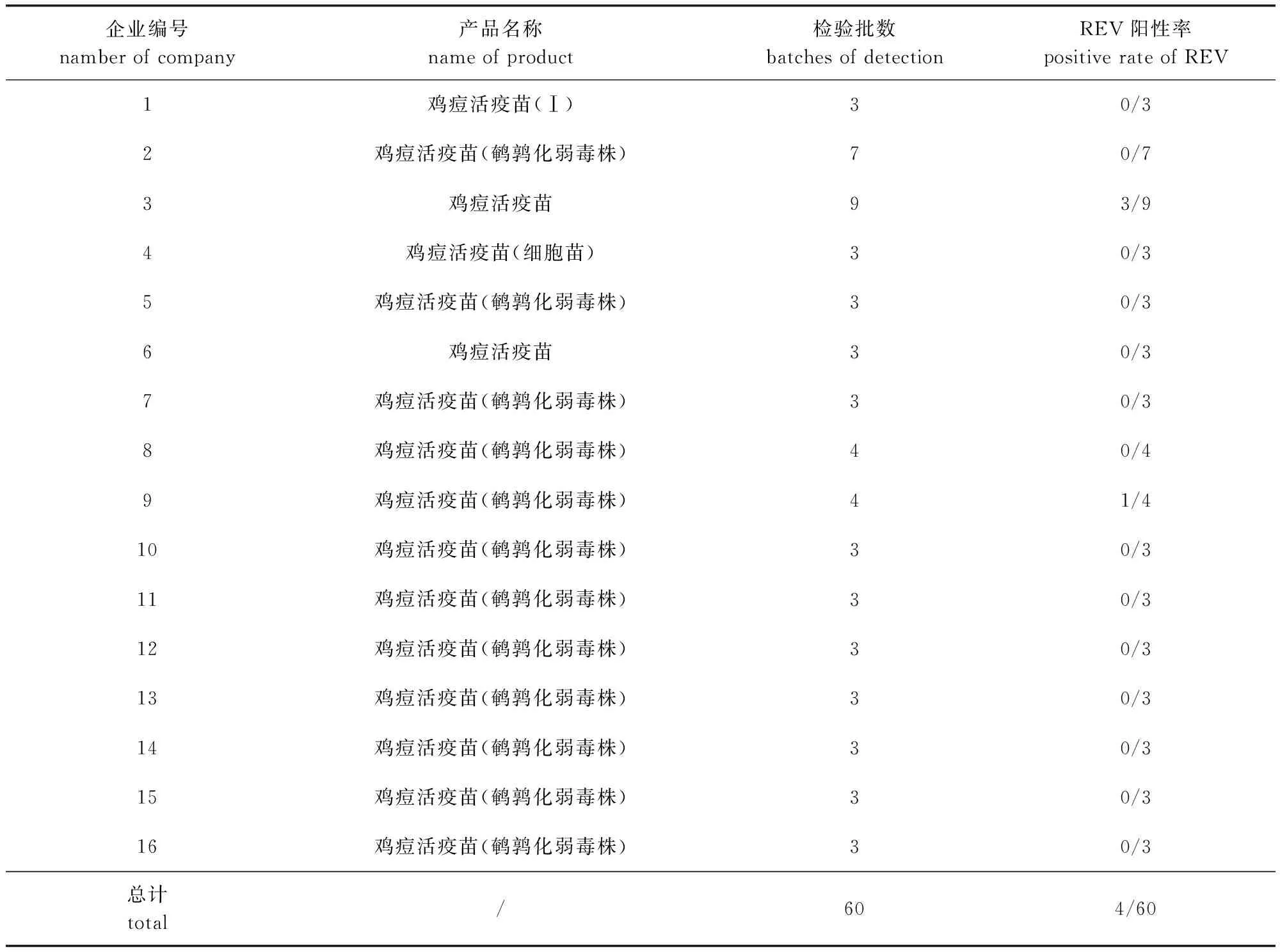
表2 IFA法检验商品鸡痘活疫苗中REV污染结果Tab 2 Result of REV contamination in commercial fowlpox live vaccines using IFA method
2.3 IFA法与鸡检查法的符合率比较 表3结果显示,IFA法检测阳性的4批鸡痘活疫苗,鸡检查法均为阳性;IFA法检测阴性的5批鸡痘活疫苗,鸡检查法也均为阴性,表明两种检测方法对9批临床疫苗中污染REV的检测结果符合率为100%。

表3 IFA法与鸡检查法的符合率比较Tab 3 Coincidence rate of IFA method and chicken test method
3 讨 论
李俊平等[11]建立的IFA方法自收入《中国兽药典》以来,已经广泛应用于禽用活疫苗外源病毒REV的检验工作,该方法与传统鸡检查法相比具有快速、准确、成本低的优点。通过检验,从商品化鸡痘活疫苗中检测出了REV阳性样品,并进一步确定了运用IFA法检测鸡痘活疫苗中污染REV的敏感性及其与鸡检查法的符合率。
研究通过向外源病毒检测为阴性的鸡痘活疫苗中添加不同病毒含量(0 TCID50、5 TCID50、10 TCID50、20 TCID50)的REV,模拟REV的污染,并用IFA法进行检验,确定了其检测鸡痘活疫苗污染REV的最小检出量为每500羽份污染20 TCID50的REV。Luan H[8]等通过人工添加不同剂量的REV到鸡马立克氏病活疫苗和鸡痘活疫苗中,再用建立的qPCR方法进行检测,结果表明qPCR法最低可检出每500羽份污染0.5 TCID50的REV。虽然IFA法与qPCR法比较敏感性略低,但是其检测为阳性的样品中可以确定含有感染性的REV病毒粒子,而qPCR法与其他PCR方法检测的是REV的某段核苷酸序列,并不能确定是否含有感染性病毒粒子。
王景燕等[14]将禽痘活疫苗接种7日龄雏鸡,采血浆接种CEF进行传代培养,并分别用IFA法和PCR法进行检测,最终获得1株REV游离病毒。Awad等[15]用PCR方法对30批鸡痘病毒疫苗样品检测REV污染情况,在1批样品中检测到REV核酸阳性。同时,该疫苗样品接种5日龄SPF鸡,定期采集血清用ELISA方法检测REV抗体均为阳性,定期采集肝脏、脾脏和法氏囊,通过组织病理学检查,在这些器官中均存在肿瘤细胞,说明该疫苗样品确实污染了REV。应用IFA法对16家企业生产的60批商品化鸡痘活疫苗进行了REV检测,结果2家企业生产的4批活疫苗IFA检测为阳性,说明我国鸡痘活疫苗中存在污染REV的情况。
目前,对鸡痘活疫苗污染REV的检测仅限于血清学和分子生物学方法,很少用鸡检查法进行验证。Awad等[15]将1批污染了REV的鸡痘活疫苗接种SPF鸡,最终检测出REV的抗体,对PCR法进行了验证。国内学者尚无系统的使用鸡检查法与鸡痘活疫苗污染REV的检测方法进行比较验证。鸡检查法是我国现行合法的能够有效地检测出禽用活疫苗中污染REV的方法。研究选取IFA法检测REV为阳性的4批鸡痘活疫苗样品通过鸡检查法都检测到了REV的特异性抗体,而5批阴性样品检测均为阴性,二者检测结果的符合率为100%,再次确证了IFA方法检测的可靠性。鸡痘活疫苗污染REV的IFA检测方法具有较高的敏感性,该方法的建立进一步完善了禽用活疫苗外源病毒的检验体系,为有效防控禽用活疫苗污染外源病毒提供了更可行有效的检验手段。
参考文献:
[1] Y.M.Saif.禽病学[M].第十二版.北京:中国农业出版社,2012: 663-688.
Y.M.Saif. Diseases of poultry[M]. 12nd edition. Beijing: China Agriculture Press, 2012: 663-688.
[2] 扈荣良.现代动物病毒学[M].北京:中国农业出版社,2014: 844-846.
Hu R L. Modern animal virology[M]. Beijing: China Agriculture Press, 2014: 844-846.
[3] Jackson C A W, Dunn SE, Smith DI,etal. "Nakanuke" and reticuloendotheliosis in chickens following vaccination with herpesvirus of turkeys (HVT)[J]. Australian Veterinary Journal, 1977, 53(9): 457-458.
[4] Wei K, Sun Z, Zhu S, Guo W,etal. Probable congenital transmission of reticuloendotheliosis virus caused by vaccination with contaminated vaccines[J]. PloS one, 2012, 7(8): e43422.
[5] Fadly A M,Garcia M C. Detection of reticuloendotheliosis virus in live virus vaccines of poultry[J]. Dev Biologicals, 2006, 126: 301-305,discussion 327.
[6] 邓小芸,祁小乐,高玉龙,等.禽网状内皮组织增生症流行现状及检测技术研究进展[J].动物医学进展, 2010, 31(9): 93-96.
Deng X Y, Qi X L, Gao Y L,etal. Progress on epidemiology and detection technique of reticuloendotheliosis[J]. Progress in Veterinary Medicine, 2010, 31(9): 93-96.
[7] Takagi M, Ishikawa K, Nagai H,etal. Detection of contamination of vaccines with the reticuloendotheliosis virus by reverse transcriptase polymerase chain reaction (RT-PCR)[J].Virus Research, 1996, 40(2): 113-121.
[8] Luan H, Wang Y, Li Y,etal. Development of a real-time quantitative RT-PCR to detect REV contamination in live vaccine[J]. Poultry Science, 2016, Pii: pew147.
[9] 农业部兽用生物制品规程委员会.中华人民共和国兽用生物制品规程(二〇〇〇年版)[S].北京:科学出版社,2000.
Veterinary Biologics Regulation Commission of Ministry of Agriculture. Regulation of Veterinary Biologics of People's Republic of China (2000 edition)[S]. Beijing: Science Press, 2000.
[10] 中国兽药典委员会.中华人民共和国兽药典三部(二〇〇五年版)[S].北京:中国农业出版社,2006.
Chinese Veterinary Pharmacopoeia Commission. Veterinary Pharmacopoeia of the People's Republic of China 3rd part (2005 edition)[S]. Beijing: China Agriculture Press, 2006.
[11] 李启红,杨承槐,刘 丹,等. 鸡马立克病活疫苗中污染禽网状内皮组织增生病病毒检测方法的建立[J].中国兽药杂志, 2014, 50(11): 81-84.
Li Q H, Yang C H, Liu D,etal. Establishment of indirect immunofluorescence assay method for detection of avian reticuloendotheliosis virus contamination in Marek's disease live vaccine[J]. Chinese Journal of Veterinary Drug, 2014, 50(11): 81-84.
[12] 李俊平,杨承槐,李启红,等. 鸡抗REV血清的制备与检定[J].中国兽药杂志,2011,45(9): 15-18.
Li J P, Yang C H, Li Q H,etal. Preparation and Identification of Chicken Anti -Reticuloendotheliosis Virus Polyclonal Antibody[J]. Chinese Journal of Veterinary Drug, 2011, 45(9): 15-18.
[13] 中国兽药典委员会.中华人民共和国兽药典三部(二〇一五年版)[S].北京:中国农业出版社,2016.
Chinese Veterinary Pharmacopoeia Commission. Veterinary Pharmacopoeia of the People's Republic of China 3rd part (2015 edition)[S]. Beijing: China Agriculture Press, 2016.
[14] 王景艳,李中明,赵 鹏,等.禽痘病毒活疫苗中网状内皮组织增生病病毒的分离鉴定及其序列比较[J].中国动物传染病学报, 2010, 18(1): 35-39.
Wang J Y, Li Z M, Zhao P,etal. Isolation of reticuloendo-theliosis virus from a fowl pox live vaccine and env gene sequence analysis[J]. Chinese Journal of Animal Infectious Diseases, 2010, 18(1): 35-39.
[15] Awad A M, Abd EI-Hamid H S, Abou Rawash A A,etal. Detection of reticuloendotheliosis virus as a contaminant of fowl pox vaccines[J]. Poultry Science, 2010, 89(11): 2389-2395.
