镍钼配比对镍钼氮化物结构和丙烷氨氧化反应性能的影响
2018-06-05张惠民
张 惠 民
(国家能源投资集团有限责任公司,北京 100011)
丙烯腈(ACN)是生产聚丙烯腈纤维(腈纶)、丁腈橡胶(NBR)、丙烯腈-丁二烯-苯乙烯树脂(ABS树脂)的主要原料。丙烯腈水解可以制得丙烯酰胺和丙烯酸及其酯类,电解加氢偶联制得己二腈,还可制造抗水剂、胶黏剂等,也用于其它有机合成和医药工业中,并用作谷物熏蒸剂等。丙烯腈是一种重要的有机化工原料,在合成纤维、合成树脂和合成橡胶等高分子材料中占有重要地位。目前,工业上丙烯腈的生产主要是丙烯氨氧化法,据统计现在全球95%以上的装置都采用该方法来生产丙烯腈[1]。近年来,由于全球丙烯资源的短缺和丙烷价格的低廉,使丙烷氨氧化制丙烯腈工艺成为烷烃活化技术中开发的热点。BP,Mitsubishi,Asahi三家公司均已完成中型试验[2]。丙烷氨氧化技术催化剂的研制与开发是至关重要的环节。近年来,随着研究的不断深入,丙烷氨氧化催化剂形成了锑酸盐[3]、钼酸盐[4]、V-Al-O-N[5]、V-P-O[6]及Ga/H-ZSM-5[7]等催化剂体系。其中,锑酸盐和钼酸盐被认为是两类更具有应用前景的潜在丙烷氨氧化催化剂体系。Florea等[5]首次将V-Al-O-N催化剂用于丙烷氨氧化反应过程中,发现该催化剂也具有很好的催化性能,与锑酸盐和钼酸盐催化剂相比,其优势主要体现在该催化剂生成丙烯腈的时空收率高达812 L/(kg·h),远高于其它催化剂的时空收率。
本课题组合成了钼基双金属氮化物催化剂,并首次将该催化剂体系应用于丙烷氨氧化制丙烯腈反应过程中,发现钴钼和镍钼双金属氮化物催化剂的催化活性和丙烯腈选择性高[8]。同时,系统研究Ni-Mo氧化物前体的不同制备方法对氮化物催化剂理化性质及丙烷氨氧化反应的影响,发现共沉淀法Ni-Mo氮化物催化剂的催化活性和丙烯腈选择性高[9]。
本研究在前期研究的基础上,进一步探讨镍钼两种金属元素配比对合成的镍钼氧化物及其氮化物催化剂结构的影响,并考察合成的镍钼氮化物催化剂对丙烷氨氧化反应的催化性能。
1 实 验
1.1 催化剂制备
1.1.1镍钼双金属氧化物的合成镍钼双金属氧化物采用共沉淀法制备。根据不同镍钼配比的要求称取一定量的钼酸铵和硝酸镍,配制成水溶液。然后将钼酸铵水溶液缓慢滴加至硝酸镍水溶液中,加入少量氨水使溶液保持在一定pH下进行沉淀,再经真空抽滤后将沉淀物在383 K烘干12 h,然后在773 K下焙烧4 h,获得镍钼双金属氧化物。合成镍钼氧化物时镍钼两种元素的配比n(Ni)/n(Mo)分别选择为1/4,2/3,1/1,3/2,4/1,该配比是镍钼两元素的化学计量比,而并非实际合成产物中的镍钼配比。
1.1.2镍钼氮化物催化剂的制备将4 g Ni-Mo氧化物(20~60目)装入石英反应管中,通入H2/N2混合气,进行程序升温反应制得Ni-Mo氮化物催化剂。H2/N2混合气体质量空速为18 000 mL/(h·g),在973 K下恒温氮化4 h,然后降温至室温;利用含有1%氧气的氮气作为钝化气体钝化12 h,即得镍钼双金属氮化物。
1.2 催化剂表征
X射线粉末衍射利用日本岛津公司生产的XRD-6000衍射仪测量,实验条件为:Cu Kα射线,2θ扫描范围为20°~80°,扫描速度为4(°)/min。可见Raman光谱实验采用法国Horiba Jobin Yvon公司生产的LabRam-HR显微共焦拉曼光谱仪,532 nm激光源,功率0.365 mW。傅里叶变换红外光谱(FTIR)分析采用美国Digilab公司生产的FTS-3000型傅里叶变换红外光谱仪,样品与KBr以1∶100的质量比混合,研磨后压成片,扫描范围为4 000~400 cm-1,分辨率为2 cm-1。
H2程序升温还原(H2-TPR)反应在传统的流体反应管中进行。将0.2 g金属氮化物置于样品管中,在He环境下于393 K下预处理1 h,然后降至室温。通入H2和Ar的混合气体(5%H2、95%Ar,体积分数),流量为50 mL/min,以10 K/min的速率将温度升至1 223 K。反应产物的质谱信号用Quantachrome Autosorb-1质谱仪进行记录。
1.3 催化剂性能评价
催化剂活性评价在常压固定床反应器中进行,装入1 g(20~40目)催化剂。反应原料气C3H8,O2,NH3,He 的摩尔比为1∶7.5∶7.5∶34,总流速为14.5 mL/min。反应温度利用催化剂床层插入的热电偶进行控制。氨氧化反应温度范围控制在693~793 K内,反应器出口温度保持在443 K。原料气和反应产物浓度利用配有FID检测器的气相色谱仪(SP-2100)进行分析。气相色谱仪中配置Porapak Q柱,用于分离CO,CO2,C2H4,C3H6,C3H8,CH3CN,CH2=CHCHO,丙烯腈。
2 结果与讨论
2.1 镍钼氧化物的表征
图1为由不同镍钼配比的镍钼氧化物的XRD图谱,其中在2θ为23.7°,25.8°,27.4°,39.7°,49.3°处出现的衍射峰是MoO3的特征峰(JCPDS Card 85-2405),2θ为28.8°,32.6°,43.9°处出现的衍射峰是α-NiMoO4的特征峰(JCPDS Card 33-0948)。
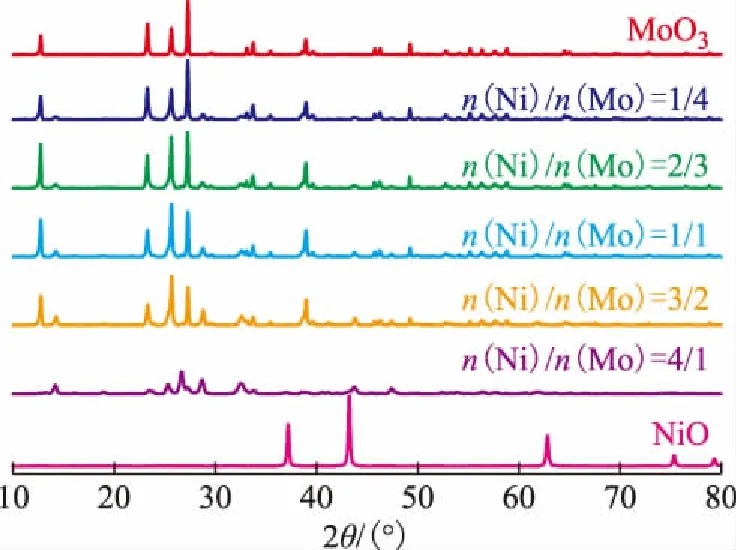
图1 不同镍钼配比的镍钼氧化物的XRD图谱
由图1可以看出:当加入Ni物种后,合成的金属氧化物的XRD图谱中出现了MoO3和α-NiMoO4两种晶相共存的衍射峰;随Ni含量的增加,合成的金属氧化物中MoO3的衍射峰强度逐渐减弱,而α-NiMoO4的衍射峰强度逐渐增强;当n(Ni)/n(Mo)为4/1时XRD谱图中已检测不到MoO3衍射峰的存在,但此时的XRD谱图中除了α-NiMoO4的衍射峰外还检测到了β-NiMoO4峰(JCPDS Card 12-0348)。
Raman光谱分析是检测少量MoO3的一种非常有效的表征手段之一。图2为不同镍钼配比合成的镍钼氧化物的可见Raman光谱。Ozkan等[10]认为MoO3的Raman峰会出现在波数为998,822,670,285 cm-1等区域。由图2可知:本研究获得的MoO3可见Raman光谱结果与其是吻合的;波数为962,914,706 cm-1处的峰归属于α-NiMoO4,波数为945,935,896 cm-1处的峰归属于β-NiMoO4[10-11];随着镍含量的增加,合成的镍钼氧化物中MoO3的Raman峰的强度逐渐减弱,当n(Ni)/n(Mo)为4/1时镍钼氧化物中已检测不到MoO3的Raman峰,此时谱图呈现出α-NiMoO4和β-NiMoO4共存的Raman峰。
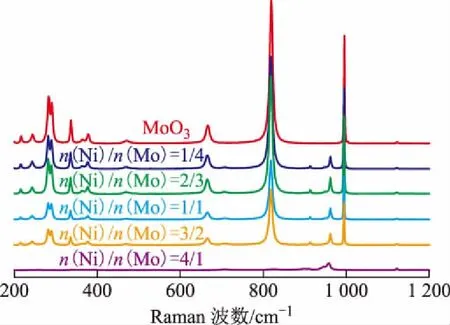
图2 不同镍钼配比的镍钼氧化物前体的可见Raman光谱
图3为不同镍钼配比合成的镍钼氧化物的FTIR图谱。
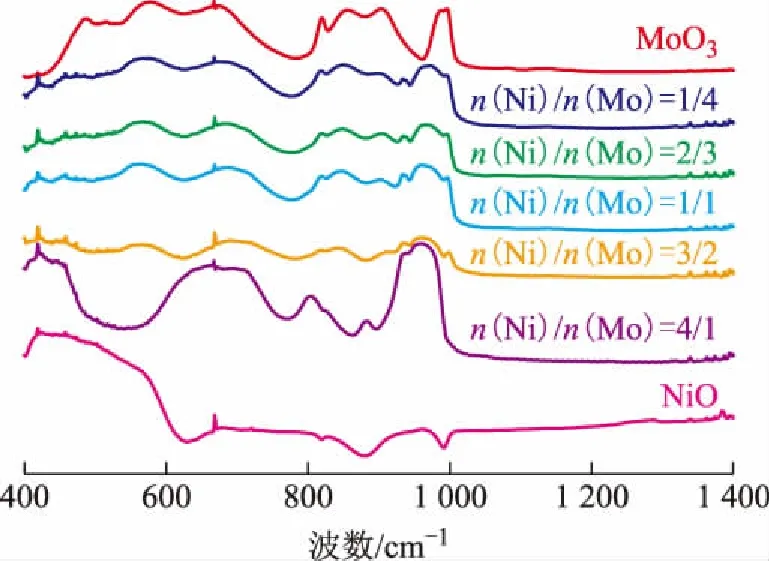
图3 不同镍钼配比的镍钼氧化物的FTIR图谱
MoO3的红外伸缩振动存在3种模式:Mo=O(997 cm-1),Mo—O—Mo(862 cm-1、821 cm-1),O—Mo—O(563 cm-1)[12]。α-NiMoO4的红外伸缩振动峰在934 cm-1和958 cm-1处,β-NiMoO4的红外伸缩振动峰在950,880,800 cm-1[13]处。由图3可以看出:随着Ni含量的增加,合成的金属氧化物中归属于MoO3的钼氧键振动峰(997,862,821,563 cm-1)强度逐渐减弱;当n(Ni)/n(Mo)为4/1时镍钼氧化物FTIR谱图中没有检测到MoO3的钼氧键振动峰,仅检测到α-NiMoO4和β-NiMoO4中钼氧键的振动峰,这与上述镍钼氧化物的XRD和Raman表征结果是一致的。
2.2 镍钼双金属氮化物的表征
图4为不同镍钼配比合成的镍钼双金属氮化物催化剂的XRD图谱。在2θ为37.4°,44.0°,63.0°处出现的谱峰对应γ-Mo2N,2θ为40.8°,43.0°,45.3°处出现的谱峰对应Ni2Mo3N。由图4可以看出:随着Ni含量的增加,氮化物中γ-Mo2N的衍射峰强度不断减弱;当n(Ni)/n(Mo)为4/1时检测不到γ-Mo2N,主要表现为Ni2Mo3N的衍射峰;而其它几种镍钼配比的氮化物的XRD谱图,表现为γ-Mo2N与Ni2Mo3N两相共存的衍射峰。这一表征结果与上述镍钼氧化物结构组成是对应的,MoO3氮化反应生成γ-Mo2N,NiMoO4氮化反应生成Ni2Mo3N。
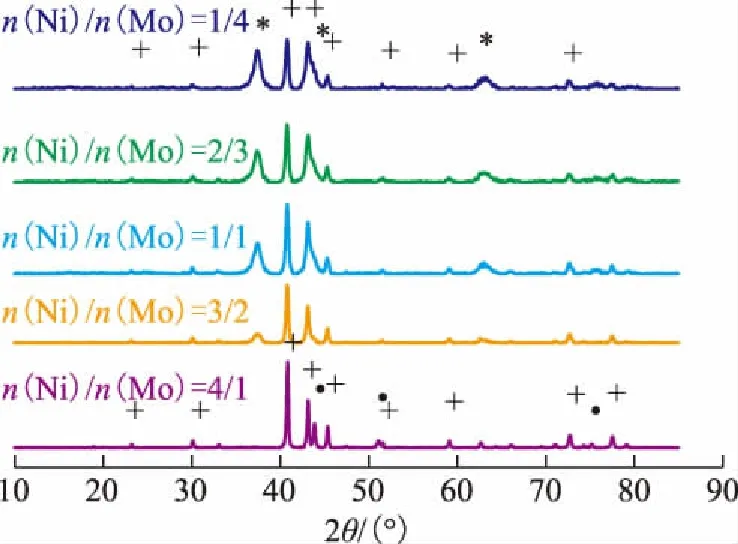
图4 不同镍钼配比的镍钼氮化物的XRD图谱*—γ-Mo2N; +—Ni2Mo3N;•—Ni
图5为不同镍钼配比氮化物催化剂的H2-TPR表征结果。从图5可以看出:Ni的加入使得H2的消耗峰向低温方向移动,表明Ni的加入有助于提高催化剂的氧化还原性能;从消耗H2的峰面积可以看出,γ-Mo2N和Ni2Mo3N两相共存的氮化物消耗H2的量明显大于γ-Mo2N或Ni2Mo3N[当n(Ni)/n(Mo)=4/1时];Ni2Mo3N[当n(Ni)/n(Mo)=4/1时]仅在低温时有氢的消耗,高温时没有氢的消耗,表明Ni2Mo3N仅具有低温弱氧化性,高温反应时没有氧化性能。
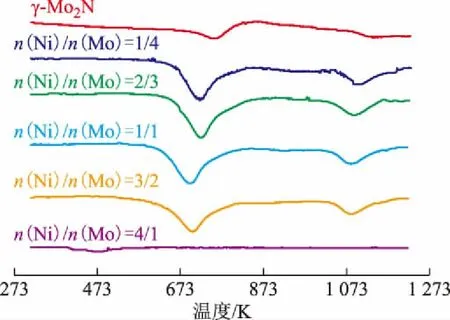
图5 γ-Mo2N和不同镍钼配比氮化物催化剂的H2-TPR表征结果
2.3 镍钼氮化物催化剂的丙烷氨氧化催化性能
将γ-Mo2N及镍钼氮化物催化剂用于丙烷氨氧化制丙烯腈反应中,反应结果如图6和图7所示。
从图6可以看出:镍钼双金属氮化物的催化活性明显高于γ-Mo2N,表明Ni的加入有助于提高氮化物的催化活性;不同镍钼配比的氮化物催化剂中,n(Ni)/n(Mo)为4/1的催化剂在低的反应温度下丙烷转化率较高,但随着反应温度的升高丙烷转化率提高较小,这是由于该催化剂中不含有γ-Mo2N,丙烷在该催化剂上发生了均相氧化反应,并未发生催化氧化脱氢反应;相比之下,其它4种镍钼配比的氮化物催化剂随着反应温度升高催化活性大幅提高,明显优于Ni2Mo3N的催化活性。
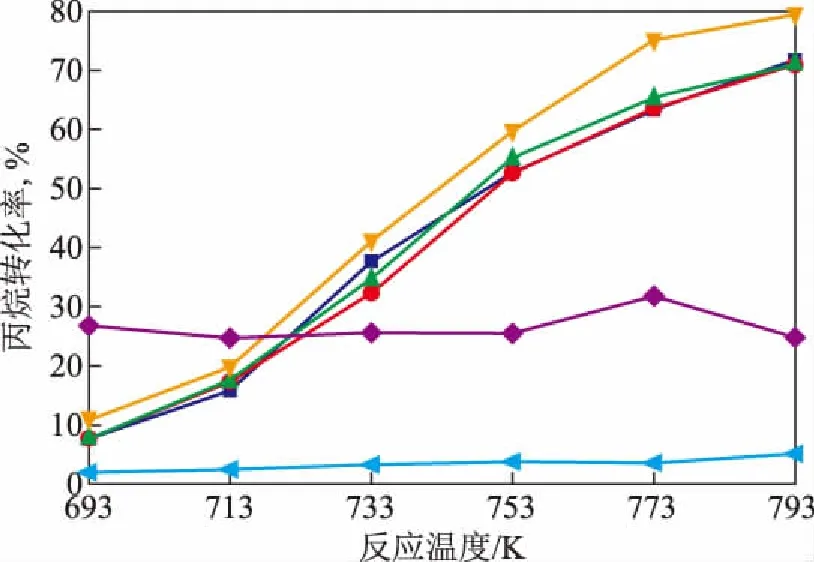
图6 γ-Mo2N和不同镍钼配比的双金属氮化物上丙烷转化率与反应温度的关系■—n(Ni)/n(Mo)=1/4; ●—n(Ni)/n(Mo)=2/3;▲—n(Ni)/n(Mo)=1/1; /n(Mo)=3/2; ◆—n(Ni)/n(Mo)=4/1; γ-Mo2N
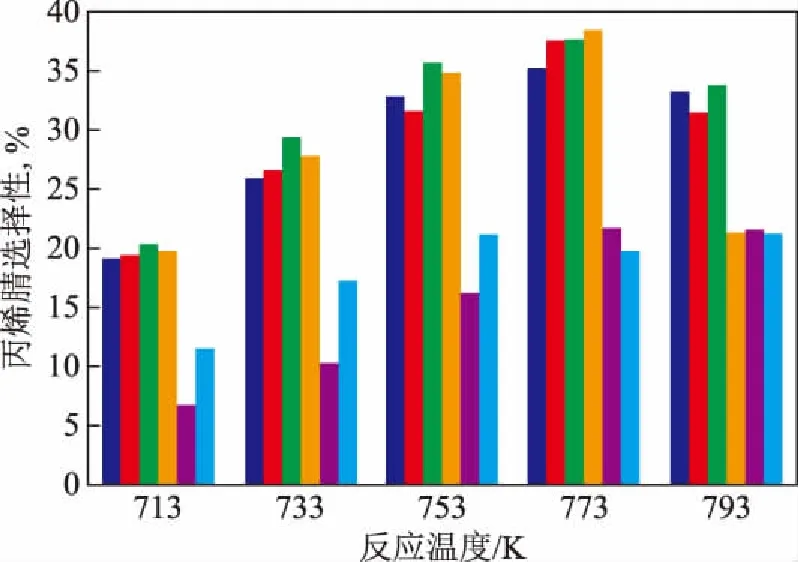
图7 γ-Mo2N和不同镍钼配比的双金属氮化物上丙烯腈选择性与反应温度的关系■—n(Ni)/n(Mo)=1/4; ■—n(Ni)/n(Mo)=2/3; ■—n(Ni)/n(Mo)=1/1; ■—n(Ni)/n(Mo)=3/2; ■—n(Ni)/n(Mo)=4/1; ■—γ-Mo2N
由图7可以看出:丙烯腈选择性随着反应温度升高而不断提高,在773 K下丙烯腈选择性达到最大值,然后随着反应温度的升高丙烯腈选择性开始下降;在反应温度为773 K及以下时,n(Ni)/n(Mo)不大于3/2的氮化物催化剂的丙烯腈选择性明显高于γ-Mo2N或Ni2Mo3N。
对不同镍钼配比氮化物催化剂丙烷氨氧化反应结果进行比较分析,可以看出,n(Ni)/n(Mo)为3/2的镍钼氮化物催化剂的催化性能优于其它催化剂,在773 K时丙烷转化率为75.0%,丙烯腈选择性为38.6%,则产率为28.95%。将镍钼氮化物催化剂丙烷氨氧化反应性能与催化剂表征结果相关联,可以发现镍钼氮化物催化剂的催化性能与其结构及氧化还原性密切相关。由n(Ni)/n(Mo)为4/1时制得的氮化物催化剂,基本由Ni2Mo3N构成,晶相中不含有γ-Mo2N,该氮化物表现出弱的氧化还原性,在丙烷氨氧化反应过程中其反应活性和丙烯腈选择性并不理想。单一晶相的Ni2Mo3N不具有丙烷氧化脱氢的催化功能,丙烷在该催化剂进行氨氧化反应时,丙烷首先在氧气作用下发生均相非催化氧化反应,生成COx和烯烃等,然后烯烃在Ni2Mo3N的作用下发生N的插入反应生产丙烯腈。在n(Ni)/n(Mo)不大于3/2时制得的氮化物催化剂,其结构由Ni2Mo3N和γ-Mo2N两种晶相组成,这类氮化物催化剂的氧化还原性比较强,在丙烷氨氧化反应过程中表现出优良的催化活性和丙烯腈选择性。这一研究结果进一步证实了丙烷在镍钼氮化物催化剂上的氨氧化反应实际上是由催化剂中Ni2Mo3N和γ-Mo2N两相协同作用完成的,催化中的两种晶相及其中氧物种和氮物种的共同作用完成了丙烷催化氧化脱氢和N物种插入丙烯中间体生成丙烯腈的反应[9]。
3 结 论
(1)通过控制镍钼两种金属元素的配比能够定向合成镍钼复合金属氧化物NiMoO4,或合成MoO3和NiMoO4两相共存的混合金属氧化物。利用合成的镍钼氧化物进行氮化反应,能够定向合成Ni2Mo3N或Ni2Mo3N和γ-Mo2N两相共存的镍钼双金属氮化物。Ni2Mo3N和γ-Mo2N两相共存的镍钼双金属氮化物比Ni2Mo3N或γ-Mo2N具有更强的氧化还原性能。
(2)在丙烷氨氧化反应中,Ni2Mo3N和γ-Mo2N两相共存的镍钼氮化物表现出的催化性能优于Ni2Mo3N或γ-Mo2N。由n(Ni)/n(Mo)为3/2的化学试剂合成的镍钼氮化物催化剂具有更优的催化性能,在773 K时丙烷转化率为75.0%,丙烯腈选择性达38.6%。
参 考 文 献
[1] 张惠民,赵震,徐春明.丙烷直接氨氧化制丙烯腈催化剂的研究进展[J].化学通报,2005,68(11):832-845
[2] 白尔铮.丙烷氨氧化制丙烯腈催化剂及工艺进展[J].工业催化,2004,12(7):1-6
[3] Bowker M,Bichnell C R,Kerwin P.Ammoxidation of propane to acrylonitrile on FeSbO4[J].Appl Catal A:General,1996,136(2):205-229
[4] Grasselli R K,Buttrey D J,Desanto Jr P,et al.Active centers in Mo-V-Nb-Te-Ox(amm)oxidation catalysts[J].Catal Today,2004,91/92:251-258
[5] Florea M,Prada-Silvy R,Grange P.Vanadium aluminium oxynitride catalysts for propane ammoxidation reaction:Effect of the V/Al ratio on the structure and catalytic behaviour[J].Appl Catal A:General,2005,286(1):1-10
[6] Centi G,Tosarelli T,Trifiro F.Acrylonitrile from propane on(VO)2P2O7with preadsorbed ammonia[J].J Catal,1993,142(1):70-83
[7] Derouane-Abd Hamid S B,Centi G,Pal P,et al.Propane ammoxidation over gallium-modified MFI zeolites[J].Catal Today,2001,64(1/2):129-138
[8] Zhang Huimin,Zhao Zhen,Xu Chunming,et al.New class of catalysts for the ammoxidation of propane to acrylonitrile over NiMo mixed metal nitrides[J].Chem Lett,2006,35(1):36-37
[9] Fan Xiaoqiang,Zhang Huimin,Li Jianmei,et al.Ni-Mo nitride catalysts:Synthesis and application in the ammoxidation of propane[J].Chinese Journal of Catalysis,2014,35(3):286-293
[10] Ozkan U,Schrader G L.NiMoO4selective oxidation catalysts containing excess MoO3for the conversion of C4hydrocarbons to maleic anhydride[J].J Catal,1985,95(1):120-136
[11] Woydt M,Skopp A,Dörfel I,et al.Wear engineering oxides/anti-wear oxides[J].Wear,1998,218(1):84-95
[12] Zeng H C.Chemical etching of molybdenum trioxide:A new tailor-made synthesis of MoO3catalysts[J].Inorg Chem,1998,37(8):1967-1973
[13] Maldonado-Hódar F J,Palma Madeira L M,Farinha Portela M.The effects of coke deposition on NiMoO4used in the oxidative dehydrogenation of butane[J].J Catal,1996,164(2):399-410
