Oct-4、SOX2和KPNA2在三阴性乳腺癌中的表达及其临床意义
2018-06-05赵士锋王数冯林李蔚然姚佳奇陶雅军
赵士锋,王数,冯林,李蔚然,姚佳奇,陶雅军
(大连大学医学院 病理学教研室,辽宁 大连 116622)
乳腺癌是一类在分子水平上具有高度异质性的疾病。2000年,Perou等[1]对乳腺癌的基因表达进行研究,将乳腺癌分成luminal A型(ER+Her-2-)、luminal B型(ER+Her-2+)、ER-/Her-2+型、basal-like型(ER-Her-2-)及normal breast-like型等。在basal-like型乳腺癌中ER-PR-及Her-2无过表达亚型被称为三阴性乳腺癌(triple-negative breast cancer,TNBC),约占全部乳腺癌的20%左右[2],其侵袭性强,转移早、复发率高、耐药且患者预后较差等生物学特点与癌症干细胞性肿瘤相符,且有研究发现在TNBC组织中活化的癌症干细胞数量明显增高,故被称为干细胞性乳腺癌[3],但在TNBC中癌症干细胞活化的机制迄今还不清楚。
Oct-4(octamer-binding transcription factor 4)和SOX2(sex determining region Y-box 2)均为核内转录因子,在胚胎干细胞和多能性细胞中均高表达,两者可形成转录复合体精确调控细胞的多潜能状态[4]。随着细胞分化Oct-4和SOX2的表达明显下降,但在肿瘤细胞中两者的表达均升高并与多种肿瘤的发生、转移以及化疗后的复发密切相关[5-6]。KPNA2(karyopherin A2,又名Importin α1)是核运输信号超家族中的一员,该家族分子作为运载工具帮助mRNA、DNA和RNA聚合酶、转录因子等进出细胞核,从而在细胞增殖、分化、发育、凋亡、迁移及DNA损伤应答等过程中发挥重要作用[7]。本研究拟通过了解在TNBC组织中Oct-4、SOX2和KPNA2的表达及与TNBC临床病理因素的关系,探讨TNBC的恶性进展机制,为寻求有效抑制TNBC细胞生长的治疗靶点研究提供参考。
1 材料与方法
1.1 材料
1.1.1 临床标本 30例TNBC和30例非TNBC组织石蜡标本均采集自2008年5月—2014年12月大连市中心医院病理科存档标本,患者术前均未接受放疗、化疗、激素或免疫治疗,病理类型均为浸润性导管癌。收集患者年龄、肿块体积、组织学分级、淋巴结转移、有无脉管内癌栓、临床分期、生存期等临床病理资料,随访方式主要采取电话随访,30例TNBC患者的中位随访时间为37(12~62)个月。
1.1.2 实验试剂 Oct4(ab19857)、SOX2(ab97959)和KPNA2(ab84440)兔抗人多克隆抗体均购自Abcam公司,工作浓度均为1:100。SP广谱超敏试剂盒、DAB酶底物显色剂等均购于福建迈新生物技术开发公司。
1.2 方法
1.2.1 免疫组织化学方法 免疫组化SP法及DAB显色操作步骤均按照试剂盒说明书进行。以已知阳性的大肠癌组织切片作为Oct-4和SOX2的阳性对照,子宫内膜癌组织切片作为KPNA2的阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照。
1.2.2 结果判定 组织免疫组化染色结果由2名具有高级职称的病理医师独立进行等级评定,采用半定量法[8-9],根据染色密度(阴性=0,弱阳性=1,中度阳性=2,强阳性=3)和阳性细胞百分比(0: 阴性,1:<25%,2:25%~50%,3:51%~75%,4:>75%)的乘积计算 5个高倍视野的免疫反应评分(immuno-reactive score,IRS)。最后结果:阴性(IRS=0):(-),弱阳性(IRS=1~4):(+),中度阳性(IRS=5~8):(++),强阳性(IRS=9~12):(+++);≥1分为阳性,0分为阴性。
1.3 统计学处理
采用SPSS 17.0统计软件进行数据分析,计数资料采用χ2检验 ,双变量Spearman相关分 析,Kaplan-Meier法绘制生存曲线并经Log-rank检验进行检验。生存时间以月计算,自手术当天起开始计算生存时间,患者死亡或失访定为随访结束点。P<0.05为差异有统计学意义。
2 结 果
2.1 Oct-4、SOX2和KPNA2在TNBC组织中的表达
O c t-4和S O X 2蛋白主要表达在细胞核,KPNA2蛋白在胞浆与胞核均可见阳性表达(图1)。在T N B C和非T N B C组织中O c t-4的阳性表达率分别为86.7%(26/30)和73.3%(22/30)(χ2=9.903,P=0.019),SOX2的阳性表达率分别为90.0%(27/30)和73.3%(22/30)(χ2=7.960,P=0.047),组间差异均有统计学意义;KPNA2的表达在两种癌组织中无统计学差异(χ2=4.190,P=0.242)(表1)。
2.2 TNBC组织中Oct-4、SOX2和KPNA2表达的相关性
Spearman秩相关分析提示在TNBC中Oct-4和SOX2的表达呈正相关(r=0.680,P<0.0001),Oct-4和KPNA2的表达呈正相关(r=0.581,P=0.0008),SOX2和KPNA2的表达亦呈正相关(r=0.770,P<0.0001)(图2)。

图1 免疫组化检测(×200) A:Oct-4;B:SOX2;C:KPNA2;D:阴性对照Figure 1 Immunohistochemical staining (×200) A: Oct-4; B: SOX2; C: KPNA2; D: Negative control
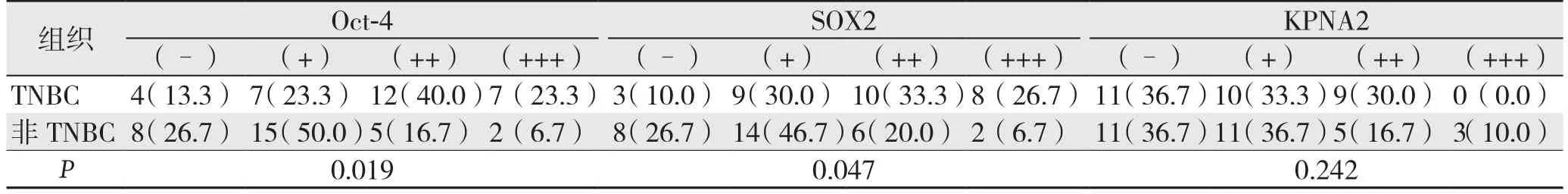
表1 Oct-4、SOX2和KPNA2在TNBC和非TNBC组织中的表达[n=30,n(%)]Table 1 Oct-4,SOX2 and KPNA2 expressions in TNBC and non-TNBC tissues [n=30,n (%)]

图2 Spearman秩相关分析Figure 2 Spearman’s rank correlation analysis
2.3 Oct-4、SOX2和 KPNA2的表达与TNBC临床病理因素的关系
病理分期依据A J C C标准[10]。在T N B C组织中,Oct-4的表达与患者年龄(χ2=5.411,P=0.02)、组织学分级(χ2=6.410,P=0.041)、淋巴结转移(χ2=7.577,P=0.006)和TNM分期(χ2=13.986,P=0.007)均有关,与肿瘤大小、脉管内有无癌栓均无关(均P>0.05);SOX2的表达与淋巴结转移(χ2=11.877,P=0.001)和TNM分期(χ2=13.293,P=0.01)均有关,与患者年龄、肿瘤大小、组织学分级、脉管内有无癌栓均无关(均P>0.05);KPNA2的表达与淋巴结转移有关(χ2=4.460,P=0.035),与其他临床病理因素均无关(均P>0.05)(表2)。

表2 Oct-4、SOX2和KPNA2 表达与TNBC患者临床病理因素的关系[n(%)]Table 2 Relations of Oct-4,SOX2 and KPNA2 expressions with clinicopathologic variables of TNBC patients [n (%)]
2.4 Oct-4、SOX2和 KPNA2的表达与TNBC患者术后生存时间的关系
随访30例TNBC患者,随访时间12~62个月。Oct-4阳性和阴性患者术后中位生存时间分别为27、57个月,SOX2阳性和阴性患者术后中位生存时间分别为29、60个月,KPNA2阳性和阴性患者术后中位生存时间分别为25、57个月。Kaplan-Meier生存曲线亦显示随着Oct-4、SOX2和KPNA2表达的增强,患者术后生存率均明显下降(χ2=14.12,P=0.0027;χ2=16.16,P=0.0011;χ2=12.29,P=0.0021)(图3)。
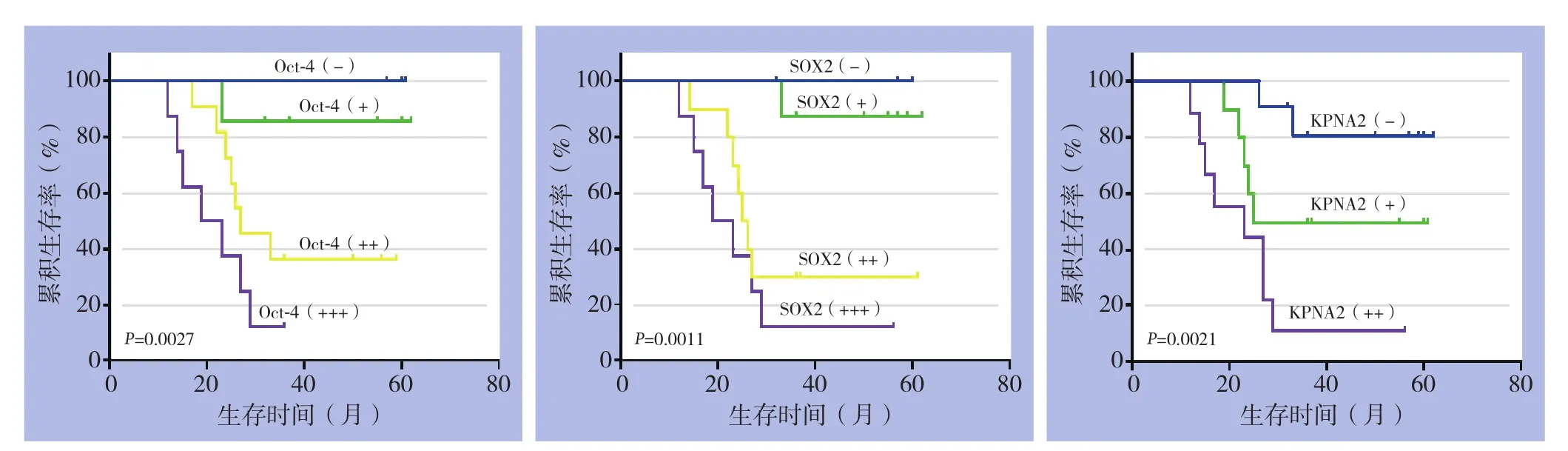
图3 不同Oct-4、SOX2和KPNA2表达状态TNBC患者的生存曲线Figure 3 The survival curves of TNBC patients with diff erent Oct-4,SOX2 or KPNA2 expression statuses
3 讨 论
TNBC作为干细胞性肿瘤其高复发率、耐药以及易转移的特性是患者预后差的主要因素,目前临床上对于TNBC尚无有效治疗措施。在TNBC组织中癌症干细胞的激活机制尚不清楚,如何靶向抑制TNBC的恶性进展成为目前TNBC治疗的难题和关键,因此研究TNBC的发生、发展及侵袭转移等的相关分子机制,具有重要的临床意义。
Oct-4由Pou5F1基因编码产生,定位于人类染色体6p21.3。Oct-4分子中的一个非常保守的DNA结合域-POU(Pit-Oct-Unc)结合域具有细胞特异激活作用,可特异性识别靶基因增强子或启动子区域的八聚体基序ATGCAAAT从而调控下游靶基因的转录[11]。Oct-4的表达与胚胎干细胞的多能性有关,是哺乳动物胚胎发生早期的重要调控因子。随着细胞分化,Oct-4在细胞中的表达逐渐下降,但在多种类型的癌症干细胞如前列腺癌干细胞、乳腺癌干细胞和p53-/-鼠肿瘤模型的肿瘤起始细胞以及化疗后复发的肿瘤组织中均见Oct-4的高表达[12-14],说明Oct-4在癌症干细胞的多潜能性维持和自我更新中发挥重要作用,但机制不清,可能是在肿瘤干细胞中基因表达重新编程的结果。本研究发现,在TNBC组织中Oct-4的表达明显高于非TNBC组织,考虑其可能与TNBC的发生及组织内癌症干细胞过度活化有关。此外,本研究发现Oct-4的表达与患者的年龄、组织学分级、淋巴结转移、TNM分期和生存期等临床病理因素均有关,提示Oct-4可以视为TNBC恶性进展的重要辅助诊断因子。
转录调控因子SOX是维持胚胎内稳态和成年体细胞中干细胞干性的重要因子。该转录因子家族有8个亚群(从A到H)约20个分子,均含有保守的高迁移率族蛋白DNA结合区域,SOX2属于SOXB1亚群(该亚群成员还有SOX1和SOX3)[15]。研究已证实SOX2基因扩增可诱导癌症干细胞的活化和自我更新促进肿瘤的发生发展,SOX2过表达可引起食道癌、卵巢癌、肺癌、皮肤癌等恶性肿瘤[5,16-18],而抑制SOX2的表达可抑制恶性胶质瘤干细胞的更新从而降低恶性胶质瘤细胞的增殖和侵袭能力[19]。本研究发现,SOX2在TNBC中的表达明显高于其在非TNBC中的表达,提示其亦可能与TNBC的发生及组织内癌症干细胞过度活化有关。在有淋巴结转移的TNBC组织中SOX2的表达明显高于无淋巴结转移的TNBC组织,且其表达随着TNM分期的增高而增强,提示SOX2可以促进TNBC的淋巴结转移和侵袭,而淋巴结转移和侵袭能力的增加往往是导致临床治疗失败的主要原因,SOX2的表达增强与患者的生存期缩短明显相关,这些结果提示SOX2亦可被视为TNBC恶性进展的重要辅助诊断因子。目前认为Oct-4和SOX2可形成复合体,通过识别DNA顺式作用元件共同启动干细胞的重新编程从而调控干细胞的多潜能性[20]。本研究发现Oct-4和SOX2的表达呈正相关,从组织学上证实两者在TNBC的恶性进展过程中可能发挥协同作用。
为确保细胞准确行使其各项功能,决定细胞功能与命运的mRNA和转录因子等大分子物质(>50 kDa)的空间定位需要被精细调控。核运输蛋白Importins(又名Karyopherin,KPN)通过识别这些大分子的核定位信号(nuclear localization signal,NLS)帮助它们通过核膜上的核孔复合体进出细胞核,从而在细胞增殖、分化等过程中发挥重要作用[21-22]。KPNA是KPN的主要亚型,目前在人类细胞中已鉴定出7个KPNA成员(KPNA1-7)[23]。关于KPNA在细胞癌变过程中的作用机制还不清楚,但目前的研究结果表明,KPNA家族分子的结构发生变化或过表达可导致其运输的货物分子在胞核或胞浆重新分布。有报道KPNA2参与多种肿瘤相关转录因子如E2F1、c-myc和cyclinD1 等的入核转运促进肿瘤细胞的恶性增殖[24-26],KPNA2还可通过影响p53的核运输及胞浆中的定位,促进细胞增殖相关基因的表达而诱导乳腺癌的发生[27]。本研究发现KPNA2的表达与淋巴结转移和生存期均相关,提示KPNA2的表达可影响TNBC患者的预后。此外KPNA2与Oct-4、KPNA2与SOX2的表达均呈正相关,推测KPNA2可能通过促进Oct-4和SOX2的入核转运从而促进TNBC的恶性发展,但KPNA2是直接与Oct-4和SOX2相互作用还是通过其他因子间接与Oct-4和SOX2相互作用还需进一步研究。
综上所述,Oct-4、SOX2在TNBC组织中的表达增加,与TNBC的发展、侵袭密切相关。Oct-4、SOX2和KPNA2均与淋巴结转移和生存期有关,提示三者可作为TNBC患者预后的重要参考指标。Oct-4、SOX2和KPNA2的表达彼此相关,提示TNBC的恶性进展可能是三者共同作用的结果。Oct-4、SOX2和KPNA2可作为抑制TNBC细胞生长的治疗靶点,但它们精确的作用机制还有待于进一步深入探索。
[1]Perou CM,Sørlie T,Eisen MB,et al.Molecular portraits of human breast tumors[J].Nature,2000,406(6797):747–752.doi:10.1038/35021093.
[2]Syed BM,Green AR,Nolan CC,et al.Biological characteristics and clinical outcome of triple negative primary breast cancer in older women - comparison with their younger counterparts[J].PLoS One,2014,9(7):e100573.doi: 10.1371/journal.pone.0100573.
[3]Tao Y,Mao J,Zhang Q,et al.Overexpression of Hedgehog signalling molecules and its involvement in triple-negative breast cancer[J].Oncol Lett.],2011,2(5):995–1001.doi:10.3892/ol.2011.357
[4]Intawicha P,Siriboon C,Chen CH,et al.Derivation and characterization of putative embryonic stem cells from cloned rabbit embryos[J].Theriogenology,2016,86(7):1799–1810.doi: 10.1016/j.theriogenology.2016.05.035
[5]Boumahdi S,Driessens G,Lapouge G,et al.SOX2 controls tumour initiation and cancer stem-cell functions in squamouscell carcinoma[J].Nature,2014,511(7508):246–250.doi:10.1038/nature13305.
[6]Abubaker K,Luwor RB,Zhu H,et al.Inhibition of the JAK2/STAT3 pathway in ovarian cancer results in the loss of cancer stem cell-like characteristics and a reduced tumor burden[J].BMC Cancer,2014,14:317.doi: 10.1186/1471–2407–14–317.
[7]Yasuhara N,Kumar PK.Aptamers that bind specifically to human KPNA2 (importin-α1) and efficiently interfere with nuclear transport[J].J Biochem,2016,160(5):259–268.doi: 10.1093/jb/mvw032
[8]肖磊,黄昌浩,袁伟杰,等.胃癌组织YAP1、E-cadherin、N-cadherin 表达及临床意义[J].中国普通外科杂志,2018,27(4):442–447.doi:10.3978/j.issn.1005–6947.2018.04.009.Xiao L,Huang CH,Yuan WJ,et al.Expressions of YAP1,E-cadherin and N-cadherin in gastric cancer tissue and their clinical significance[J].Chinese Journal of General Surgery,2018,27(4):442–447.doi:10.3978/j.issn.1005–6947.2018.04.009.
[9]刘鑫宇,贺彦宇,彭创,等.黏蛋白3和黏蛋白4在结石相关肝内胆管细胞癌中的表达及意义[J].中国普通外科杂志,2018,27(2):193–198.doi:10.3978/j.issn.1005–6947.2018.02.010.Liu XY,He YY,Peng C,et al.Mucin-3 and -4 expressions in hepatolithiasis-associated intrahepatic cholangiocarcinoma and their significance [J].Chinese Journal of General Surgery,2018,27(2):193–198.doi:10.3978/j.issn.1005–6947.2018.02.010.
[10]Singletary SE,Connolly JL.Breast cancer staging: working with the sixth edition of the AJCC Cancer Staging Manual [J].CA Cancer J Clin,2006,56(1):37–47.
[11]Kang H,Park JI,Roh S.Murine somatic cell nuclear transfer using reprogrammed donor cells expressing male germ cell-specific genes[J].J Vet Med Sci,2016,78(1):149–152.doi: 10.1292/jvms.14–0596.
[12]Emura N,Sakurai N,Takahashi K,et al.OCT-4 expression is essential for the segregation of trophectoderm lineages in porcine preimplantation embryos[J].J Reprod Dev,2016,62(4):401–408.doi: 10.1262/jrd.2016–040.
[13]Jiang MY,Lee TL,Hao SS,et al.Visualization of early prostatic adenocarcinoma as a stem cell disease[J].Oncotarget,2016,7(46):76159–76168.doi: 10.18632/oncotarget.12709.
[14]Darini CY,Pisani DF,Hofman P,et al.Self-renewal gene tracking to identify tumour-initiating cells associated with metastatic potential[J].Oncogene,2012,31(19): 2438–2449.doi: 10.1038/onc.2011.421.
[15]Sarkar A,Hochedlinger K.The sox family of transcription factors:versatile regulators of stem and progenitor cell fate[J].Cell Stem Cell,2013,12(1):15–30.doi: 10.1016/j.stem.2012.12.007.
[16]Shafiee M,Aleyasin SA,Vasei M,et al.Down-Regulatory Effects of miR-211 on Long Non-Coding RNA SOX2OT and SOX2 Genes in Esophageal Squamous Cell Carcinoma[J].Cell J,2016,17(4):593–600.
[17]Belotte J,Fletcher NM,Alexis M,et al.Sox2 gene amplification significantly impacts overall survival in serous epithelial ovarian cancer[J].Reprod Sci,2015,22(1):38–46.doi:10.1177/1933719114542021.
[18]Rudin CM,Durinck S,Stawiski EW,et al.Comprehensive genomic analysis identifies SOX2 as a frequently amplified gene in small-cell lung cancer[J].Nat Genet,2012,44(10):1111–1116.doi: 10.1038/ng.2405.
[19]Carrasco-Garcia E,Arrizabalaga O,Serrano M,et al.Increased gene dosage of Ink4/Arf and p53 delays age-associated central nervous system functional decline[J].Aging Cell,2015,14(4):710–714.doi:10.1111/acel.12343
[20]Sawan C,Hernandez-Vargas H,Murr R,et al.Histone acetyltransferase cofactor Trap maintains self-renewal and restricts differentiation of embryonic stem cells[J].Stem Cells,2013,31(5):979–991.doi: 10.1002/stem.1341.
[21]Cautain B,Hill R,de Pedro N,et al.Components and regulation of nuclear transport processes[J].FEBS J,2015,282(3):445–462.doi:10.1111/febs.13163.
[22]von Appen A,Kosinski J,Sparks L,et al.In situ structural analysis of the human nuclear pore complex[J].Nature,2015,526(7571):140–143.doi: 10.1038/nature15381.
[23]Laitman BM,Mariani JN,Zhang C,et al.Karyopherin Alpha Proteins Regulate Oligodendrocyte Differentiation[J].PLoS One,2017,12(1):e0170477.doi: 10.1371/journal.pone.0170477.
[24]Kim NH,Yoshimaru T,Chen YA,et al.BIG3 Inhibits the Estrogen-Dependent Nuclear Translocation of PHB2 via Multiple Karyopherin-Alpha Proteins in Breast Cancer Cells[J].PLoS One,2015,10(6):e0127707.doi: 10.1371/journal.pone.0127707.
[25]Nastasie MS,Thissen H,Jans DA,et al.Enhanced tumour cell nuclear targeting in a tumour progression model[J].BMC Cancer,2015,15:76.doi: 10.1186/s12885–015–1045-z.
[26]Huang L,Wang HY,Li JD,et al.KPNA2 promotes cell proliferation and tumorigenicity in epithelial ovarian carcinoma through upregulation of c-Myc and downregulation of FOXO3a[J].Cell Death Dis,2013,4:e745.doi: 10.1038/cddis.2013.256.
[27]Miyamoto Y,Oka M.Data on dimer formation between importin α subtypes[J].Data Brief,2016,7:1248–1253.doi: 10.1016/j.dib.2016.03.080.
