不同分子标记物在甲状腺乳头状癌中的表达改变及其诊断价值
2018-06-05汤文丽高庆军赵代伟
汤文丽,高庆军,赵代伟
(1.贵州医科大学附属医院 甲状腺外科,贵州 贵阳 550004;2.贵州医科大学第二附属医院 甲状腺外科,贵州 凯里 556000)
随着高清晰超声在临床中广泛应用,甲状腺结节的检出率逐年升高,良恶性甲状腺结节的临床处理不同,同时对患者的生存质量的影响以及涉及的医疗费用也存在显著的差异,因此甲状腺结节的良恶性诊断尤为重要[1]。但由于甲状腺不典型恶性增生的组织及细胞学特点与良性增生鉴别较困难,特别是甲状腺乳头状癌(PTC)与良性甲状腺结节(BTN)有部分病例单纯通过组织病理学检查不能明确诊断[2-3]。现已有多种针对特定疾病的免疫组化分子标记物在PTC及BTN的鉴别中有独到之处[4-5]。尽管有些标记物在鉴别甲状腺结节的良恶性中表现出较好的敏感性及特异性,但由于不同标记物的都存在其诊断上的局限性,至今未能找出单独某种分子标记物为其可靠的检测物[6]。大多数研究建议行联合诊断的推断也并未给出直观的统计学数据。本研究通过ROC曲线及二元Logistic统计学方法分别及联合计算CK19、Galectin-3、HBME-1、TPO及Ki-67在甲状腺良恶性病变中的表达情况,直观的比较出相对最有价值的免疫组化标记物检测组合。
1 材料与方法
1.1 临床资料
选取贵州医科大学2014年1月—2016年3月行手术治疗并常规组织病理学检查明确诊断病例标本蜡块共252例,剔除甲状腺滤泡癌、未分化癌、髓样癌、转移癌等病例后最终选取诊断为BTN 115例,PTC 85例。患者资料包括性别、年龄和组织病理学结果,其中良恶性中男女比例均为1:3。BTN中患者年龄在16~79岁之间,中位数年龄48岁;PTC中患者年龄在13~76岁之间,中位数年龄45岁。上述患者术前均未行放化疗治疗,术后常规组织学病理报告均由2名高年资病理科医师审核后出具。
1.2 免疫组织化学检测
1.2.1 标本处理及染色步骤 将石蜡标本进行切片、制片。使用SP免疫法根据试剂要求进行抗原修复、封闭内源性过氧化物酶活性及抗原抗体反应,使用二氨基联苯胺色原体(DAB)溶液显色。每种分子标记物单独设置一组用PBS液替代一抗的阴性对照组(以上试剂均购至福州迈新公司,所有试剂均在有效期内并按照说明书妥善保存,进行实验前已行预实验证明抗体活性良好)。
1.2.2 结果判定 与PBS代替一抗的阴性组进行对照,CK19、Ki-67及TPO染色均以细胞浆出现的棕黄色颗粒为阳性标准,Galectin-3染色以细胞浆或细胞核出现的棕黄色颗粒为阳性标准;HBME-1染色以细胞膜出现棕黄色颗粒为阳性标准。参考Cheung等[7]介绍的方法,根据着色程度和范围,以无着染细胞或着染细胞数<10%为(-),着染细胞数10%~25%为(+),着染细胞数25%~50%为(++),着染细胞数50%~75%为(+++),着染细胞数≥75%为(++++)。为方便计算,按阳性细胞数百分比及着色强度分为5级。并依次赋予0、1、2、3、4分。由于TPO为阳性时倾向于良性诊断,其余3种分子标记物为阳性时倾向于恶性诊断,故将TPO的阳性程度与评分负对应处理,方便后续计算。本次研究中Ki-67其百分比均不高,听取高年资病理科医师建议后,以≤1%时记0分,≤3%时记1分,≤5%时记2分,≤7%时记3分,>7%时记4分。切片染色后均由高级病理医师双盲阅片。阅片后剔除双盲阅片结果差异较大及染色效果不佳判定困难标本。
1.3 统计学处理
统计计算使用SPSS 22.0及Madcalc 12.7.0.0软件进行。非参数Mann-Whitney法检验单个免疫组化标记物在PTC及BTN中表达上的差异。受试者工作特征曲线(ROC)比较评估单一或联合免疫标记物的诊断性能,确定诊断恶性肿瘤的最佳截断点(cut-off)并计算出单独及联合标检测分子标记物诊断的特异性、敏感性、阳性预测值(PPV)和阴性预测值(NPV),通过Fisher精确检验计算其显著性。再将联合组筛选后利用Medcalc软件进行两两组间ROC曲线结果的比较,采用非参数Z检验法。显著性差异的检验标准设定为α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 各分子标记物的表达情况
分别检测CK19、Galectin-3、HBME-1、TPO及Ki-67在PTC与BTN中的表达水平。PTC中呈广泛胞浆及包膜着色的为CK19,胞浆着色的为Galectin-3,包膜特别是腔面着色的为HBME-1,仅胞核着色的为Ki-67,TPO呈阴性。BTN中可见胞浆染色且呈局灶阳性或阴性的为及胞浆强阳性的为TPO,呈阴性或弱阳性的为CK19、Galectin-3、H B M E-1及K i-6 7。统计分析显示,C K 1 9、Galectin-3、HBME-1及Ki-67在PTC中表达明显高于BTN中的表达(均P<0.001),TPO因其反向赋值,结合检验分析得出其在BTN中表达明显高于PTC(P<0.001)(图1)。
2.2 各分子标记物的诊断效能
通过ROC曲线找到截断值并计算出特异性、敏感性、PPV、NPV(图2)(表1):⑴ TPO的曲线面积(AUC)最大,为0.943,其截断值≥1.5,特异性、敏感性、PPV、NPV分别为92.2%、92.9%、89.8%、94.6%;⑵ Galectin-3的AUC为0.869,其截断值≥3.0,特异性、敏感性、PPV、NPV分别为77.4%、94.4%、76.1%、94.7%;⑶ HBME-1的AUC为0.838,其截断值≥3.0,特异性、敏感性、PPV、NPV分别为77.7%、86.6%、74.7%、88.9%;⑷ CK19的AUC为0.753,其截断值≥3.0,特异性、敏感性、PPV、NPV分别为51.3%、100.0%、60.7%、100.0%;⑸ Ki-67的AUC为0.728,其截断值≥0.5,特异性、敏感性、PPV、NPV分别为66.4%、76.3%、61.7%、79.8%。由截断值可计算出5种分子标记物在PTC中表达的阳性率[7](表2)。
2.3 不同分子标记物组合的诊断效能
使用二元Logistic回归公式联合不同分子标记物行多种组合后带入ROC曲线再次进行计算并比较(表3)。两种免疫组化分子标记物联合时Galectin3/TPO组合其AUC最大,为0.987,其特异性、敏感性、PPV和NPV分别为92.5%、97.2%、90.8%、97.7%。3种免疫组化分子标记物联合时Galectin3/TPO/Ki-67组合其AUC最大,为0.991,其特异性、敏感性、PPV和NPV分别为95.4%、98.4%、93.8%、98.8%。4种免疫组化分子标记物联合时Galectin3/HBME-1/TPO/Ki-67组合其AUC最大,为0.994,其特异性、敏感性、PPV和NPV分别为96.5%、96.7%、95.1%、97.6%。而在行5种分子标记物联合的统计计算时发现其AUC较所有组合最大,为0.996,其特异性、敏感性、PPV和NPV分别为96.4%、96.7%、95.1%、97.6%,较其他组合价值更大(图3)。根据表3计算Galectin-3/TPO组合与HBME-1/TPO组合的Youden指数(敏感性+特异性-1)分别为0.897及0.832。
将5组免疫组化分子标记物联合的组合与4种免疫组化分子标记物联合中A U C值最大的Galectin-3/HBME-1/TPO/Ki-67组合,3种免疫组化分子标记物联合中AUC最大的Galectin-3/HBME-1/TPO组合,2种免疫组化分子标记物联合中AUC最大的Galectin-3/TPO组合分别进行两两ROC曲线结果的Z检验:⑴ CK19/Galectin-3/HBME-1/TPO/Ki-67组合与Galectin-3/HBME-1/TPO/Ki-67组合的ROC曲线结果进行检验,差异无统计学意义(P=0.1062);⑵ CK19/Galectin-3/HBME-1/TPO/Ki-67组合与Galectin-3/HBME-1/TPO组合的ROC曲线结果进行检验,差异无统计学意义(P=0.1636);⑶ CK19/Galectin-3/HBME-1/TPO/Ki-67组合与Galectin-3/TPO组合的ROC曲线结果进行检验,差异无统计学意义(P=0.1215);⑷ CK19/Galectin-3/HBME-1/T P O/K i-6 7组合与C K 1 9/T P O/K i-6 7组合的R O C曲线结果进行检验,差异有统计学意义(P=0.0359);⑸ Galectin-3/HBME-1/TPO/Ki-67组合与Galectin-3/HBME-1/TPO组合的R O C曲线结果进行检验,差异无统计学意义(P=0.3541);⑹ Galectin-3/HBME-1/TPO/Ki-67组合与Galectin-3/HBME-1/TPO组合的ROC曲线结果进行检验,差异无统计学意义(P=0.2620);⑺ Galectin-3/HBME-1/TPO组合与Galectin-3/TPO组合的ROC曲线结果进行检验,差异无统计学意义(P=0.5676);⑻ Galectin-3/TPO组合与HBME-1/TPO组合的ROC曲线结果进行检验,差异无统计学意义(P=0.7182);⑼ Galectin-3/TPO组合与TPO的ROC曲线结果进行检验,差异有统计学意义(P=0.0054)(表4)。
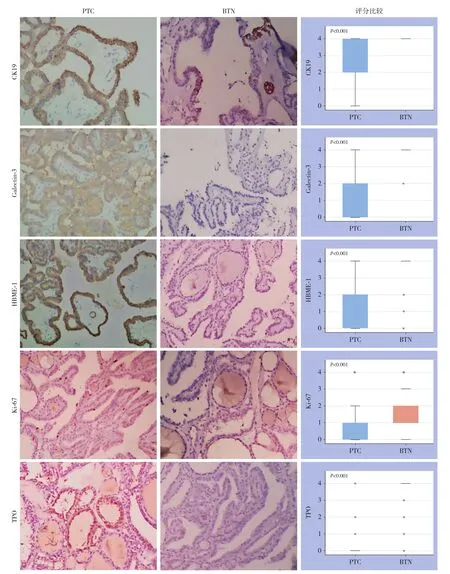
图1 各分子标记物的免疫组化检测情况(×400)Figure 1 Immunohistochemical staining for each molecular marker (×400)

图2 各分子标记为独立检测的ROC曲线Figure 2 ROC curves of detections of each molecular marker
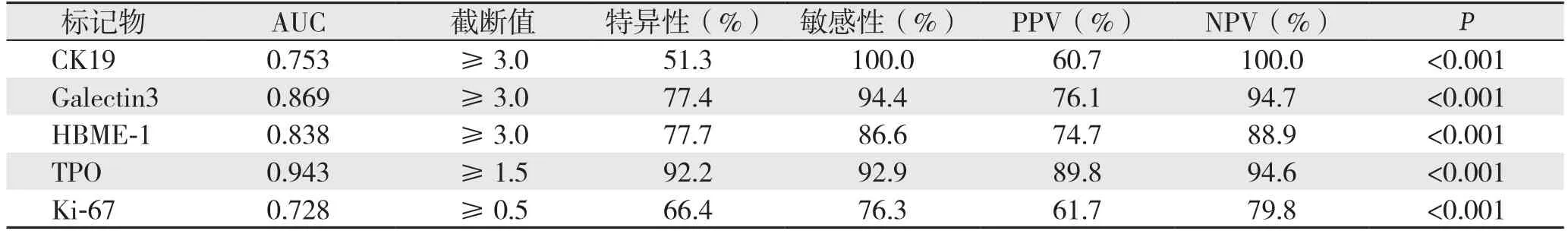
表1 各分子标记物诊断性能指标Table 1 The variables for diagnostic efficiency of each molecular marker
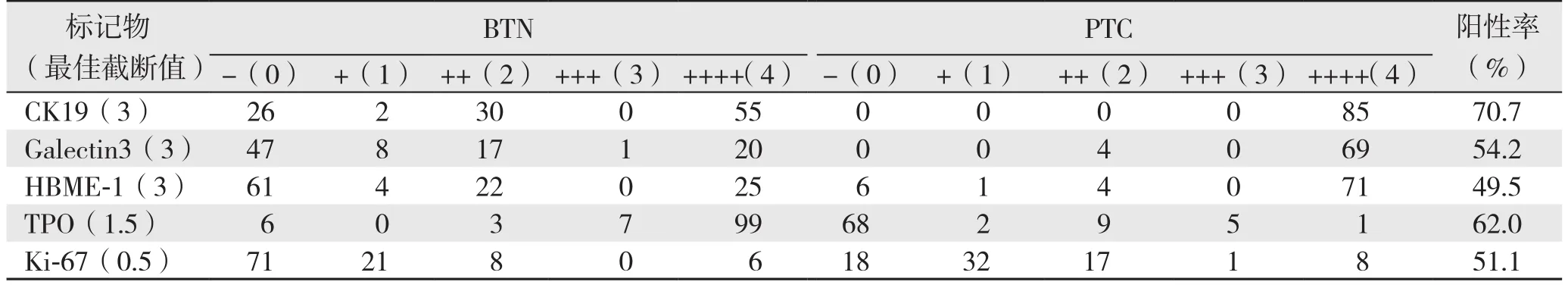
表2 根据最佳截断点计算的5种分子标记物在PTC中表达的阳性率Table 2 The positive expression rates of the 5 molecular markers in PTC based on their best cut-off values
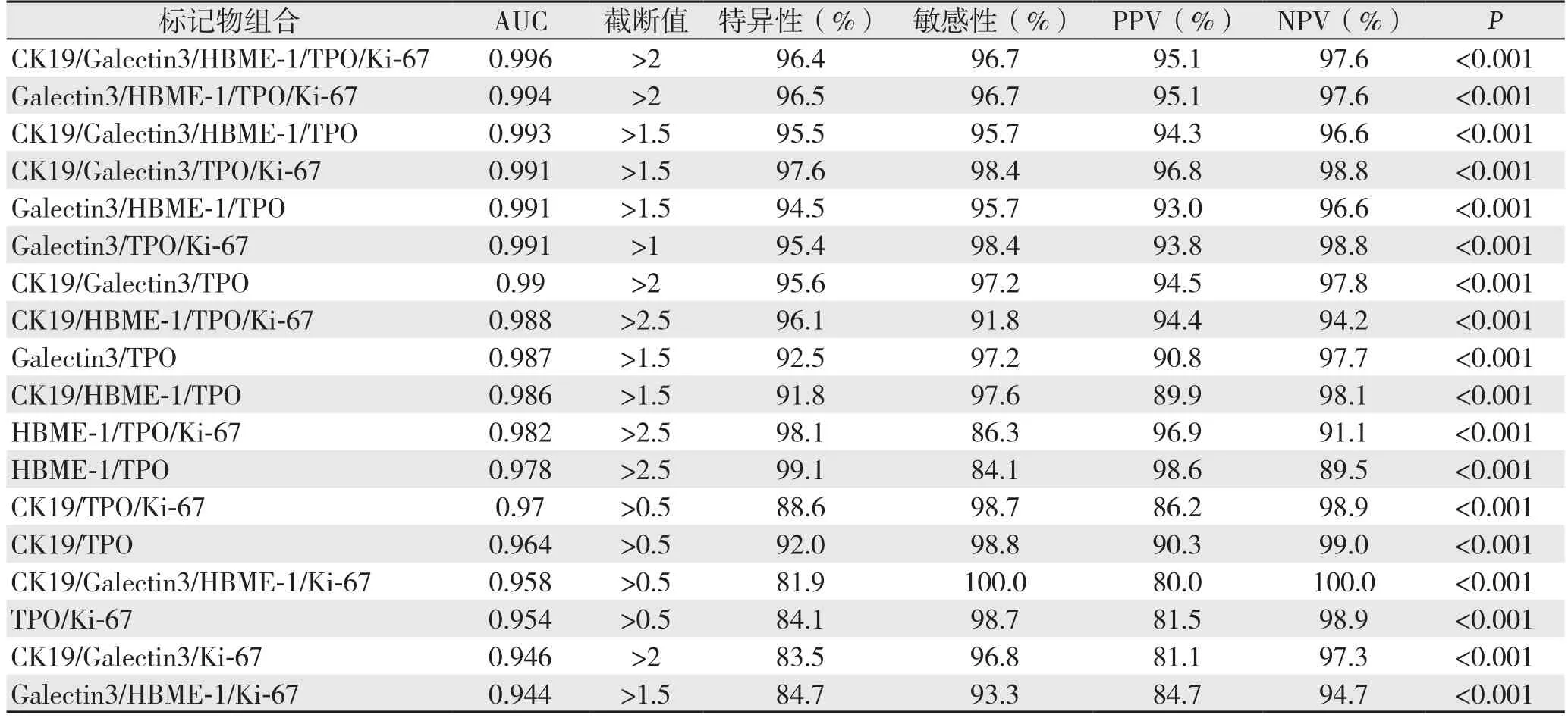
表3 5种分子标记物不同组合方式的诊断性能指标Table 3 The variables for diagnostic efficiency of different combinations among the 5 molecular markers
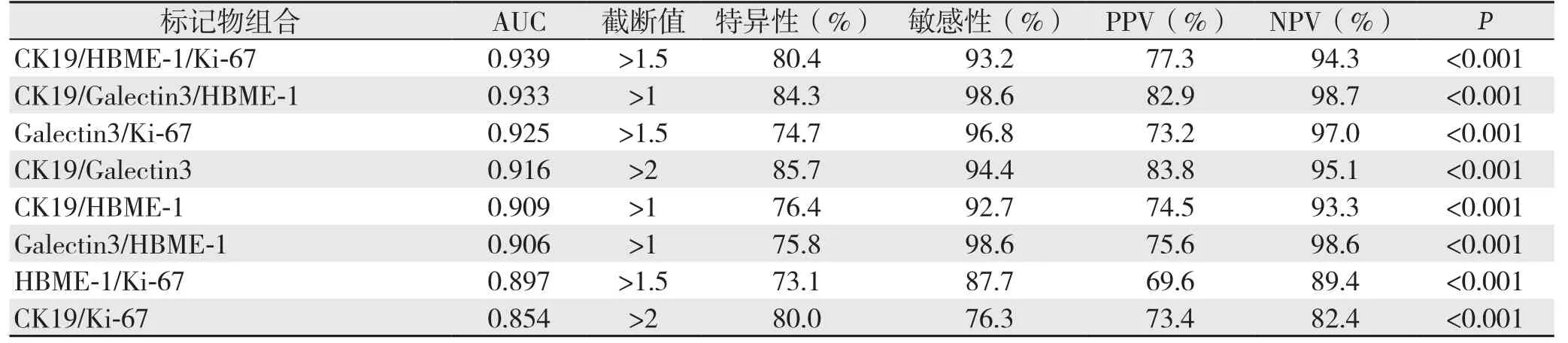
表3 5种分子标记物不同组合方式的诊断性能指标(续)Table 3 The variables for diagnostic effi ciency of diff erent combinations among the 5 molecular markers (continued)

图3 5种分子标记物联合检测ROC曲线Figure 3 ROC curve of the combination detection of the 5 molecular markers

表4 各种不同组合的两两比较Table 4 pairwise comparison between each diff erent combination
3 讨 论
ROC曲线是通过同种诊断不同截断点计算出的敏感性及特异性绘制出ROC曲线,根据AUC判断其诊断价值。在AUC>0.5的情况下,AUC越接近于1,其诊断效果越好,诊断价值越大。AUC在0.5~0.7时其准确性较低,AUC在0.7~0.9时有一定的准确性,AUC在0.9以上时有较高准确性。AUC=0.5时,表示该诊断方法阳性和阴性结果随机,完全没有诊断能力,无诊断价值。AUC若<0.5则越小证明该诊断结果与该疾病呈负相关[8]。
CK19是一种低分子量细胞角蛋白,其不止在大多数PTC中呈弥漫强烈的阳性,BTN中多呈阴性,在少数BTN病例中也可呈灶性弱阳性,且在所有滤泡状癌和髓样癌中均为阴性[9]。因此,CK19弱阳性不具特异性,而CK19弥漫强阳性有助于PTC的诊断[10]。其ROC曲线计算出AUC为0.753>0.5,有一定的诊断价值。又因其在PTC及BTN中阳性率均较高,但在PTC中均呈弥漫阳性表达,故其阴性时对于排除PTC有重要作用,但呈阳性时特异性不高,如想进一步提高诊断准确性则有必要联合其他分子标记物进行协助诊断。Galectin-3属凝集素蛋白家族成员。大量研究证实其有助于甲状腺良、恶性乳头状增生的鉴别,是一个有价值的标记蛋白。带入ROC曲线计算出AUC为0.869>0.5,有一定诊断价值。因其并非只在甲状腺肿瘤中能检测出表达上调情况,其在增生的上皮细胞及炎症细胞中也存在高表达情况[11]。因其敏感性较低,故单独检测时其鉴别价值不大,但特异性较高,故其阴性时排除恶性增生价值大。HBME-1在大多数上皮型间皮瘤细胞膜上呈强阳性表达,在甲状腺乳头状癌中呈高表达[12-13]。可以将检测HBME-1作为辅助手段[14]。带入ROC曲线计算出AUC为0.838>0.5,有一定诊断价值。但其特异性不如Galectin-3,故单独诊断效果不理想。TPO在PTC中常常低表达或不表达,而在正常甲状腺组织及甲状腺良性状增生等分化良好的甲状腺组织中表达[15-16]。带入ROC曲线计算出AUC为0.943>0.5,有较高诊断价值,且为五种免疫组化分子标记物中诊断价值最高的。就结果来看TPO在BTN中呈高达,但在PTC中亦有阳性表达,故其检测呈阳性时排除恶性的准确度不高,但其为阴性时可基本排除良性可能。对于鉴别良恶性甲状腺增生特别是相对于其他几种免疫组化分子标记物仍然具有很强的诊断能力。人Ki-67蛋白的表达与细胞增殖密切相关,是确定细胞生增生状态的极好标记物,可以作为诊断甲状腺结节良恶性的一项辅助指标[11]。带入ROC曲线计算出AUC为0.728>0.5,有一定诊断价值,对于辅助其他分子标记物进行甲状腺增生的增殖状态的了解具有一定价值。将其与其他免疫组化分子标记物联合应用时均能提高诊断的敏感性及特异性,说明Ki-67虽然在单独诊断方面无较强价值,但却是较好的行联合诊断的免疫组化分子标记物选择。
免疫组化分子标记物进行两两联合诊断时Galectin3/TPO的AUC值最大,且其单独行ROC曲线计算时也为5种免疫组化分子标记物中最大的两种,说明在两种免疫组化分子标记物进行联合诊断时其诊断价值最高,但仅仅通过简单对比AUC值则忽略了样本误差,通过各个组合及单个免疫组化分子标记物的ROC曲线结果的统计学比较发现,Galectin-3/TPO组合与5种、4种及3种联合的AUC值最大组在统计学比较上其AUC值无统计学差异,但与单个免疫组化分子标记物AUC值最大的TPO比较其差异具有统计学意义,说明Galectin-3/TPO较单个免疫组化分子标记物的诊断价值高,与多个分子标记物的组合中AUC值较大的组间无统计学差异。再将Galectin-3/TPO与HBME-1/TPO进行组间比较发现,差异无统计学意义(P>0.05),但进行Youden指数比较时发现Galectin-3/TPO组合的Youden指数大于HBME-1/TPO组合,可得Galectin-3/TPO组合其真实性较HBME-1/TPO组合强。故结合临床工作的应用价值,联合Galectin-3及TPO进行检测时对于鉴别PTC及BTN较其他免疫组化分子标记物价值高。
手术前行粗针或细针穿刺行细胞学检查为术前甲状腺结节性质诊断的金标准,但仍有数量可观的患者无法在术前明确甲状腺结节的性质,如果使用多种免疫组化分子标记物则需要细胞数量较多,耗费较大的成本,如果能筛选出一种或两种价值较好的免疫组化分子标记物则有望能应用于术前甲状腺结节性质的诊断和鉴别。由于Galectin-3/TPO与其他AUC值比其大的分子标记物组合具有相似的诊断价值,且通过统计学比对为两种联合中最优组,且较单个免疫组化分子标记物有明显的统计学优势,故选取该组合为鉴别PTC及BTN最有价值的组合。
结合临床工作中需考虑实验成本、耗时、患者的诊疗体验等情况,检测的免疫组化分子标记物太多不仅会浪费资源及时间,而且与循证医学常用的一元论相悖,将简单问题复杂化。本研究为了便于术前诊断,经过统计学比较并综合考虑临床应用价值,得出联合Galectin-3及TPO进行检测为最有鉴别PTC及BTN的诊断价值的免疫组化分子标记物组合。
[1]Haugen BR,Alexander EK,Bible KC,et al.2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J].Thyroid,2016,26(1):1–133.doi:10.1089/thy.2015.0020.
[2]Gharib H,Papini E.Thyroid nodules: clinical importance,assessment,and treatment[J].Endocrinol Metab Clin North Am,2007,36(3):707–735.
[3]Sanuvada R,Nandyala R,Chowhan AK,et al.Value of cytokeratin-19,Hector Battifora mesothelial-1 and galectin-3 immunostaining in the diagnosis of thyroid neoplasms[J].J Lab Physicians,2018,10(2):200–207.doi: 10.4103/JLP.JLP_106_17.
[4]Murtezaoglu AR,Gucer H.Diagnostic value of TROP-2 expression in papillary thyroid carcinoma and comparison with HBME-1,galectin-3 and cytokeratin 19[J].Pol J Pathol,2017,68(1):1–10.doi: 10.5114/pjp.2017.67610.
[5]Mseddi M,Ben Mansour R,Gouiia N,et al.A comparative study of nuclear 8-hydroxyguanosine expression in Autoimmune Thyroid Diseases and Papillary Thyroid Carcinoma and its relationship with p53,Bcl-2 and Ki-67 cancer related proteins[J].Adv Med Sci,2017,62(1):45–51.doi: 10.1016/j.advms.2016.06.003.
[6]Arcolia V,Journe F,Renaud F,et al.Combination of galectin-3,CK19 and HBME-1 immunostaining improves the diagnosis of thyroid cancer[J].Oncol Lett,2017,14(4):4183–4189.doi: 10.3892/ol.2017.6719.
[7]Cheung C C,Ezzat S,Freeman J L,et al.Immunohistochemical diagnosis of papillary thyroid carcinoma[J].Mod Pathol,2001,14(4):338–342.
[8]冯国双,刘德平.医学研究中的Logistic回归分析及SAS实现[M].北京: 北京大学医学出版社,2012:81.Feng GS,Liu DP.Logistic regression analysis in medical research and SAS realization[M].Beijing: Peking University Medical Press,2012:81.
[9]Palo S,Biligi DS.Differential diagnostic significance of HBME-1,CK19 and S100 in various thyroid lesions[J].Malays J Pathol,2017,39(1):55–67.
[10]刘剑鸣,王志明,李新营.甲状腺癌分子生物学的研究进展[J].中国普通外科杂志,2010,19(5):564–568.Liu JM,Wang ZM,Li XY.Research advances in molecular biology of thyroid cancer[J].Chinese Journal of General Surgery,2010,19(5):564–568.
[11]Yılmaz E,Karşıdağ T,Tatar C,et al.Serum Galectin-3: diagnostic value for papillary thyroid carcinoma[J].Ulus Cerrahi Derg,2015,31(4):192–196.doi: 10.5152/UCD.2015.2928.
[12]Liu Z,Yu P,Xiong Y,et al.Significance of CK19,TPO,and HBME-1 expression for diagnosis of papillary thyroid carcinoma[J].I Int J Clin Exp Med,2015,8(3):4369–4374.
[13]Gucer H,Bagci P,Bedir R,et al.The Value of HBME-1 and Claudin-1 Expression Profile in the Distinction of BRAF-Like and RAS-Like Phenotypes in Papillary Thyroid Carcinoma[J].Endocr Pathol,2016,27(3):224–232.doi: 10.1007/s12022–016–9433–8.
[14]黄堃,龚卫东,王南鹏,等.galectin-3、HBME-1、CK19及RET在甲状腺肿瘤中的表达情况及其临床价值[J].中国普外基础与临床杂志,2013,20(2):156–160.doi: 10.7507/1007–9424.20130043.Huang K,Gong WD,Wang NP,et al.Expressions of Galectin-3,HBME-1,CK19,and RET in Benign and Malignant Thyroid Tumor and Their Clinical Significances[J].Chinese Journal of Bases and Clinics In General Surgery,2013,20(2):156–160.doi:10.7507/1007–9424.20130043.
[15]Savin S,Cvejic D,Isic T,et al.Thyroid peroxidase and galectin-3 immunostaining in differentiated thyroid carcinoma with clinicopathologic correlation[J].Hum Pathol,2008,39(11):1656–1663.doi: 10.1016/j.humpath.2008.04.006.
[16]Di Cristofaro J,Silvy M,Lanteaume A,et al.Expression of tpo mRNA in thyroid tumors: quantitative PCR analysis and correlation with alterations of ret,Braf,ras and pax8 genes[J].Endocr Relat Cancer,2006,13(2):485–495.
