催化H2O2氧化吖啶黄固体基质室温磷光法测定痕量秋水仙碱
2018-06-01孙莉娜林常青郑志勇
孙莉娜,林常青,郑志勇
(漳州职业技术学院食品工程学院,福建,漳州 363000)
秋水仙碱(Colchicine,COL)不仅能用于治疗痛风及某些恶性肿瘤[1],而且可预防与治疗家族性地中海热、肾脏、某些皮肤病及纤维化性疾病等[2],显示了较好的应用前景。医学报告显示,对于成年人来说,超过0.8 mg/kg的COL通常是致命的,研究报告口服药物秋水仙碱最低的致命剂量是 7~26 mg[3-4]。显然,COL与人体疾病密切相关,在临床上具有重要的应用价值。
近年来,COL的测定有荧光法(检出限(LD) 是[5]、HPLC 法[7]、超高效液相色谱-串联质谱法(UPLC-MS/MS)(LD 为5.0×10–11g·mL–1)[8]、伏安法[9]和薄层色谱法[10]等。然而,这些检测方法中有的需要使用有毒有害的有机溶剂,有的由于设备昂贵,且操作繁琐、分析成本较高而不利于推广应用[11]。如:HPLC/MS、HPLC需用有毒有害的有机溶剂萃取,操作繁琐;伏安法、薄层色谱法与荧光法等的LD高,灵敏度低,在药代动力学研究中难以满足对COL检测的需要[8];虽然 UPLC-MS/MS灵敏度高,但使用的仪器昂贵,分析成本高,应用范围有限。因此,探索一种高灵敏度、简易、快速、低成本的检测 COL新方法是极其有意义和价值的。由于固体基质室温磷光法(SS-RTP)比常见的荧光或磷光检测手段更具有Stokes位移大、容易减少或消除本底荧光和散射干扰、发光寿命长、检测的选择性更好等优点,人们开发了一系列的SS-RTP用于有机分子[12-14]、生物活性物质[15-20]和有毒离子[21-22]等检测,显示了SS-RTP的潜在应用前景。
实验研究发现,以 Pb2+为微扰剂时,吖啶黄(AY)在聚酰胺素膜(PAM)固体基质上发射强而稳定的室温磷光信号(RTP)信号。在100℃反应10 min条件下,COL可催化H2O2氧化AY的反应,导致AY的RTP信号猝灭,且ΔIp值与COL含量呈线性关系,据此提出了催化SS-RTP法测定痕量COL的新方法。该方法的LD为0.037 fg·spot–1(样品量为 0.40 μL/斑,对应浓度为 9.3×10–14g·mL–1), 比已报道的方法的检出限(5.0×10–11g·mL–1)[8]低,这种灵敏、准确、重现性与选择性好的SS-RTP鲜见文献报道,更适用于人血清中痕量秋水仙碱的分析。这种新方法的建立和应用的研究,将有利于推动COL检测技术的进一步发展。
1 实验部分
1.1 仪器及试剂
LS-55型荧光分光光度计(Perkin Elmer公司),其仪器参数分别为:延迟时间0.1 ms,门控时间2.0 ms,循环时间20 ms,积分值1,激发狭缝10 nm,发射狭缝10 nm,扫描速度 1500 nm/min;固体前表面处理器(Perkin Elmer公司);0.50 µL平头微量注射器(上海医用激光仪器厂);AE240型电子分析天平(梅特勒-托利多仪器有限公司)。
COL 工作液(先配成 10.0 μg·mL–1COL 的储备液,临用时逐级稀释成 1.0 ng·mL–1、100.0 pg·mL–1和 10.0 pg·mL–1的 COL 溶液作为工作液)、1.0×10–4mol·L–1吖啶黄(AY)、2% (w/v) H2O2溶液、1.00 mol·L–1Pb2+溶液、三次石英亚沸蒸馏水。其中除 COL试剂为基准试剂以外,其它试剂均为分析纯。
定量滤纸(购买杭州新华纸业有限公司)。聚酰胺膜(PAM)、硝酸纤维素膜(NCM)、醋酸纤维素膜(ACM)(均购买路桥四甲生化塑料厂)。滤纸均先剪切成Ф = 1.5 cm圆片,压痕(Ф = 4.0 mm),以备用。
1.2 实验方法
往25 mL比色管中加入适量COL、1.00 mLAY、4.00 mLH2O2,用蒸馏水定容,摇匀。于100 ℃下反应10 min,流水冷却5 min。将PAM放入1.00 mol·L–1Pb2+溶液中浸泡10 s后,在(90 ± 1)℃温度下干燥2 min,再用0.50 µL规格的平头微量注射器悬空点样 0.40 µL,继续在(90 ± 1)℃温度下干燥 2 min,同时作试剂空白试验。在442 nm和507 nm处测定试剂空白(无秋水仙碱时)的磷光信号与催化反应试液的磷光信号Ip值 ,求出。
2 结果与讨论
2.1 磷光光谱
扫描COL-H2O2-AY体系磷光光谱(图1)可知,用PAM作固体基质,且在Pb2+的微扰下,AY会发射出强而稳定的RTP信号(= 471.2/644.9 nm,Ip = 182.5,曲线1.1’);当2存在时,AY的RTP发生猝灭(= 71.5/645.3 nm,Ip = 171.6,曲线2.2’);往体系中添加1000.0 pg COL溶液时,AY的RTP发生剧烈猝灭(λex/λem = 471.0/643.2 nm,Ip = 55.0,曲线 4.4’),其= 116.6,比非催化反应体系的(10.9)大10.7倍,且与COL的含量存在着线性关系,为催化SSRTP测定COL含量提供了可能性。

图1 COL -H2O2-AY 磷光光谱Fig.1 COL -H2O2-AY phosphorescence spectrum
2.2 表观活化能(Ea)和速率常数(k)的测定
为了证明COL催化H2O2氧化AY的反应可能,在最佳条件下考察了催化反应的表观活化能(Ea)和速率常数(k)。针对 4.8 fg·spot–1的 COL 溶液,进行反应温度与反应时间对体系ΔIp值的影响情况的探讨,结果显示:当t = 10 min时,反应温度在60~100(℃) 范围内与–成正比,其回归方程为=1.819×(1/T)×1000 –3.903 , r =0.9966。当T = 100°C时ΔIp最大,且表观活化能E= 40.53 kJ ·mol–1;当 T =100℃时,反应时间在 4~10(min)范围内能与成线性关系,且呈一级反应关系,该回归方程为 ln= –0.0732 +0.0306 t (min),r = 0.9975。其中 10 min时最大,此时速率常数 k = 3.97×10–4s–1,这些都说明了 COL对氧化AY是有催化效应。
2.3 测定条件的选择
对体系中 4.8 fg·spot–1的 COL 溶液,分别探讨各种试剂的浓度与用量、氧化剂、固体基质、离子微扰剂、反应酸度、反应温度和时间、通或不通干燥的 N2和放置时间等条件对体系 ΔIp的影响,结果如图2~12所示。

图2 AY浓度对ΔIp的影响Fig.2 The influence of AY concentration on ΔIp
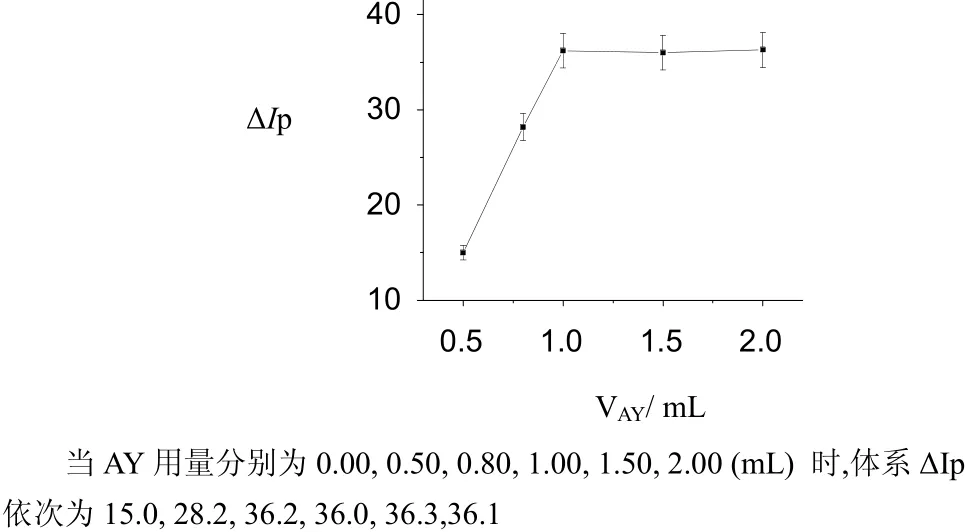
图3 AY用量对ΔIp的影响Fig.3 The influence of AY amount on Δip
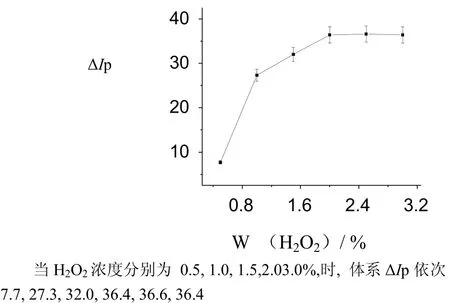
图4 H2O2浓度对ΔIp的影响Fig.4 The influence of H2O2 concentration on Δip
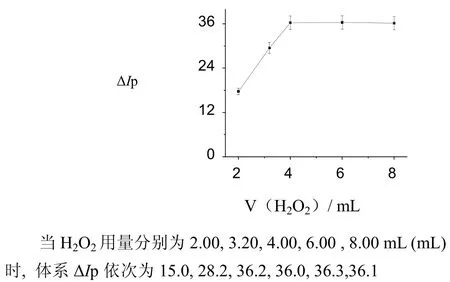
图5 H2O2用量对ΔIp的影响Fig.5 The influence of H2O2 amount on ΔIp
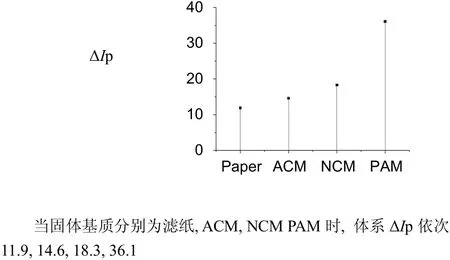
图6 固体基质对ΔIp的影响Fig.6 The influence of Solid substrate on ΔIp
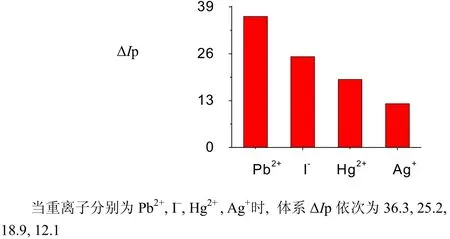
图7 重离子对ΔIp的影响Fig.7 The influence of Heavy ion on ΔIp
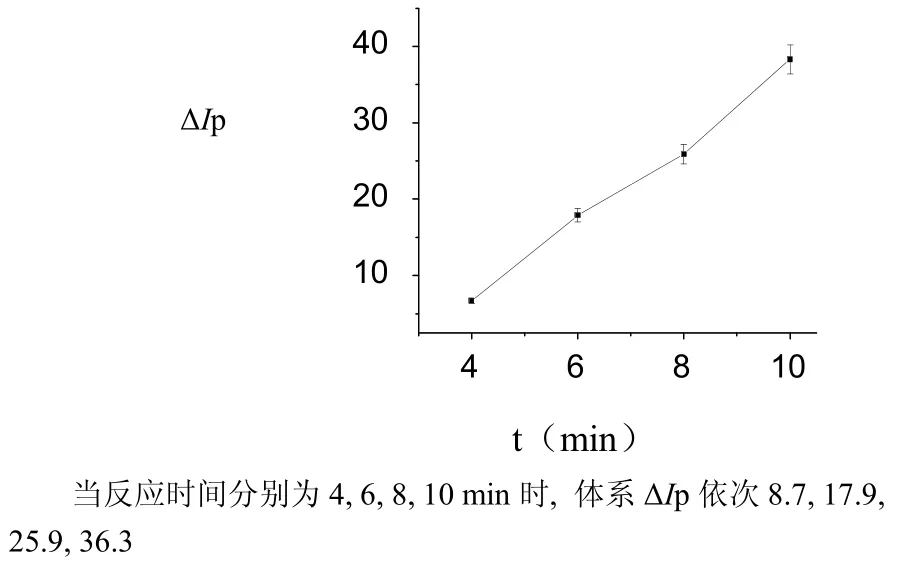
图8 反应时间对ΔIp的影响Fig.8 The influence of reaction time on ΔIp
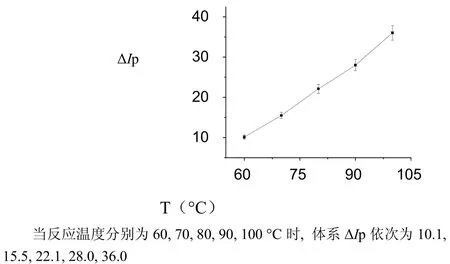
图9 反应温度对ΔIp的影响Fig.9 The influence of reaction temperature on ΔIp
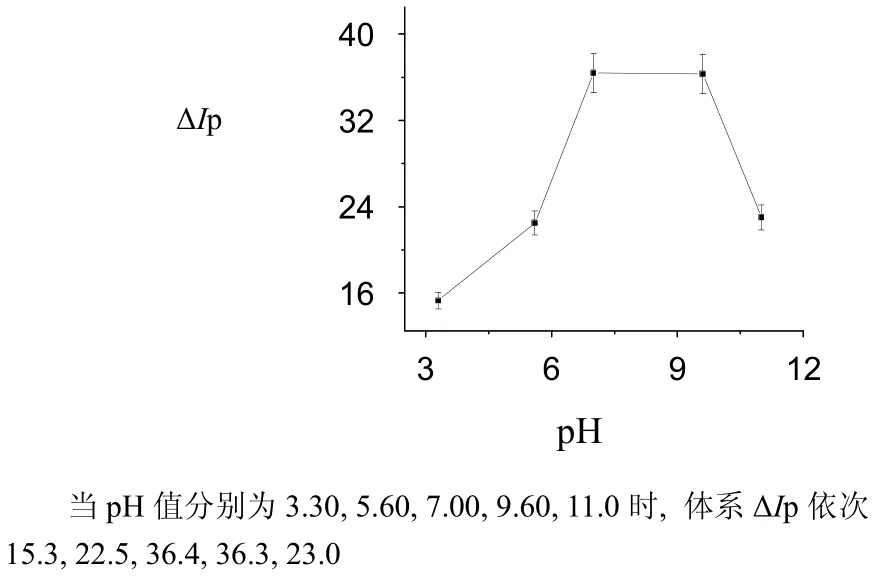
图10 pH值对ΔIp的影响Fig.10 The influence of pH value on ΔIp
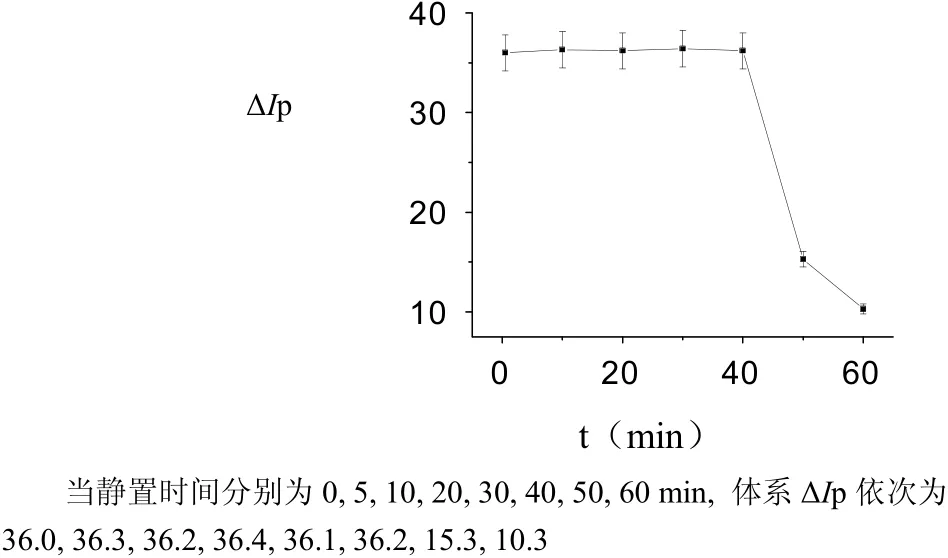
图11 静置时间对ΔIp的影响Fig.11 The influence of Incubation time on ΔIp
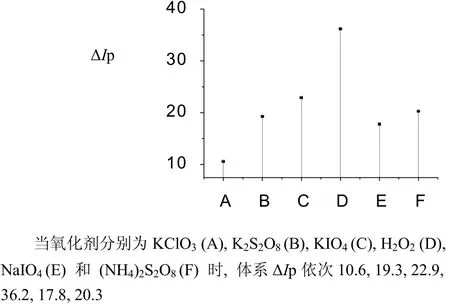
图12 氧化剂对体系ΔIp的影响Fig.12 The influence of Oxidant on ΔIp
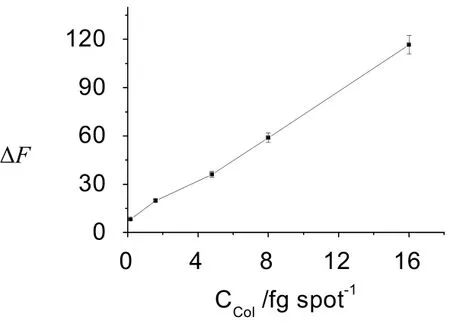
图13 工作曲线的回归方程Fig.13 The regression equation of the working curve
由图2~12得出以下规律:
(1) 随着 AY浓度和用量的增加,体系的值逐渐增大,当 AY 为 1.0 mL1.0×10–4mol–1时体系ΔIp值达到最大值。
(2) 虽然、、、、作为氧化剂时体系值较高,但以的最大,可能是的氧化能力最大。随着浓度和用量的增加,体系的值逐渐增大。当为4.0 mL2.0 %时,体系值达到最大值;当超过4.0 mL2.0 %时体系的值几乎不变。
(3) 在研究所考察的几种固体基质中,相对于滤纸、NCM和ACM,PAM发射磷光最强。可能是重原子溶液在PAM扩散较慢,干燥时能迅速扩散的缘故[25]。
(4) 虽然、、作为离子微扰剂时体系ΔIp值较高,但以的最大,可能是由于是重金属离子,其重原子效应很大程度提高了发光分子从S1态T1态的跃迁几率,才使体系的值发生剧烈增强。研究表明:随着浓度的增加,体系值增大;浓度为 1.00 mol时,体系值达到最大;浓度大于 1.00 mol时,体系值反而减少。可能是适度的重原子效应能增加 AY从单线态向三线态跃迁几率而使磷光增强,而过度的重原子效应使磷光增强猝灭的缘故[22]。
(5) 当pH在3.30~7.00范围内,随着pH的增加体系的值线性增大;当pH在7.00~9.60范围内,体系最大且稳定。可能是在此pH值范围内COL的催化反应速率最大。
(6) 随着反应温度与时间的增加,体系值逐渐增大,可能是COL的催化反应能力逐渐增大。当反应温度与时间分别为100 ℃、10 min时,体系值最大,显然,此时COL的催化反应能力最强。
(7) 本实验研究发现在通入 3~25 min干燥 N2的条件下,体系是稳定的,可能是氧气及湿度的影响被消除的缘故。然而,不通干燥 N2时,随着时间的增加,体系ΔIp值逐渐减小,表明了氧气及湿度可导致RTP猝灭,故选择通干燥N2时间为6 min最佳。
(8) RTP发射的稳定性是实现催化SS-RTP测定痕量COL的关键。在最佳条件下,放置时间在40 min内体系值几乎不变,重现性好。当放置时间超过40 min,体系的值逐渐减少,这可能与放置过程AY被潮解有关。
结果表明:当用 1.00 mL1.0× 10–4mol·L–1AY 和4.00 mL 2.0%为氧化剂)、PAM为固体基质、为离子微扰剂、反应温度为100 ℃和反应时间为10 min、反应pH为7.00、通干燥的N2时间为6 min、静置时间为40 min时,体系的值最大且稳定。此时体系的pH = 7.00。
2.4 工作曲线,线性范围,精密度与检出限
在最佳条件下,体系的与COL浓度含量呈线性关系(图2),此研究方法的工作曲线的回归方程、线性范围、相关系数(r)、RSD%(分别对 0.16(fg·spot–1) 和16.0 ()的COL溶液进行7次平行测定试验,并计算其 RSD%)、LOD(对试剂空白进行11次的平行测定,求得Ip平均值为171.6,以3Sb/k计算,Sb = 0.083)、limit of quantification(LOQ)(以10Sb/k计算)等与文献[5,8]方法比较于表1。

表1 几种测定COL的方法比较Table 1 Several methods for determining COL are compared
本方法的g·mL–1,按计算,Sb = 0.083,n=11)比文献[8]低,展现高的灵敏度。可能的原因:一是 COL催化反应对测量信号的放大效应;二是重原子的重原子微扰效应,提高了AY分子往三重态跃迁的几率,使体系的值剧烈变大。本方法不仅为超痕量COL的检测提供了新技术,而且显示了催化反应对测量信号的放大效应是进一步提高SS-RTP灵敏度的一种有效途径。
2.5 共存离子的影响
用本法分别测定12.0 pg·mL–1COL、12.0 pg·mL–1COL + X ng·mL–1共存离子(物),当相对误差为±5℅时,共存离子(物)的允许浓度与文献、COL=399 ng=0.4 pgCOL[8])比较于表 2。
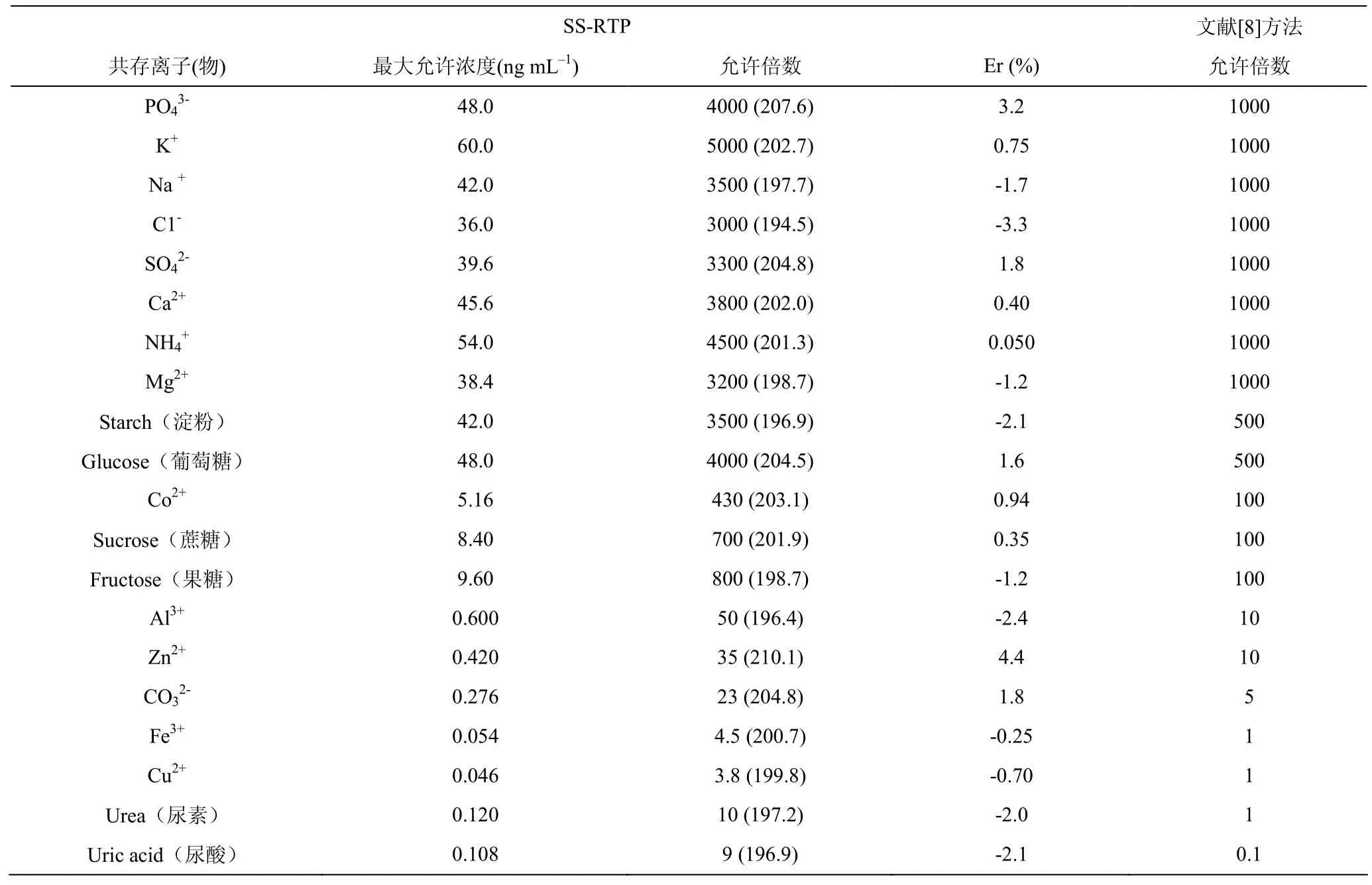
表2 共存离子(物)的影响Table 2 The effects of coexisting ions (objects)
由表2可知,本方法比文献[8]方法的共存离子(物)允许存在浓度更高,选择性更好,体现了本方法的研究价值。
2.6 样品分析
6名健康志愿者于给药前12 h,进清淡晚餐后,禁食过夜,于次日早晨空腹服用秋水仙碱片2片(1 mg),用温开水200 mL送服。参照文献[8]方法,两周后分别自上肢静脉取血液5.00 mL,置肝素试管中,以3000 rpm的转速离心10 min,取上层人血清水定容至50 mL,-40°C保存备用,供测试。取1.00 mL试液,按上述实验方法测定 COL含量,同步做加标回收实验,所得数据再与UPLC-MS/MS[8]进行比较,结果列于表3。本法与UPLC-MS/MS测定秋水仙碱含量的的显著性差异分析列于表4。
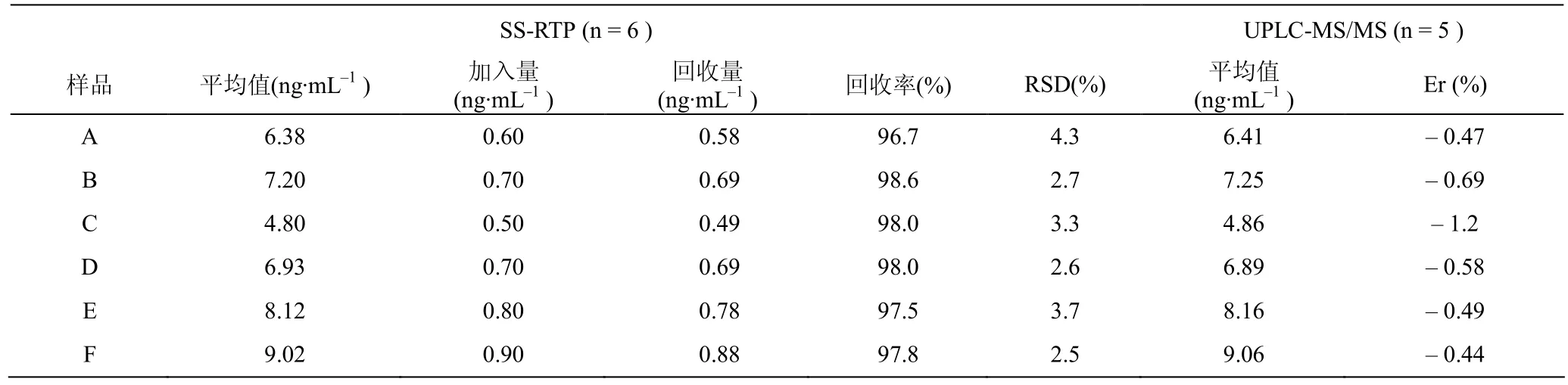
表3 人血清中秋水仙碱含量的分析结果Table 3 The analysis results of the content of narcissus in human serum
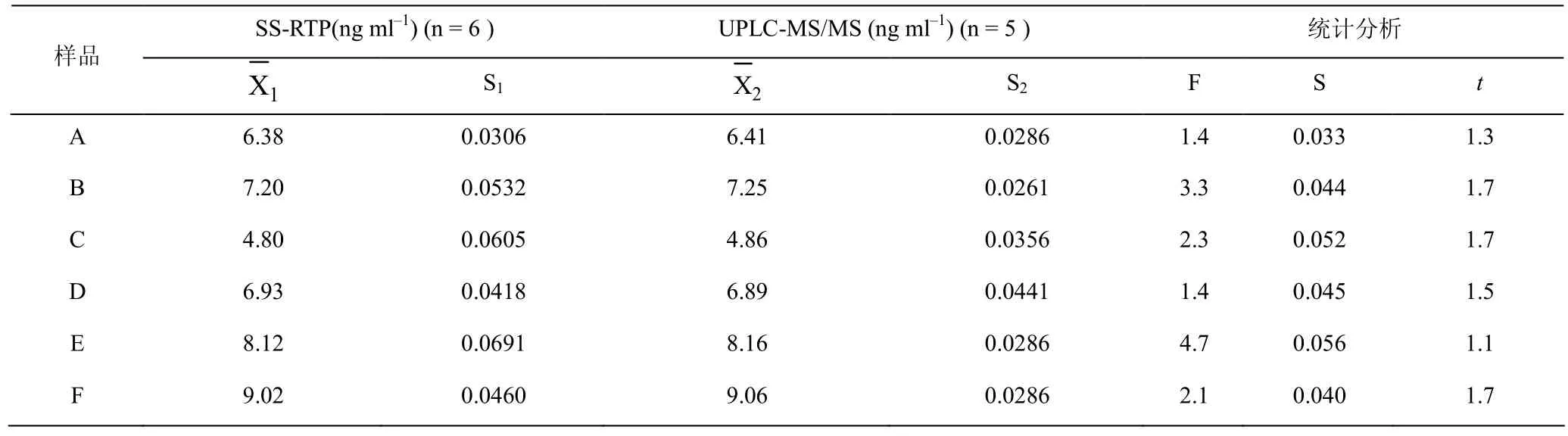
表4 测定结果的显著性分析Table 4 A significant analysis of the results
由表3和表4可见,本方法用于人血清中COL含量的测定,结果与 UPLC-MS/MS相吻合,回收率为96.7%~98.6%,RSD为2.5%~4.3%,具有较高的准确度和精密度。此外,人血清样品的F值分别为 1.4、3.3、2.3、1.4、4.7和 2.1,表明 S1与 S2不存在显著性差异;对应的t值分别为 1.3、1.7、1.7、1.5、1.1和1.7,表明与不存在显著性差异。因此,所设计的SS-RTP是灵敏的、准确的,适用于人血清中COL的测定。
3 小结
本研究考察了催化SS-RTP的灵敏度、选择性和用于测定痕量 COL的新方法的可行性,同时,探讨了催化反应的动力学常数。新方法灵敏、简便、快速、选择性好、准确度高,用于人体血清中痕量COL的测定,结果与UPLC-MS/MS相吻合。本研究推动了COL检测技术的研究进展。
[1]Sahu R K, Jain A, Nayak S. Development and evaluation of transdermal patches of Colchicine [J]. Der Pharmacia Lettre, 2012,4 (1): 330-343.
[2]Syed F F, Mayosi B M. Pharmacotherapy: Colchicine for recurrent pericarditis [mdash]what's new in CORP-2 [J].Nature Reviews Cardiology, 2014, 11(2): 376-378.
[3]Finkelstein Y, Aks S. Colchicine poisoning: the dark side of an ancient drug [J]. Clin Toxicol, 2010, 48(5):407-414.
[4]Lin Z Y, Kuo C H, Wu D C, et al. Anticancer effects of clinically acceptable colchicine concentrations on human gastric cancer cell lines [J]. Kaohsiung Journal of Medical Sciences, 2016, 32(2): 68-73.
[5]Jiang S S, Liu Z F, Hu X L, et al. Fluorescence quenching method for the determination of colchicine with some aromatic amino acids as probes [J]. Acta Chimica Sinica,2010, 68(22): 2325-2330.
[6]Ng S W, Ching C K, Chan A Y W, et al. Simultaneous detection of 22 toxic plant alkaloids (aconitum alkaloids,solanaceous tropane alkaloids, sophora alkaloids,strychnos alkaloids and colchicine) in human urine and herbal samples using liquid chromatography–tandem mass spectrometry [J]. Journal of Chromatography B,2013, 942(4): 63-69.
[7]Hadad G M, Badr J M, El-Nahriry K, et al. Validated HPLC and HPTLC methods for simultaneous determination of colchicine and khellin in pharmaceutical formulations [J]. Journal of chromatographic science,2013, 51(3): 258-265.
[8]Li J L, Qiu Z W, Sun A L, et al. UPLC-MS/MS determination of colchicine in blood of poisoned sufferers [J]. Chinese Journal of Health Laboratory Technology, 2012, 22 (11): 2571-2573.
[9]Wang F, Zhou J, Liu Y, et al. Electrochemical oxidation behavior of colchicine on a graphene oxide-Nafion composite film modified glassy carbon electrode [J].Analyst, 2011, 136(19): 3943-3949.
[10]Gandhi S, Deshpande P, Sengar M. High performance thin layer chromatographic determination of diclofenac sodium and thiocolchicoside in fixed dose combination [J].IRJP, 2010, 1(1): 220-224.
[11]沈淑君. 核固红-亮绿双指示剂催化光度法测定痕量Pb()Ⅱ[J]. 井冈山大学学报:自然科学版,2016,37(3):30-34.
[12]Wang H F, Wu Y Y, Yan X P. Room-temperature phosphorescent discrimination of catechol from resorcinol and hydroquinone based on sodium tripolyphosphate capped Mn-doped ZnS quantum dots [J].Analytical chemistry, 2013, 85(3): 1920-1925.
[13]Liu J M, Lin L P, Wang X X, et al. Highly sensitive detection of residual chlorpromazine hydrochloride with solid substrate room temperature phosphorimetry [J].Fluoresc, 2012, 22(4): 1087-1094.
[14]Liu J M, Lin L P, Wang X X, et al. A highly sensitive coupling technique for the determination of trace quercetin based on solid substrate room temperature phosphorimetry and poly (vinyl alcohol) complex imprinting [J]. Analytica Chimica Acta, 2012, 723(23):76-82.
[15]Kondrashina A V, Papkovsky D B, Dmitriev R I.Measurement of cell respiration and oxygenation in standard multichannel biochips using phosphorescent O2-sensitive probes[J]. Analyst, 2013, 138(17):4915- 4921.[16]Liu J M, Huang X M, Lin S Q, et al. Determination of trace gastrin and diagnosis of human diseases using Cd Te quantum dots labelled gastrin antibodies as phosphorescence sensors [J]. Analyst, 2011, 136(15):3789-3796.
[17]Cash K J, Clark H A. Phosphorescent nanosensors for in vivo tracking of histamine levels [J]. Analytical chemistry, 2013, 85(13): 6312-6318.
[18]Liu J M, Huang X M, Cui M L, et al. Determination of trace human chorionic gonadotropin by using ultiwall carbon nanotubes as phosphorescence labeling reagent [J].Analytical Biochemistry, 2012, 431(18): 19–29.
[19]Bi L, Dong X, Yu Y. Room-temperature phosphorescence sensor based on manganese doped zinc sulfide quantum dots for detection of urea[J]. Journal of Luminescence, 2014, 153(12): 356-360.
[20]Liu J M, Li F M, Liu Z B, et al. 8-Quinolineboronic acid as a potential phosphorescent molecular switch for the determination of alpha-fetoprotein variant for the prediction of primary hepatocellular carcinoma [J].Analytica Chimica Acta, 2010, 663(48): 184-189.
[21]Liu J M, Wang H X, Lin L P, et al. Catalytic solid substrate–room-temperature phosphorimetry detection for trace cadmium with Cd2+–3.5-generation polyamidoamine dendrimer–Tween-80 complex [J]. Luminescence,2012, 27(2): 346-351.
[22]Huang Y Q, Cai P Y, Liu J M, et al. Ultra-sensitive phosphorescence sensor for the detection of trace As(V)based on the signal amplification effect of As(V)catalyzing H2O2oxidize Cd Te –Cys-quantum dots[J].RSC Adv, 2014, 4(1): 7410–7417.
[23]Liu J M, Huang X M, Lin S Q, et al. Determination of trace gastrin and diagnosis of human diseases using Cd Te quantum dots labelled gastrin antibodies as phosphorrescence sensors[J]. Analyst,2011,136(18): 789-3796.
