老年胃癌病人胃癌组织中Ki67、P53及Her2的表达及临床意义
2018-05-29
胃癌位居世界癌症死因顺位的第2位,是严重威胁人类生命健康安全的最常见恶性肿瘤之一[1]。据统计我国每年死于胃癌的人数约有16万[2],近年来60岁以上的老年人胃癌发病率出现了上升趋势[3]。由于早期胃癌多无明显临床症状,待病人自行就诊时多数已属中晚期,如能在早期发现胃癌则能大大提高其生存率及生活质量[4]。研究发现,Ki67、P53及人类表皮生长因子受体2(human epidermal growth factor receptor 2, Her2)均和肿瘤的发生发展具有密切的关系[5],但是三者在胃癌中表达的相关研究还比较少,因此,本研究对老年胃癌病人胃癌组织中Ki67、P53及Her2的表达及其临床意义进行研究,为临床辅助诊断提供理论依据。
1 资料与方法
1.1 临床资料 选取2016年1月至2017年5月期间在我院住院治疗的老年胃癌病人152例及其手术切除的病理组织标本,男84例,女68例,平均年龄(69.55±10.45)岁,其中胃腺癌87例,印戒细胞癌65例。按照2010年美国癌症联合委员会(AJCC)的胃癌TNM分期标准进行临床分期[6],Ⅰ期25例,Ⅱ期42例,Ⅲ期55例,Ⅳ期30例。
1.2 纳入与排除标准 纳入标准:(1)年龄≥60岁;(2)均经过病理诊断确诊为原发性胃癌,均有胃癌组织和癌旁组织病理组织标本;(3)病例临床资料及病理资料完整。本研究获得医院伦理委员会批准,病人知情同意并签署知情同意书。排除标准:(1)病人病理取材前曾经接受过化疗、放疗及生物免疫治疗;(2)患有其他部位恶性肿瘤、胃部良性肿瘤者;(3)病例临床资料及病理资料不完整者;(4)不配合、依从性差者。
1.3 方法 对病理组织标本进行甲醛脱水固定,然后用石蜡包埋,采用免疫组织化学法(SP法)进行Ki67、P53及Her2检测。Ki67、P53位于细胞核上,阳性表达为棕色或者黄色颗粒,Ki67、P53判定标准:阴性为未发现肿瘤细胞着色或者有小于10%的肿瘤细胞着色,阳性为有超过10%的肿瘤细胞着色。Her2位于细胞膜上,阳性表达为棕褐色,Her2判定标准:未发现细胞膜着色或者肿瘤细胞着色数小于10%为Her2(-),肿瘤细胞着色数超过10%且细胞膜有不完整的着色为Her2(+),Her2(-)和Her2(+)均作为Her2阴性,肿瘤细胞着色数超过10%且细胞膜有完整的轻度至中度着色为Her2(++),肿瘤细胞着色数超过10%且细胞膜有完整的强度着色为Her2(+++),Her2(+++)作为Her2阳性,Her2(++)者需要再进行荧光原位杂交技术即FISH检测,以核实是否为Her2阳性。

2 结果
2.1 老年胃癌病人胃癌组织和癌旁组织中Ki67、P53及Her2的表达情况比较 老年胃癌病人胃癌组织中Ki67、P53及Her2的阳性表达率分别为74.34%、58.55%、49.34%,均明显高于癌旁组织的阳性表达率,差异均具有统计学意义(P<0.01)。见表1。
表1 胃癌组织和癌旁组织中Ki67、P53及Her2的表达情况(n,%,n=152)

组别Ki67阳性表达P53阳性表达Her2阳性表达 胃癌组织113(74.34)∗∗89(58.55)∗∗75(49.34)∗∗ 癌旁组织42(27.63)15(9.87)13(8.55)
注:与癌旁组织比较,**P<0.01
2.2 老年胃癌病人胃癌组织中Ki67、P53及Her2的表达和临床病理特征的关系 临床分期为Ⅲ~Ⅳ期、有淋巴结转移、浸润深度为肌层和浆膜层的老年胃癌病人,其胃癌组织中Ki67、P53及Her2阳性表达率均明显升高(P均<0.05);未发现老年胃癌病人胃癌组织中Ki67、P53及Her2阳性表达率与性别、组织学分型有关(P>0.05)。见表2。
3 讨论
胃癌是我国发病率和死亡率均较高的恶性肿瘤[7],特别是老年人群由于受到环境因素、饮食因素及遗传因素等的影响,胃癌发病率出现升高趋势,为了早期发现胃癌,提高老年胃癌病人的生存率及生活质量,本研究对老年胃癌病人胃癌组织中Ki67、P53及Her2的表达及其临床意义进行了相关研究。
Ki67是能够反映恶性细胞增殖活性的核增殖抗原,分布于细胞有丝分裂的S期、G1期、G2期及M期[8-9]。Tobin等[10]的研究发现,Ki67和恶性肿瘤的发生发展有非常密切的关系。P53是细胞凋亡过程中非常重要的调控因子,由11个外显子和10个内含子构成[11],按照基因型不同将其分为野生型P53及突变型P53。野生型P53在机体内起到抑癌作用,突变型P53发生基因突变以后,不能再发挥抑癌作用,而开始发挥促癌作用,促进细胞发生恶性增殖及恶性化进展[12]。采用SP法检测的均为突变型P53[13]。Her2是具有酪氨酸蛋白激酶活性的表皮生长因子受体家族成员,在机体正常的生理状态下,Her2处于未激活状态,当受到各种因素影响以后,Her2被激活就开始发挥恶性肿瘤转化活性,容易引起恶性肿瘤的复发转移[14]。本研究发现老年胃癌病人胃癌组织中Ki67、P53及Her2的阳性表达率分别为74.34%、58.55%、49.34%,均明显高于癌旁组织的阳性表达率,且差异均具有统计学意义(P<0.05),王静等[5]、田丽峰等[15]的研究也发现胃癌病人胃癌组织中Ki67、P53及Her2的阳性表达率均明显高于癌旁组织,所以Ki67、P53及Her2在老年胃癌病人胃癌组织中呈现高表达;临床分期为Ⅲ~Ⅳ期的老年胃癌病人,其胃癌组织中Ki67、P53及Her2阳性表达率分别为94.12%、67.06%、58.82%,均明显高于临床分期为Ⅰ~Ⅱ期的老年胃癌病人,且差异均具有统计学意义(P<0.05),临床分期越高的老年胃癌病人Ki67、P53及Her2阳性表达率越高;有淋巴结转移的老年胃癌病人,其胃癌组织中Ki67、P53及Her2阳性表达率分别为90.36%、68.67%、59.04%,均明显高于无淋巴结转移的老年胃癌病人(P<0.05),有淋巴结转移的老年胃癌病人Ki67、P53及Her2阳性表达率越高;浸润深度为肌层和浆膜层的老年胃癌病人,其胃癌组织中Ki67、P53及Her2阳性表达率分别为93.88%、76.53%、66.33%,均明显高于浸润深度为黏膜和黏膜下层的老年胃癌病人(P<0.05)。所以本研究进一步验证了随着恶性肿瘤的恶性化进展,老年胃癌病人Ki67、P53及Her2阳性表达率随之增高,即Ki67、P53及Her2和胃癌的发生发展具有密切的关系[16]。
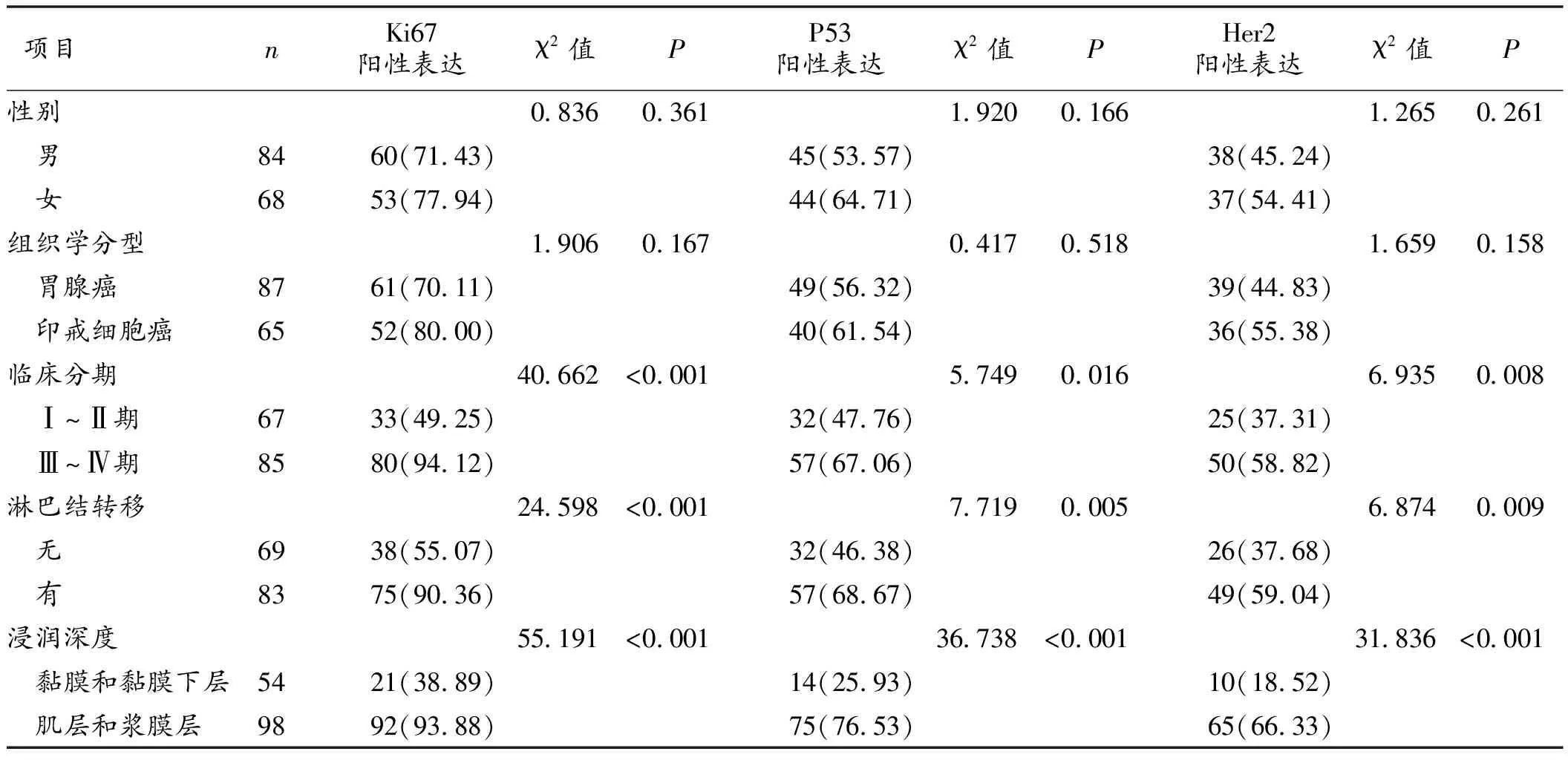
表2 胃癌组织中Ki67、P53及Her2的表达和临床病理特征的关系(n,%)
综上所述,老年胃癌病人胃癌组织中Ki67、P53及Her2呈现高表达,而且Ki67、P53及Her2均和老年胃癌的发生发展具有密切的关系,可以作为判定老年胃癌恶性程度及进展的重要指标。
[]
[1] Dikken JL, Coit DG, Baser RE, et al. Performance of a nomogram predicting disease-specific survival after an R0 resection for gastric cancer in patients receiving postoperative chemoradiation therapy[J]. Int J Radiat Oncol Biol Phys, 2014, 88(3): 624-629.
[2] Song W, Yang HB, Chen P, et al. Apoptosis of human gastric carcinoma SGC-7901 induced by deoxycholic acid via the mitochondrial-dependent pathway[J].Appl Biochem Biotechnol, 2013, 171(4): 1061-1071.
[3] 高炜,徐艳霞,梁华,等. 替吉奥对比卡培他滨一线治疗老年晚期胃癌的疗效分析[J]. 实用老年医学, 2012, 26(6): 501-503,506.
[4] 黄海,史冬梅,于晓峰,等. 老年人胃癌癌前变化的随访研究[J]. 实用老年医学, 2012, 26(5): 404-406, 409.
[5] 王静,周福有,王俊生,等. Her2,ki67,p53在贲门癌与胃窦癌组织中的表达情况对比研究[J].医药前沿, 2014,4(11): 228-229.
[6] Washington K. 7th edition of the AJCC cancer staging manual: stomach[J]. Ann Surg Oncol, 2010, 17(12): 3077-3079.
[7] Chen JN, Jiang Y, Li HG, et al. Epstein-Barr virus genome polymorphisms of Epstein-Barr virus-associated gastric carcinoma in gastric remnant carcinoma in Guangzhou, southern China, an endemic area of nasopharyngeal carcinoma[J]. Virus Res, 2011,160(1/2): 191-199.
[8] Synnestvedt M, Borgen E, Russnes HG, et al. Combined analysis of vascular invasion, grade, HER2 and Ki67 expression identifies early breast cancer patients with questionable benefit of systemic adjuvant therapy[J]. Acta Oncol, 2013, 52(1): 91-101.
[9] Cserni G, Vris A, Liepniece KI, et al. Distribution pattern of the Ki67 labelling index in breast cancer and its implications for choosing cut-off values[J]. Breast, 2014, 23(3): 259-263.
[10] Tobin NP, Lindstrm LS, Carlson JW, et al. Multi-level gene expression signatures, but not binary, outperform Ki67 for the long term prognostication of breast cancer patients[J]. Mol oncol, 2014, 8(3): 741-752.
[11] Wei Q, Tianbo J, Qi Y, et al. PRIMA-1 selectively induces global DNA demethylation in p53 mutant-type thyroid cancer cells[J]. J Biomed Nanotechnol, 2014, 10(7): 1249-1258.
[12] Cao W, Zhang JL, Feng DY, et al. The effect of adenovirus-conjugated NDRG2 on p53-mediated apoptosis of hepatocarcinoma cells through attenuation of nucleotide excision repair capacity[J]. Biomaterials, 2014, 35(3): 993-1003.
[13] He Y, Nie Y, Xie L, et al. P53 mediated apoptosis by reduction sensitive shielding ternary complexes based on disulfide linked PEI ternary complexes[J]. Biomaterials, 2014, 35(5): 1657-1666.
[14] Bente BH, Yu C, Kristian B, et al. Photochemical activation of the recombinant HER2-targeted fusion toxin MH3-B1/rGel; Impact of HER2 expression on treatment outcome[J]. J Control Release, 2014, 182: 58-66.
[15] 田丽峰,李莹杰,陈嘉薇,等. EGFR和Ki67在胃不典型增生和胃癌中的表达及二者相关性[J]. 哈尔滨医科大学学报, 2001, 35(2): 116-118.
[16] 党海珍,魏力,叶勇,等. 胃癌患者术后多项免疫分子表达对预后的影响[J]. 中华保健医学杂志, 2015, 17(4): 293-296.
