miR-16、126表达预测糖尿病微血管并发症的临床价值
2018-05-29何继宏张芳娣邱海山陈远东
何继宏 杨 海 张芳娣 邱海山 陈远东
糖尿病主要以慢性血糖升高为临床特征,主要由胰岛素分泌不足或作用缺陷所引起,其具体发病机制尚不明确[1]。长期血糖控制不佳会诱发糖尿病微血管病变,明显增加致残率及死亡率,因此早期诊断、监控糖尿病微血管并发症对预防恶性事件发生有重要意义[2]。微小核糖核酸(microRNA,miRNAs)是一种新型基因表达调控因子,与胰岛素生成、分泌及胰岛素作用有密切关系[3]。近年来有研究显示[4-5],miR-16、miR-126可参与糖尿病发生、发展,而且其在糖尿病血管并发症的发生中具有重要作用,但临床对于两者在糖尿病血管并发症中含量变化还需进一步研究。因此本次研究采取PCR方法定量检测2型糖尿病患者血清中miR-16、126表达水平,分析其在糖尿病发生、发展中的作用。结果报告如下。
1 资料与方法
1.1 一般资料 纳入我院2015年6月-2017年12月于我院就诊的2型糖尿病(糖尿病组)、2型糖尿病微血管并发症患者(微血管并发症组)各40例为研究对象,本次研究经医院伦理委员会审查批准。2型糖尿病组患者均符合糖尿病诊断标准[6],其中男25例,女15例;年龄20~72岁,平均(50.35±9.87)岁;体重指数18.54~31.95 kg/m2,平均(25.34±3.95)kg/m2;病程1~9年,平均(1.95±1.05)年。微血管并发症组患者均符合2型糖尿症诊断标准[6],且发生微血管并发症,其中男23例,女17例;年龄22~76岁,平均(51.78±8.64)岁;体重指数19.05~32.87 kg/m2,平均(26.14±4.02)kg/m2;病程8个月~7年,平均(2.04±1.13)年。本次患者排除标准:年龄<18岁或>80岁;其他类型糖尿病;合并严重心血管疾病、甲状腺功能紊乱、急性感染及恶性肿瘤者。另选取40例健康体检者为对照组,男22例,女18例;年龄19~78岁,平均(50.95±8.05)岁。
1.2 方法
1.2.1 标本收集与保存,采集80例患者及40例健康体检者空腹静脉血3 mL,3 000 r/min低速离心10 min,收集血清标本置于-80℃保存。
1.2.2 生化指标测定 采用全自动生化分析仪检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)水平,各检测试剂盒均购自北京中杉金桥生物技术有限公司,严格按照试剂盒操作说明书进行操作。
1.2.3 血清RNA提取及荧光定量PCR检测miR-16、miR-126 收集的血清标本中加入TRIZOL LS试剂及200 μL氯仿摇匀,静置15 min,4℃ 12 000 rpm离心10 min,将上层水相已至另一离心管中,加入异丙醇,4℃ 12 000 rpm离心10 min,弃上清液,加入乙醇,7 500 rpm离心5 min,加入100 μL 0.1%DEPC ddH2O,严格按照RNA回收试剂盒说明书纯化回收RNA。采用逆转录荧光PCR检测miR-16、miR-126,以U6为内参,引物及探针购自TaKaRa公司,严格按照实验室操作步骤进行操作。
1.3 观察指标 记录三组FPG、HbA1c、TC、TG、LDL-C、HDL-C水平差异,并采用荧光定量PCR检测三组血清miR-16、miR-126变化,分析miR-16、miR-126对糖尿病微血管并发症的预测价值。
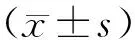
2 结果
2.1 三组血生化检测结果比较 微血管并发症组、糖尿病组FPG、HbA1c、TC、TG、LDL-C、HDL-C水平均高于对照组,差异有统计学意义(P<0.05)。微血管并发症组与糖尿病组各生化检测结果比较均无显著差异(P>0.05)。见表1。


组别FPG(mmol/L)HbA1c(%)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)微血管并发症组(n=40)9.26±2.181)9.68±2.541)4.75±1.952.15±0.651)3.12±0.571)1.05±0.071)糖尿病组(n=40)9.24±2.231)10.21±2.311)4.70±2.062.04±0.711)2.97±0.681)1.02±0.081)对照组(n=40)5.13±2.355.32±1.984.32±2.191.02±0.322.33±0.541.43±0.10
注:与对照组比较,1)P<0.05。
2.2 三组血清miR-16、miR-126比较 微血管并发症组、糖尿病组、对照组中miR-16呈降低趋势,miR-126呈升高趋势,差异有统计学意义(P<0.05)。见表2。


组别miR-16miR-126微血管并发症组(n=40)42.95±14.671)2)18.35±6.171)2)糖尿病组(n=40)26.69±9.462)26.97±9.862)对照组(n=40)15.06±0.9735.14±0.95
注:与糖尿病组比较,1)P<0.05;与对照组比较,2)P<0.05。
2.3 miR-16、miR-126对糖尿病微血管并发症的预测价值分析 miR-16预测糖尿病微血管并发症的ROC曲线下面积0.810,标准误为0.051,P=0.000,95%置信区间为0.710~0.910,当最佳截断值为32.62,此时敏感度与特异度均为0.825。miR-126预测糖尿病微血管并发症的ROC曲线下面积0.784,标准误为0.051,P=0.000,95%置信区间为0.683~0.884,当最佳截断值为20.42,此时敏感度与特异度均为0.825,特异度为0.725。见图1-图2。
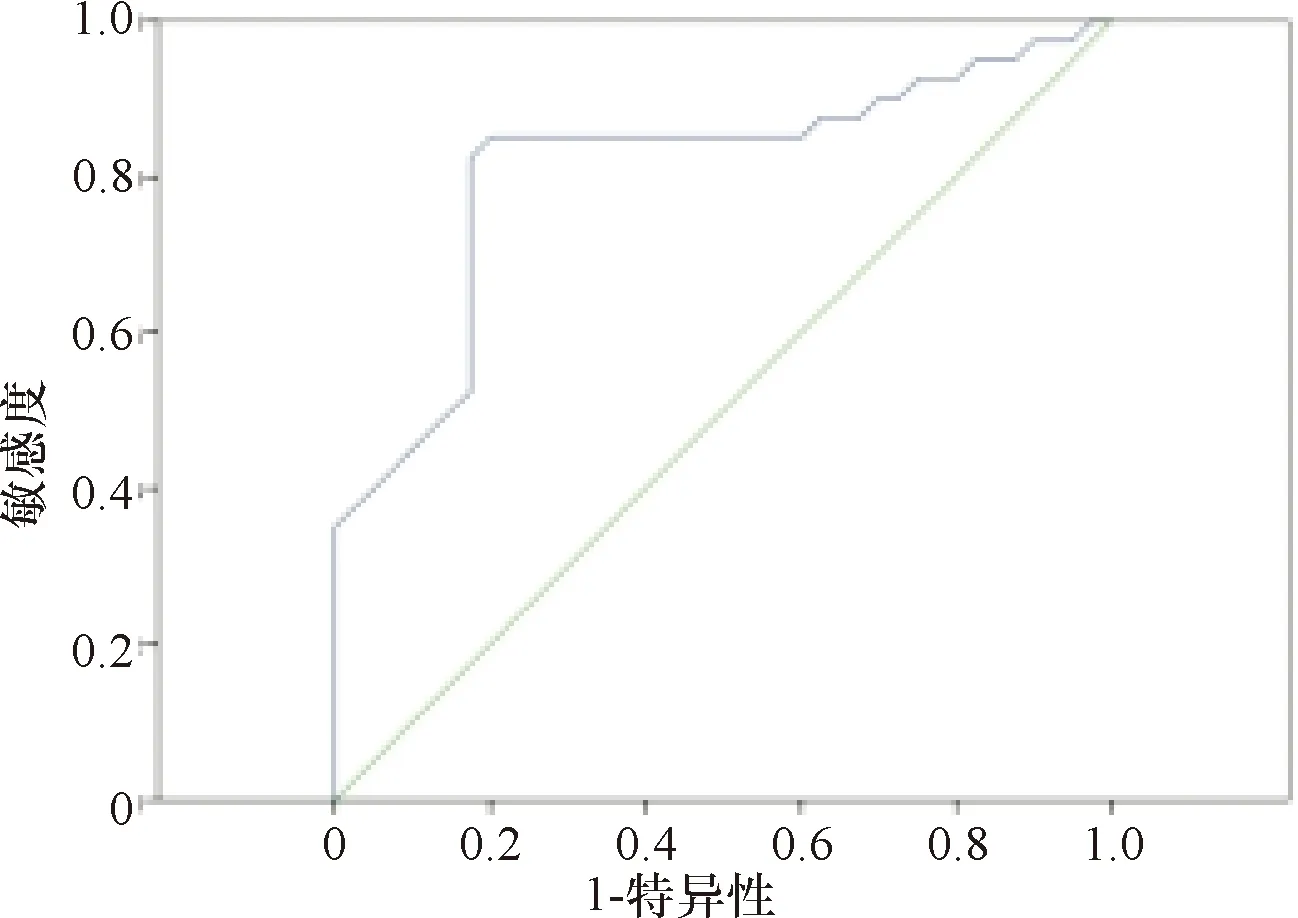
图1 miR-16预测糖尿病微血管并发症的ROC曲线
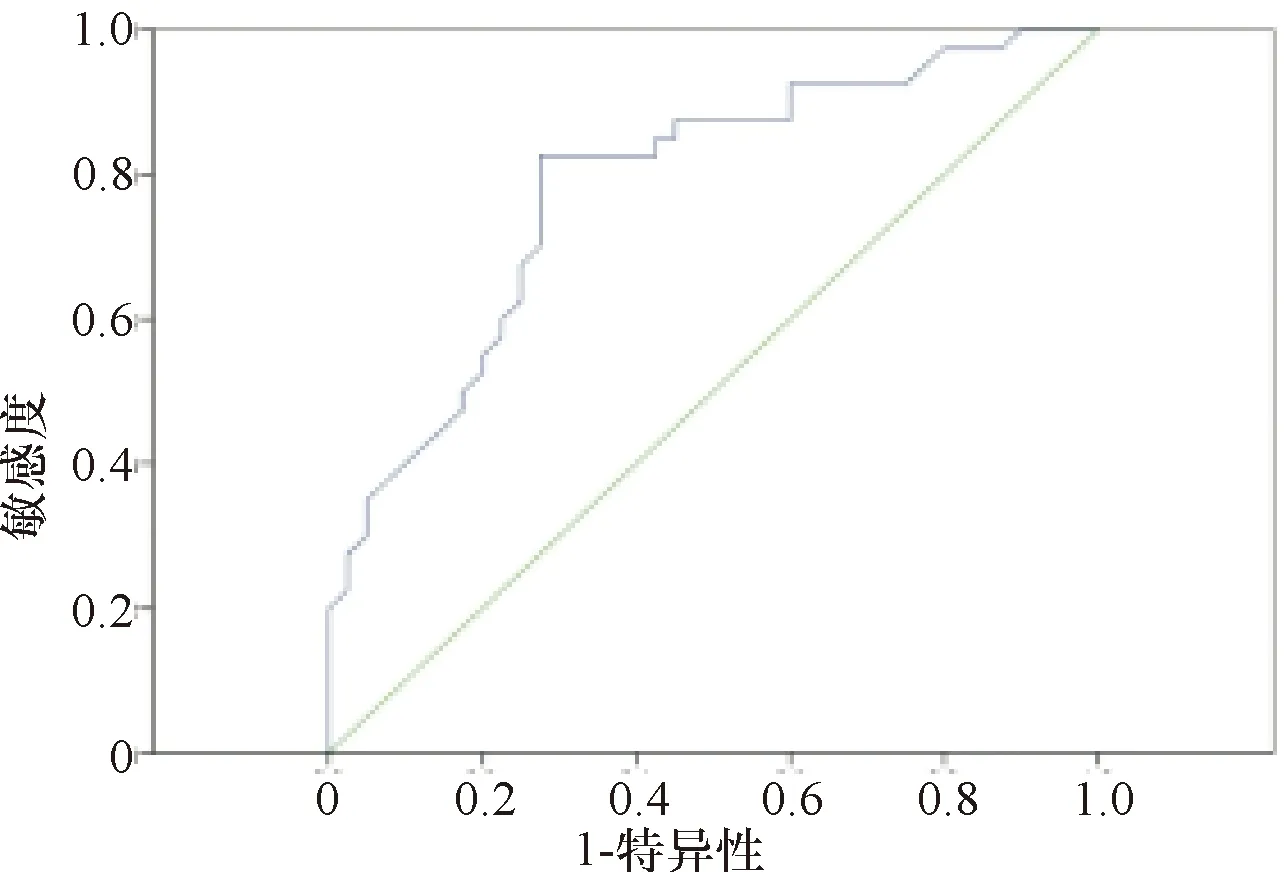
图2 miR-126预测糖尿病微血管并发症的ROC曲线
3 讨论
miRNAs与特异性靶信使结合后可在转录水平上抑制基因表达,可调控细胞周期,参与疾病进展,而且这些循环miRNAs在血浆中含量稳定,检测方便、无创,有可能成为预测、诊断糖尿病及其相关微血管并发症的生物标志物[7-8]。目前临床有大量研究显示[9-11],miRNAs与糖尿病发病机制有密切关系,而且其与胰岛素发育、生成及分泌有关。
本次研究显示,微血管并发症组、糖尿病组各生化指标与对照组间有显著差异,但糖尿病微血管并发症患者生化指标与糖尿病并无显著差异,与既往研究结果相符[12]。但通过PCR技术检测患者体内miRNAs含量变化结果显示,糖尿病微血管并发症患者miR-16表达显著高于糖尿病患者,提示miR-16或许可作为诊断糖尿病微血管并发症的辅助标志物。本次研究还显示,miR-16预测糖尿病微血管并发症的ROC曲线下面积0.810,当最佳截断值为32.62,此时敏感度与特异度均为0.825,这也进一步提示miR-16有望成为糖尿病病情进展及血管并发症的相关血清标志物。万淑君等[13]研究
显示,糖尿病肢体缺血患者血液循环中miR-16含量增高,而且在血管重建术后狭窄与血液中miR-16水平有关,在预测预后方面有一定价值。
miR-126在人内皮细胞中表达,其在血管形成、血管炎性反应方面有重要意义。本次研究显示,糖尿病微血管并发症患者及单纯糖尿病患者体内miR-126表达低下,而且糖尿病微血管并发症患者miR-126与糖尿病患者之间也存在差异,miR-126预测糖尿病微血管并发症的ROC曲线下面积0.784,当最佳截断值为20.42,此时敏感度与特异度均为0.825,提示血清miR-126可作为糖尿病及微血管并发症的生物标志物。郭晓莉等[14]研究显示,在肝细胞中,miR-126可靶向抑制胰岛素受体底物而发生胰岛素抵抗,这也进一步反应血清miR-126与糖尿病进展密切相关。虽然目前临床对于miR-16、miR-126在糖尿病及糖尿病微血管并发症方面取得一些研究,但关键的基因分子仍需后续研究进一步探讨。
综上,miR-16、miR-126与糖尿病微血管并发症发生有关,可为糖尿病及其微血管并发症的诊断及治疗提供一个新思路。
[1] 李淑华,刘月芬.格列美脲对胰岛素控制不佳的2型糖尿病患者胰岛素敏感性的影响[J].实用临床医药杂志,2016,20(3):146-147.
[2] 田浩明,李舍予.长期血糖控制与糖尿病慢性血管并发症:循证治疗三十年[J].中国糖尿病杂志,2016,8(11):641-644.
[3] 马科,朱晓波,徐志伟,等.高脂饮食诱导胰岛素抵抗小鼠血浆microRNA表达谱及其与TLR4的关系[J].中国免疫学杂志,2016,32(12):1745-1752.
[4] 李晓云,王立新,牛建一,等.miR-126在糖尿病大鼠脑缺血损伤组织中的表达及在血管再生中的意义[J].中华神经医学杂志,2016,15(9):908-912.
[5] YE E A,STEINLE J J.miR-15b/16 protects primary human retinal microvascular endothelial cells against hyperglycemia-induced increases in tumor necrosis factor alpha and suppressor of cytokine signaling 3[J].Journal of Neuroinflammation,2015,12(1):1-8.
[6] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(基层版)[J].中华全科医师杂志,2013,12(8):1227-1245.
[7] 郑昭烽,罗秀菊.循环microRNAs与缺血性脑卒中的研究进展[J].中南医学科学杂志,2016,44(3):352-355.
[8] 庞建丽,张艳亮,段 勇.微RNA表达谱联合基因表达谱在肺癌检测中的应用[J].医学综述,2016,22(13):2547-2550.
[9] 孙 平,肖 乐,龚昆梅,等.应用微阵列芯片分析糖尿病大鼠下肢动脉硬化miRNAs差异表达谱[J].中国病理生理杂志,2016,32(5):917-922.
[10] 李如月,向晓辉,张 斌,等.TLR4信号通路相关miRNAs在炎症反应调节中的研究进展[J].天津医药,2017,45(7):771-776.
[11] 邵 滢,王秋月.Mir-217/Sirt1通路与糖尿病肾病[J].国际内分泌代谢杂志,2015,35(2):124-126.
[12] 王金华,王俭勤.体液miRNAs:糖尿病肾病早期的潜在性生物标志物[J].中国中西医结合肾病杂志,2014,15(10):938-940.
[13] 万淑君,王 成,王 静,等.2型糖尿病微血管并发症患者血清miR-16,miR-126和miR-221水平检测及临床意义[J].现代检验医学杂志,2016,31(5):9-13.
[14] 郭晓莉,陈 艳,马卫国,等.血液循环中miR-126作为标志物对2型糖尿病肾脏疾病患者诊断的临床意义[J].临床肾脏病杂志,2017,17(6):361-365.
