复合诱变选育氢化可的松高转化率菌株
2018-05-28薛玮莹申雁冰黄炜王敏邓铭倩
薛玮莹,申雁冰,黄炜,王敏,邓铭倩
复合诱变选育氢化可的松高转化率菌株
薛玮莹,申雁冰*,黄炜,王敏*,邓铭倩
工业发酵微生物教育部重点实验室, 天津市工业微生物重点实验室, 天津科技大学生物工程学院, 天津 300457
蓝色犁头霉()是转化17-羟基孕甾-4-烯-3,20-二酮-21-醋酸酯(RSA)生成氢化可的松(简称HC)的生产菌株。因保藏菌种退化,为了进一步提高HC生产水平,对保藏菌株分离纯化后,利用常压室温等离子体诱变(简称ARTP)和ARTP-LiCl复合诱变的方法对一株蓝色犁头霉进行了诱变。建立了以菌落形态为标准的初筛方法,选取培养6 d后菌落颜色较深、背面呈环状纹路、菌丝较密集的菌株进行HC转化复筛,得到一株遗传稳定性较好的菌株AL-172,RSA浓度为3.5 g/L时,HC转化率达72.52%,底物投料浓度和HC转化率较实验室保藏菌株分别提高了40%和16.20%,具有良好的应用前景。
氢化可的松; 蓝色犁头霉; 诱变育种; 菌落形态; ARTP
氢化可的松(Hydrocortisone,简写HC)又称皮质醇、可的索,化学名为11,17,21-三羟基孕甾-4-烯-3,20-二酮,属肾上腺皮质激素类药物,是激素类药物中产量最大的品种之一,也是许多甾体激素类药物的中间体[1]。利用微生物的11-羟基化作用能生成HC的底物很多,其中应用最普遍的是RS(化学名17,21-二羟基-孕甾-4-烯-3,20-二酮)和RSA[2]。在自然界中发现许多微生物具有甾体11-羟基化能力,其中霉菌最多。目前已应用于工业化生产的菌种有两种,一是国外普遍采用的新月弯孢霉(),二是我国采用的蓝色犁头霉()[3-5]。
蓝色犁头霉转化RSA生产HC过程中,存在菌种退化,副产物表氢化可的松(11-Epihydrocortisone,EHC)比例高,菌株转化率较低等问题[9,10]。本研究首先将已退化的保藏菌株进行分离纯化,并根据菌落形态和转化率关系建立初筛方法,挑选出转化率高的菌株进行常压室温等离子体诱变(ARTP)和ARTP-LiCl复合诱变,通过菌落形态进行初筛,摇瓶复筛,筛选出一株转化能力强,副产物较少的HC生产菌株,对提高HC产量,增强我国HC市场竞争力,促进相关企业发展有着重要意义。
1 材料和方法
1.1 菌种和培养基
菌种:蓝色犁头霉(),由天津科技大学微生物制药研究室保存。
种子和发酵培养基(g/L):玉米浆12,酵母膏2.5,硫酸铵5,葡萄糖10.5,pH6.4~6.7。
PDA培养基(g/L):土豆200,葡萄糖20,琼脂20。
1.2 仪器
ARTP室温等离子诱变系统,北京思清源生物科技有限公司;CH20BIMF 200双目显微镜,日本OLYMPUS;Agilent 1260 型HPLC仪,美国Agilent。
1.3 初筛方法建立
根据菌落形态特征和HC转化率之间的关系建立初筛方法。将蓝色犁头霉孢子悬液梯度稀释后涂布,挑取单菌至空白平板,培养并观察菌落形态。根据不同菌落形态特征对菌株进行分类,测定具有同一菌落特征菌株的转化率,确定高产菌株具有的菌落特征,作为初筛条件。
1.4 甾体转化实验
菌种活化及斜面培养:将蓝色犁头霉菌株接种于斜面培养基上,28 ℃下培养7 d,至孢子成熟。
甾体转化:无菌水洗下斜面种子,制成3×107个/mL的孢子悬浮液。取1 mL孢子悬浮液接种于种子培养基中,于28 ℃、150 r/min培养17 h。按10%的接种量将种子接种于250 mL三角瓶中的30 mL发酵培养基中,在同样条件下培养至pH降低至3.8左右时,调节pH至5.4,投入1.2 mL底物RSA乙醇溶液(RSA终浓度为2.5 g/L),继续培养24 h,取样测定HC转化率。
1.5 ARTP诱变方法
本实验利用ARTP对蓝色犁头霉的孢子进行诱变,电源功率110 W,工作气体为99.99%氦气,样品与等离子体发射源距离为3 mm,工作气体流量为10 L/min,操作温度控制在26.0~30.0 ℃。
将斜面上的孢子洗下制成孢子悬液,调整孢子悬液浓度至1×106个/mL。取10 μL孢子悬液滴加在无菌载片上。选取适宜诱变时间进行诱变,将诱变后的孢子洗下涂布在平板上,挑取单菌培养,选取符合初筛条件的菌株进行复筛。
1.6 ARTP-LiCl复合诱变
ARTP诱变同方法1.5,诱变后洗下孢子悬液涂布于含有不同浓度LiCl的PDA平板上,挑取单菌培养,选取复合初筛的菌株进行复筛。
1.7 分析检测方法
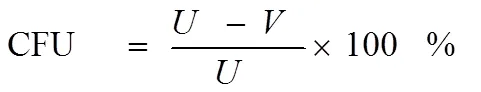
式中:其中为不经过诱变处理对照菌的总菌落数,为经诱变处理后对应的总菌落数。
1.7.2 LiCl致死率测定选取LiCl的浓度梯度为0,0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%,4.5%,5.0%,5.5%,6.0%(w/v)。将孢子悬液梯度稀释后涂布,进行单菌落计数,对比未经LiCl处理的单菌落数,根据公式计算致死率。
1.7.3 甾体化合物分析检测方法采用HPLC法,转化液样品用两倍量乙酸丁酯萃取,取100 μL有机相于1.5 mL离心管中,挥干后加1 mL流动相溶解,12000r/min离心10 min。然后用高效液相色谱仪检测,色谱柱为Eclipse C18(3.5 μm,150 mm×4.6 mm);流动相为V甲醇:V水=30:70;流速0.8 mL/min;柱温25 ℃;进样量20 μL;检测波长:240 nm。
2 结果与分析
2.1 初筛方法建立
文献研究表明,在霉菌诱变育种的过程中,可以根据霉菌的菌落形态特征建立初筛方法[11-13]。本研究对实验室保藏菌株进行分离纯化,将单菌转接在PDA平板上,28 ℃培养6 d后,分析菌落颜色、菌落背面形态、菌丝疏密与HC转化率之间关系,据此建立初筛方法。
2.1.1 菌落颜色与转化率的关系经过6 d培养后,菌丝已经基本覆盖整个平板,形成菌落的菌丝大部分已经完全成熟并形成孢子。如图1所示,菌丝完全成熟并产生孢子时,菌落的颜色主要由菌丝颜色、孢子自身的颜色和孢子数量决定。将菌株根据培养6 d后菌落颜色深浅进行分类,并检测其转化率。由表1可知,培养6 d后菌落颜色较深菌株的转化率明显偏高。

图1 培养6 d后菌落颜色
a:菌落颜色较浅 The bacterial colony color was lighter;b:菌落颜色居中 The bacterial colony color was mediate;c:菌落颜色较深 The bacterial colony color was deeper
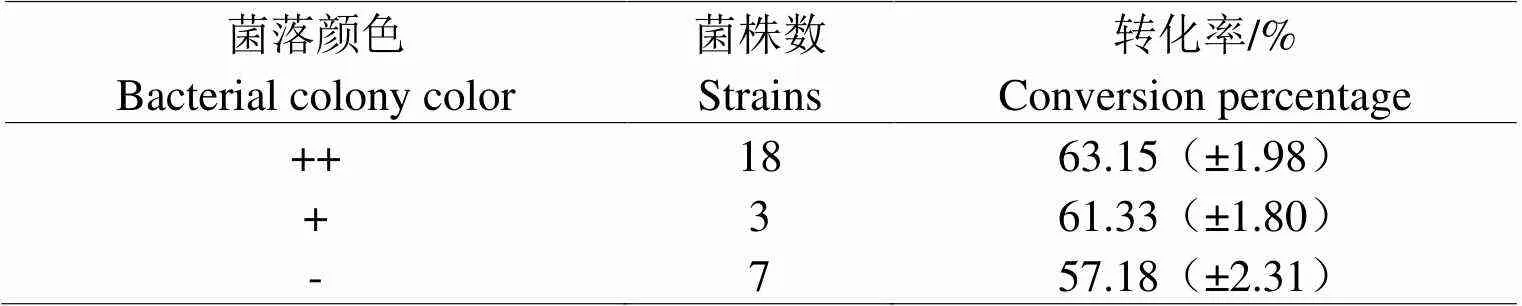
表1 菌落颜色和转化率之间关系
注:“++”代表颜色较深,“+”代表颜色居中,“-”代表颜色较浅。
Note: ++ presented the deeper color; + presented the mediate color;- presented the lighter color.
2.1.2 菌丝疏密程度与转化率的关系菌落形成后,由于菌株生长活力不同,菌丝的疏密程度不同。生长能力较强的菌株,菌丝生长的相对密集;反之,生长能力较差的菌株,形成菌落后菌丝则相对稀疏。如图2所示,在透射光照射的情况下菌丝疏密的差别尤为明显。将菌株分类后测定其转化率如表2所示,从中可看出,培养6 d后菌丝生长较密集的菌株转化率相对较高。
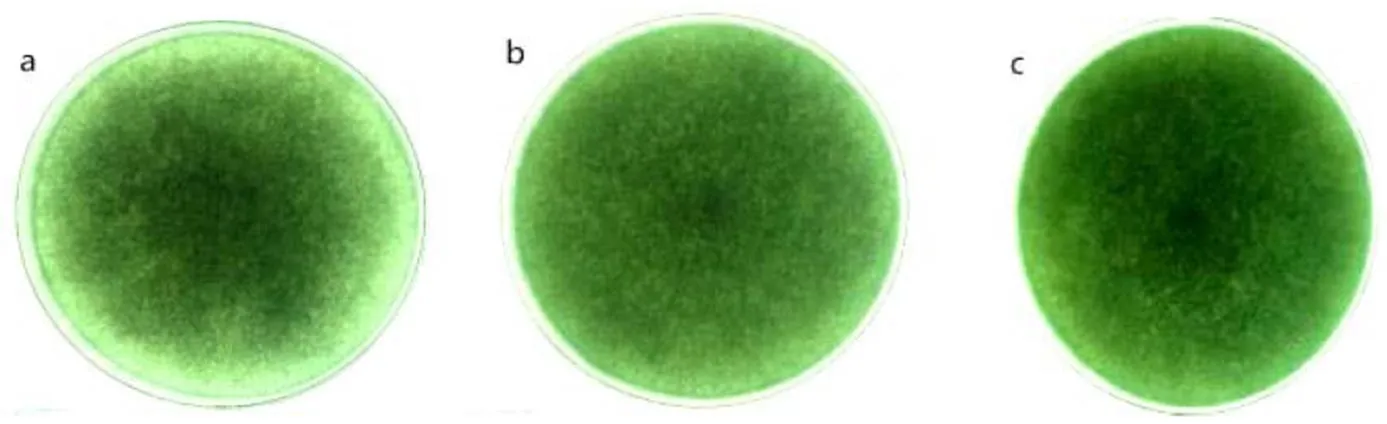
图2 培养6 d后菌丝疏密度
a:菌丝较稀疏 The sparser mycelinum;b:菌丝疏密度居中 The mediate mycelium;c:菌丝较密集 The denser mycelium
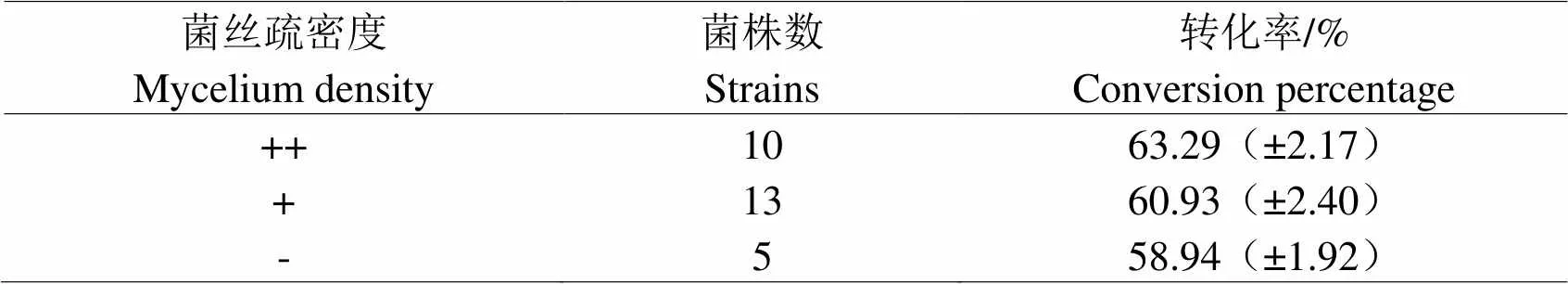
表2 菌丝疏密度和转化率之间关系
注:“++”表示菌丝密集,“+”表示菌丝疏密度居中,“-”表示菌丝稀疏。
Note: ++ presented the dense mycelium; + presented the mediate mycelium; - presented the sparse mycelium
菌落颜色和菌丝疏密度共同表征了菌株的生长状况和成熟速度。培养6 d后,菌丝密集的菌株菌丝生长较快,菌落颜色较深的菌株菌丝成熟较快,二者共同决定了菌株的生长和成熟情况。
2.1.3 菌落背面形态与转化率的关系菌丝完全覆盖平板后,菌落背面形态也有一定差别,如图3所示,一种形态为菌落在生长过程中背面形成环形纹路,由接种的位置向平板边缘形成断续的一环一环犹如靶环状纹路;另一种形态为菌落在生长过程中形成的背纹成星状向外扩散。背纹体现了菌落在生长过程中的生长“轨迹”,一定程度上代表了菌株的生长特性。根据背纹形态将菌株分为两类,转化率测定结果如表3。菌落背纹呈环状的菌株的转化能力要优于背面没有环状背纹的菌株。

图3 培养6 d后菌落背面形态
Fig.3 Colonial morphology on the back of plate after 6 days culture
a:菌落背面呈环状纹路The cyclic lines on the back of bacterial colony; b:菌落背面形成星状纹路 The stellated lines on the back of bacterial colony
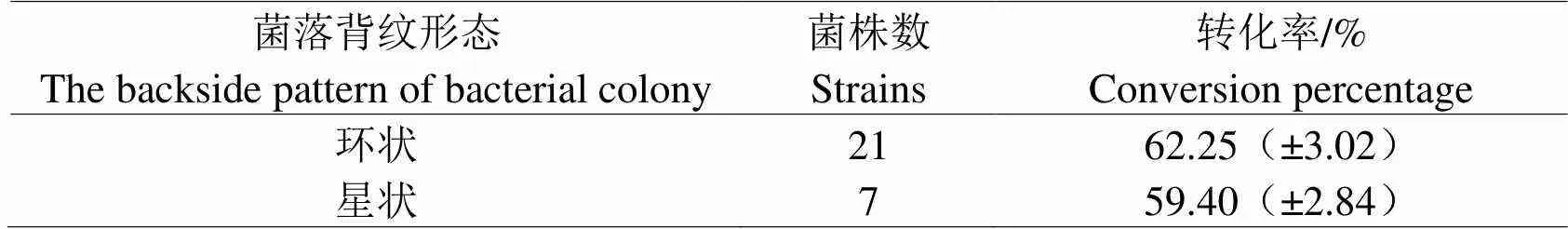
表3 菌落背面形态和转化率之间的关系
在现有的蓝色犁头霉诱变育种研究中,未见报道有快捷有效的初筛方法。本研究根据霉菌诱变育种过程中菌落形态的差异,根据蓝色犁头霉菌落形态特性与具有同一特性的菌株转化能力的平均值之间的关系建立初筛方法,将菌落颜色较深、菌落背面呈环状、菌丝较密集作为初筛标准,一定程度上提高了诱变育种的效率。
2.2 ARTP诱变菌株的获得
2.2.1 ARTP诱变时间的确定诱变时间通常通过诱变致死率确定,致死率过高,所得诱变菌株较少;致死率太低,突变率较低。考察了ARTP系统分别作用不同时间时出发菌株的致死率,致死率曲线如图4所示。由于不同菌株在不同致死率下可能呈现不同的正变率,在不确定致死率与正变率关系的条件下,为了增加正变菌株筛选的几率,选择致死率分别为84.73%,43.71%,26.65%时对应的照射时间50 s、35 s、30 s作为诱变时间。

图4 ARTP诱变的致死率曲线
2.2.2 ARTP诱变菌株的获得对ARTP诱变后的菌株进行初筛和复筛,挑选出三株HC转化率较高的菌株,转化率分别为69.85%、69.53%和69.45%。对此三株菌株进行遗传稳定性检测,菌株传代五次后,均体现良好遗传稳定性。转化率最高的菌株编号A-42,菌株的转化率提高至69.85%,较出发菌株的转化率增幅6.7%。以A-42作为ARTP-LiCl复合诱变的出发菌株。
2.2.3 LiCl添加浓度的确定不同LiCl浓度对孢子液的作用强度不同,在作用时间相等的情况下,LiCl浓度越高,作用强度越强。实验测定了LiCl浓度对菌株致死率的影响,结果表明LiCl添加量为1.5%、2.0%、2.5%时,致死率分别为35.06%,57.78%,84.44%。致死率保持在35%~85%的区间内,可以保证有一定数量的菌株存活,又能保证有一定的诱变作用。选取1.5%,2.0%,2.5%的LiCl添加浓度进行复合诱变实验。
2.2.4 ARTP-LiCl复合诱变菌株的获得根据2.2.1所述,仍采用30 s、35 s、55 s三个ARTP照射时间下的孢子混合液进行复合诱变。将孢子混合液梯度稀释后,涂布于含有LiCl的PDA平板上进行复合诱变,1 d后挑取单菌落至不含LiCl的PDA平板上进行培养。经初筛和摇瓶转化复筛测定,有18株菌株转化能力有较大提高。结果如图5所示,菌株AL-171、AL-172、AL-177对HC的转化能力最强,转化率分别为74.82%,74.87%,74.72%,且副产物含量较少。
对此三株菌株进行遗传稳定性分析,选择遗传稳定性优良的菌株进行条件优化。由表4可知,AL-172菌株对于HC的转化率保持在73.98%~74.87%之间,与另两株诱变菌株相比转化率较高,且实验平行性较好,遗传稳定性较强。AL-172菌株比A-42菌株增幅7.53%,比保藏菌株的转化率(62.41%)增幅19.96%。因此选取菌株AL-172进行后续试验。
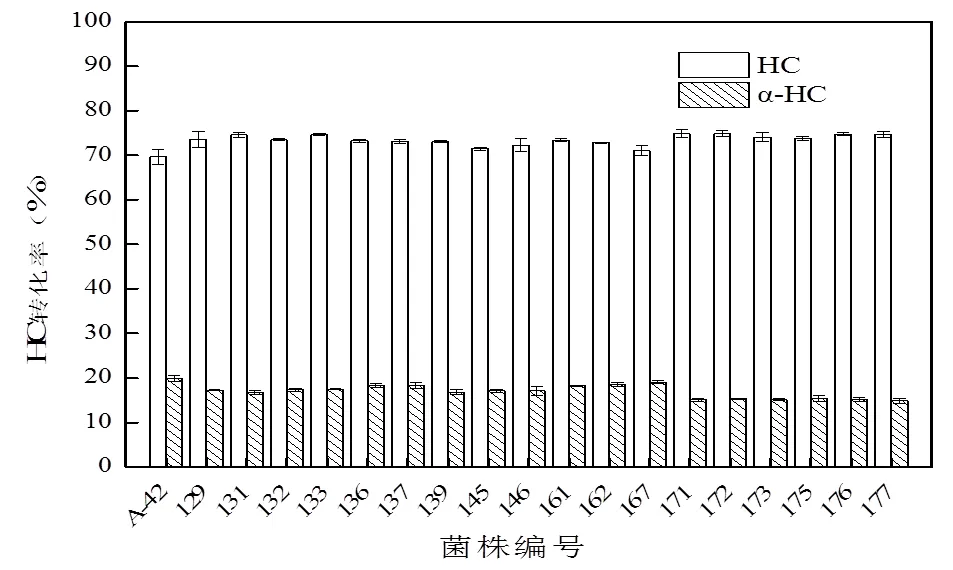
图5 ARTP-LiCl复合诱变菌株转化率
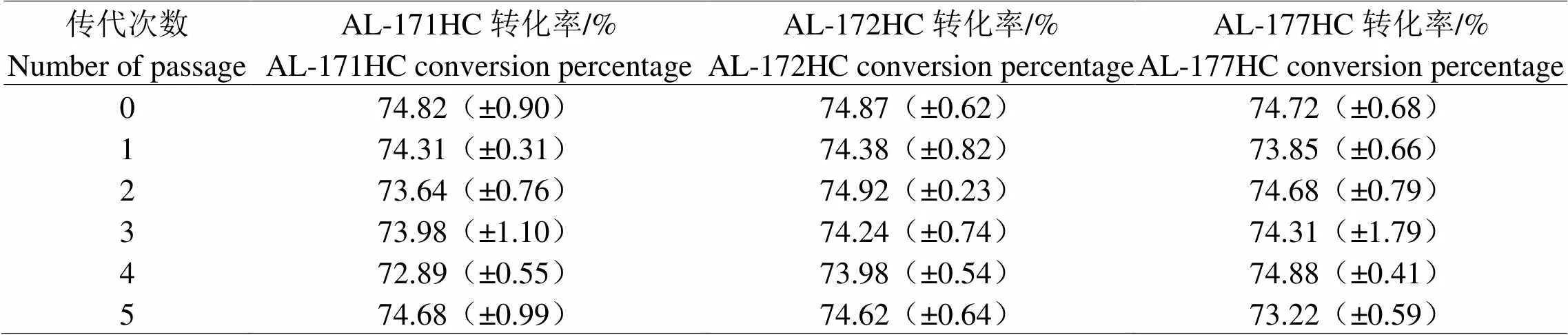
表4 ARTP-LiCl复合诱变菌株遗传稳定性测定
2.3 诱变菌株的高底物浓度生物转化反应
保藏菌株的HC转化率较低,不仅因为其副产物较多,对于底物的转化能力也较弱。摇床转化36 h后,其底物RSA仍有残留。诱变后菌株AL-172在24 h时底物已基本转化完全,对底物转化能力较强,因此探究其对高浓度底物的转化作用。在其他条件都不变的基础上,考察了不同底物浓度对生物转化反应的影响,结果如图6所示。

图6 不同底物浓度下HC的转化情况
由图6可知,随着底物浓度升高,HC的转化率略有降低,副产物和底物的剩余量略有升高。当底物浓度为3.5 g/L时,HC转化率达到72.52%,EHC含量略有升高,达到18.18%,且RSA和RS基本转化完全,较保藏菌株有较大提高。随着底物浓度升高,底物残留增加,因此将最适投料浓度确定为3.5 g/L。根据现有研究报道,蓝色犁头霉菌株在96 h内,投料量2%的条件下,HC的转化率在50%,另外生成25%的副产物[14]。诱变菌株AL-172转化率及专一性明显优于已有报道水平。
3 结论
采用ARTP诱变和ARTP-LiCl复合诱变的方法对转化RSA生成HC的蓝色犁头霉菌株进行了诱变。在此过程中,建立了以菌落形态为初筛标准的初筛方法,确定了在PDA平板上培养6 d后菌落颜色较深、菌落背纹呈环状、菌丝较密集作为初筛条件。诱变得到一株转化率高达74.87%的菌株AL-172,比实验室保藏菌株转化率提高了19.96%。在高浓度底物发酵实验中,菌株AL-172在底物浓度为3.5 g/L的高底物浓度转化过程中,转化率达到72.52%,较保藏菌株在投料浓度增加40%的条件下,转化率增幅16.20%。该菌株具有良好的工业应用前景。
[1] 孙熙年,金守满,元福实,等.氢化可的松生产菌-淡紫犁头霉(3.65)的选育[J].辽宁大学学报,1986(4):54-57
[2] 王敏,郭亚文,卢文玉,等.氢化可的松高转化菌株的选育及其发酵条件[J].应用与环境生物学报,2004,10(5):663-666
[3] 王敏.新月弯孢霉的甾体11-羟基化作用研究[D].天津:天津科技大学,2001
[4] 王超.-环糊精作用下甾体化合物的生物转化特性研究[D].天津:天津科技大学,2005
[5] Lu WY, Du LX, Wang M,. Effect of two-steps substrate addition on steroids 11-hydroxylation byCL-114[J]. Biochemical Engineering Journal, 2009,32(3):233-238
[6] 刘丹.产几丁质酶渤海丝状真菌()的筛选、鉴定及产酶研究[D].天津:天津师范大学,2012
[7] 刘燕,杨建松,王露,等.等离子诱变选育柠檬酸高产菌[J].天津科技大学学报,2014,29(1):16-19
[8] 谭俊.基于多尺度创新原理的工业微生物高通量筛选平台构建及应用研究[D].上海:华东理工大学,2013
[9] 范林萍.双菌转化RSA制氢化可的松新工艺的研究[D].甘肃:兰州大学,2010
[10] 赵荣,王敏,骆健美,等.蓝色犁头霉JY-2#的选育与发酵特性[J].天津科技大学学报,2006,21(4):44-47
[11] 宋敏,曹娟,张颖颖,等.不同菌落形态的链霉菌对产谷氨酰胺转氨酶的影响[J].广西农业生物科学,2008,27(4):436-439
[12] 乔长晟,杨朋朋,赵男,等.基于代谢途径分析的多杀菌素高产菌株筛选[J].湖北农业科学,2013,52(10):2309-2314
[13] 石漫漫.雷帕霉素高产菌株的选育与发酵工艺优化[D].天津:天津科技大学,2015
[14] 范林萍.双菌转化RSA制氢化可的松新工艺的研究[D].甘肃:兰州大学,2010
Breeding Strains with Compound Mutation for High Conversion Rate of Hydrocortisone
XUE Wei-ying, SHEN Yan-bing*, HUANG Wei, WANG Min*, DENG Ming-qian
300457,
is a production strain that converts 17 alpha-hydroxyprogesterone - 4-ene-3, 20-di-21-acetate (RSA) into hydrocortisone (HC). The preserved strain could degenerate, in order to further improve the level of HC production, after the isolation and purification of the preserved strain, the mutagenesis was carried out by using the compound mutagenesis method of Atmospheric temperature Plasma (art) and ARTP-LiCl. The primary screening method was established on the basis of colony morphology. After 6 days of culture, the colony color was darker, there was cricoid markings on the back, HC conversion was rescreened in the bacterial strain with dense mycelium, and the mutant AL-172 with high genetic stability was obtained. When the RSA concentration was 3.5 g / L, the conversion rate of HC reached 72.52 %. Substrate feed concentration and HC conversion rate increased by 40% and 16.20% respectively compared with laboratory preservation strains. It has a good prospect of application.
Hydrocortisone;; mutation breeding; ARTP
Q93-335
A
1000-2324(2018)03-0396-06
2016-07-12
2016-12-20
天津市科技计划项目(15ZCZDSY00510)
薛玮莹(1989-),女,硕士研究生. E-mail:wyxue23@163.com
Author for correspondence. E-mail:shenyb@tust.edu.cn; minw@tust.edu.cn
