紫花苜蓿9个盐响应相关基因表达模式
2018-05-26张亚玲吴清莹付佳琦崔国文
张亚玲,张 攀,尹 航,王 洋,孙 杰,吴清莹,付佳琦,崔国文
(东北农业大学动物科学技术学院,黑龙江 哈尔滨 150030)
土壤盐碱化是造成全球作物产量降低和品质下降的主要非生物胁迫之一。盐渍化土地是我国重要的、具有潜在利用价值的边际土地资源,总面积约有3 667万hm2,其中盐渍化耕地近670万hm2,约占全国总耕地的5%[1-2]。由于气候变化和农牧业生产活动的影响,我国盐碱化土壤的面积呈现日益扩大的趋势,而土地盐碱化造成的土壤理化性质变差、土地利用率降低、草地产量下降等问题严重威胁到农牧业生产和生态环境建设[3-4]。
牧草是可持续农业的重要组成部分,随着我国农业结构调整,草地畜牧业的发展使苜蓿在牧草产业中成为主导产业。紫花苜蓿(Medicagosativa)产量高、品质好、适应性强,是全球性栽培的豆科苜蓿属多年生草本植物,长期以来在生态治理、畜牧业发展和种植业结构调整中发挥着重要作用[5-6]。但盐胁迫会显著降低紫花苜蓿的产量,培育耐盐新品种是降低盐渍化土地对紫花苜蓿生长和产量影响的有效途径[7-8]。
植物的耐盐性是一个非常复杂的数量性状,涉及到多基因和多种耐盐机制的协调作用[9-10]。随着分子生物学的发展和转基因技术的进步,植物抗逆性研究已从传统的生理指标测定转变为对其分子机理的阐释[11-12]。Winicov和Button[13]分析了盐胁迫对紫花苜蓿光合作用相关基因表达的影响,结果显示,光合作用相关叶绿体基因psdD、psaB、atpB、rbcL以及核基因pCab4、pCab1、rbcS在紫花苜蓿中的表达增强。因此,全面研究并了解紫花苜蓿的盐相关基因的表达模式有助于紫花苜蓿耐盐分子育种。为此,基于盐胁迫下紫花苜蓿蛋白质组数据,通过生物信息学分析筛选出9个盐响应相关蛋白,在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中Blast其对应的编码基因序列,采用Primer Premier 5.0软件设计引物,用荧光定量PCR分析不同浓度NaCl胁迫处理、不同处理时间后其在紫花苜蓿中的表达模式,研究结果可为紫花苜蓿耐盐研究提供候选基因,并为研究其耐盐分子机制奠定基础。
1 材料与方法
1.1 植物材料
试验用紫花苜蓿种子为龙牧801(Longmu 801),由东北农业大学动物科学技术学院草业科学实验室提供。
1.2 材料培养与处理
选取籽粒饱满、健康的紫花苜蓿种子,用5%的次氯酸钠消毒10 min,蒸馏水冲洗4~5次后置于铺有滤纸的培养皿中,放入人工培养箱中暗培养,相对湿度60%~75%,培养温度25 ℃/20 ℃(日/夜),待苜蓿子叶展开后转入自制的苜蓿培养槽中,用改良的Hoagland营养液水培[14],每2 d换一次培养液。二周龄的紫花苜蓿幼苗转入NaCl浓度为0、0.2%、0.4%、0.8%的营养液中进行盐胁迫处理,处理时间分别为0、1、2、4、8 h,取整株幼苗为试验材料,样品立即进入液氮中冷冻处理并储存在-80 ℃冰箱中直至使用。每个处理设4个生物学重复。
1.3 总RNA的提取及其反转录
紫花苜蓿幼苗总RNA用TIANGEN的RNAprep Pure 植物总RNA提取试剂盒提取,用1%琼脂糖凝胶检测其完整性(图1a),用微量分光光度计进行浓度的测定。RNA的反转录用的HiScript Ⅱ Q Select RT SuperMix for qPCR (+gDNA wiper) 试剂盒(Vazyme,中国)进行,cDNA质量用Taq酶(Vazyme,中国)进行普通PCR鉴定(图1b)。
1.4 盐响应相关基因
盐响应相关基因的选择以前期获得的紫花苜蓿盐胁迫下差异表达蛋白质组数据为基础[4],通过生物信息分析差异蛋白的分子功能、参与的生物过程和代谢通路,然后筛选出9个盐响应相关蛋白,并在NCBI中Blast其对应基因的编码序列和登录号,获得盐响应相关基因(表1)。
图1 紫花苜蓿幼苗总RNA 电泳图和cDNA 质量评估图Fig. 1 Electrophoregram of total RNA and quality evaluation of cDNA of alfalfa seedlings
M,marker DL 2 000.
1.5 实时荧光定量PCR
实时定量PCR以紫花苜蓿肌动蛋白基因β-Actin作为内参,紫花苜蓿9个盐响应相关基因为目的基因,采用Premier 5.0进行引物的设计(表2),荧光定量PCR用ABI7500实时荧光定量PCR仪完成整个试验,反应体系(20 μL):10 μL 2×ChamQ SYBR qPCR Master Mix(Vazyme-ChamQ SYBR qPCR Master Mix),ROX Reference Dye 2(50 X) 0.4 μL,cDNA 1 μL,终浓度为10 μmol·L-1的上下游引物各0.4 μL,dd H2O 7.8 μL。反应结束后,通过检测溶解曲线来确定PCR产物的特异性,采用Livak和 Schmittgen[15]提出的2-ΔΔct计算基因在不同处理下的相对表达量。
1.6 数据处理
用Excel 2003进行数据前期处理,用SPSS 19.0软件对数据进行统计分析,用Origin 8进行绘图。
2 结果与分析
2.1 G6PI基因的表达分析
葡萄糖-6-磷酸异构酶(glucosamine-6-phosphate isomerase,G6PI)是催化葡萄糖-6-磷酸和果糖-6-磷酸(Fru6P)的可逆相互转化的细胞内酶。处理时间和浓度对G6PI基因的表达均有明显影响(图2)。NaCl处理1 h时,各浓度下G6PI基因的表达量均显著上调(P<0.05)。0.2% NaCl处理下,G6PI基因的表达量呈先升高后降低再升高的波动性变化;0.4% NaCl处理下,G6PI基因的表达量在4 h 时达到高峰;0.8% NaCl处理下,G6PI基因的表达量显著高于其他浓度的处理。
2.2 ABP19a基因的表达分析
生长素结合蛋白(auxin-binding protein,ABP)是广泛存在于高等植物中的生长素类物质,对植物生长发育有调节作用。NaCl处理浓度和时间均对ABP19a的表达量有显著影响(P<0.05)(图3)。NaCl处理1 h时,0.4% NaCl胁迫下,ABP19a的表达量先显著上调(P<0.05),然后逐步下降;NaCl处理2 h时,0.4%和0.8% NaCl胁迫的紫花苜蓿中ABP19a的表达量显著上调;0.2% NaCl胁迫下,ABP19a的表达量从4 h开始显著上调(P<0.05),8 h时的表达量是其他浓度处理下的6倍。
2.3 Trx-h1基因的表达分析
硫氧还蛋白(Thioredoxin,Trx)是具有催化活性二硫键的小型普遍存在的蛋白质。NaCl处理浓度和时间对Trx-h1的表达量都有显著影响(P<0.05)(图4);处理1 h时,除0.2% NaCl胁迫外,其他浓度处理下Trx-h1的表达量均有显著上调(P<0.05),且0.4%NaCl胁迫下上调幅度更大;0.2% NaCl胁迫下Trx-h1基因的表达量随时间无显著变化;0.8% NaCl胁迫下,Trx-h1基因的表达量先显著上调,4 h后显著下调。
2.4 PR bet 1家族蛋白基因的表达分析
病程相关蛋白(pathogenesis-related proteins,PR)是植物体在受到真菌、细菌和病毒等病原菌入侵或受到非生物胁迫后产生的一种或几种上调蛋白,广泛存在于单子叶和双子叶植物中。如图5所示,NaCl胁迫1 h时,各浓度处理与对照相比均有显著性上调(P<0.05),0.4% NaCl胁迫下的PRbet1家族蛋白基因的表达量最大,是同一时间点其他浓度处理的4倍;在0.2% NaCl胁迫下,PRbet1家族蛋白基因的表达量在NaCl胁迫处理1 h时表达量最大。
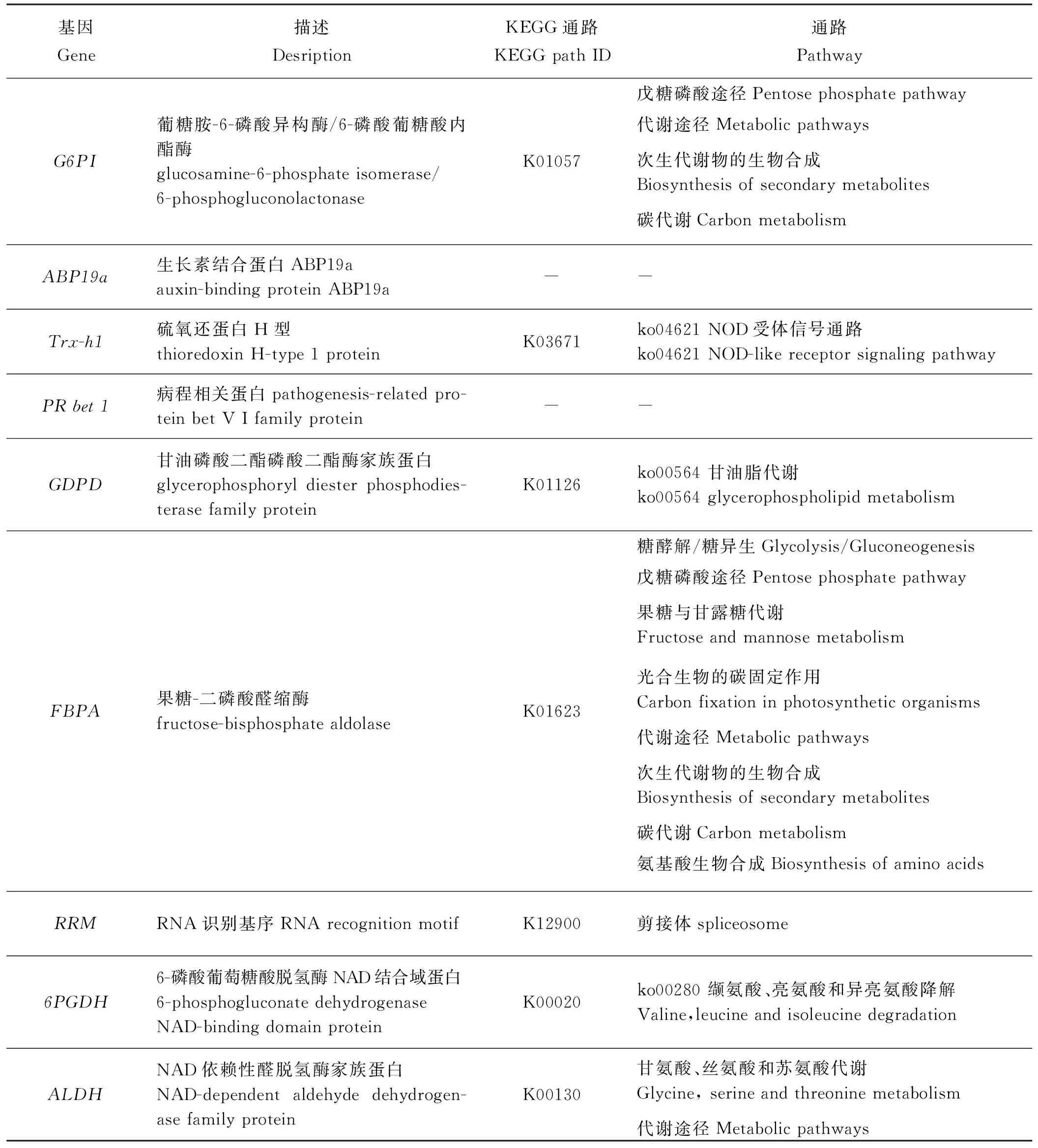
表1 9个盐响应相关基因的KEGG通路注释Table 1 KEGG path annotation of nine salt-tolerance genes
2.5 GDPD基因的表达分析
甘油磷酸二酯磷酸二酯酶(glycerophosphoryl diester phosphodiesterase,GDPD)催化甘油磷酸二酯类物质水解为甘油-3-磷酸(G-3-P)和相对应的醇类。如图6所示,NaCl胁迫处理1 h时,3个处理浓度较对照都有显著性变化(P<0.05);处理4 h后GDPD基因的表达量均显著升高;不同浓度处理之间,0.2% NaCl胁迫下GDPD基因的表达量变化最显著;在时间处理上,4 h是该基因表达量大幅上调的节点,8 h该基因表达量都显著上调(P<0.05)。

表2 实时荧光定量PCR引物序列Table 2 Primer sequences used for RT-PCR
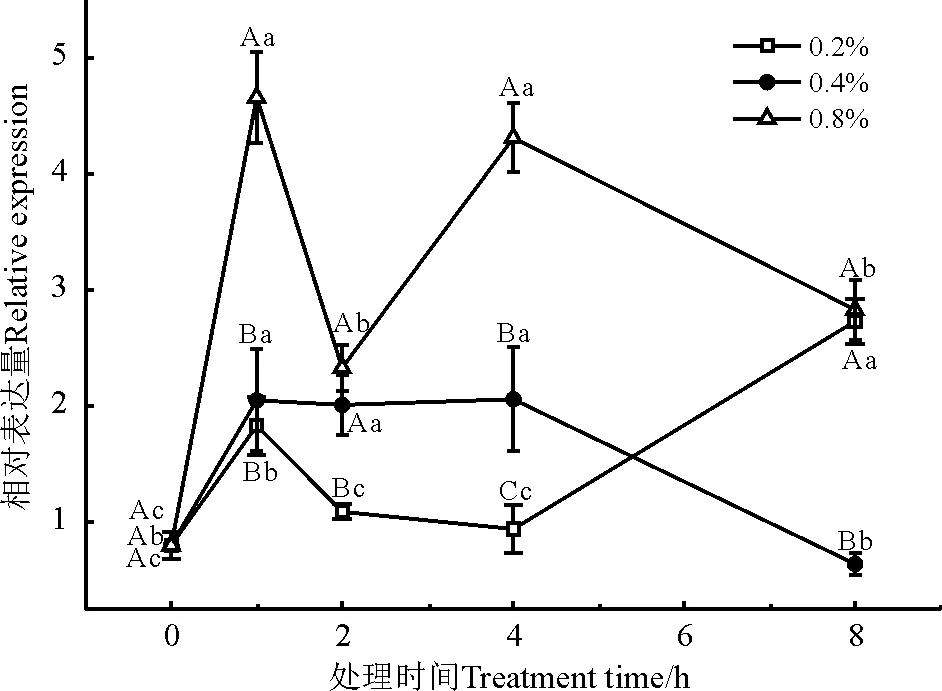
图2 盐胁迫下G6PI基因的相对表达量Fig. 2 Relative expression of G6PI gene under salt stress
不同大写字母表示同一处理不同浓度间差异显著(P<0.05),不同小写字母表示同一浓度不同处理时间间差异显著(P<0.05),下同。
Different capital letters indicate significant difference for the same treatment among different time at the 0.05 level; Different lowercase letters indicate significant difference in expression at different time at the same concentration at the 0.05 level,similarly for the following figures.
2.6 FBPA基因的表达分析
果糖-二磷酸醛缩酶(fructose-bisphosphate aldolase,FBPA)是生物体内碳代谢及糖代谢途径中的关键酶之一。NaCl处理浓度和时间对FBPA基因的表达量均有显著性影响(P<0.05);0.2% NaCl胁迫下,FBPA的表达量随时间无显著变化(P>0.05);0.4% NaCl胁迫下,FBPA的表达量在2 h最大;0.8% NaCl胁迫下,FBPA的表达量在2 h显著上调,在4 h时达到最大,并显著高于其他处理浓度和处理时间(图7)。

图3 盐胁迫下ABP19a基因的相对表达量Fig. 3 Relative expression of ABP19a under salt stress

图4 盐胁迫下Trx-h1基因的相对表达量Fig. 4 Relative expression of Trx-h1 under salt stress

图5 盐胁迫下PR bet 1基因的相对表达量Fig. 5 Relative expression of PR bet 1 under salt stress
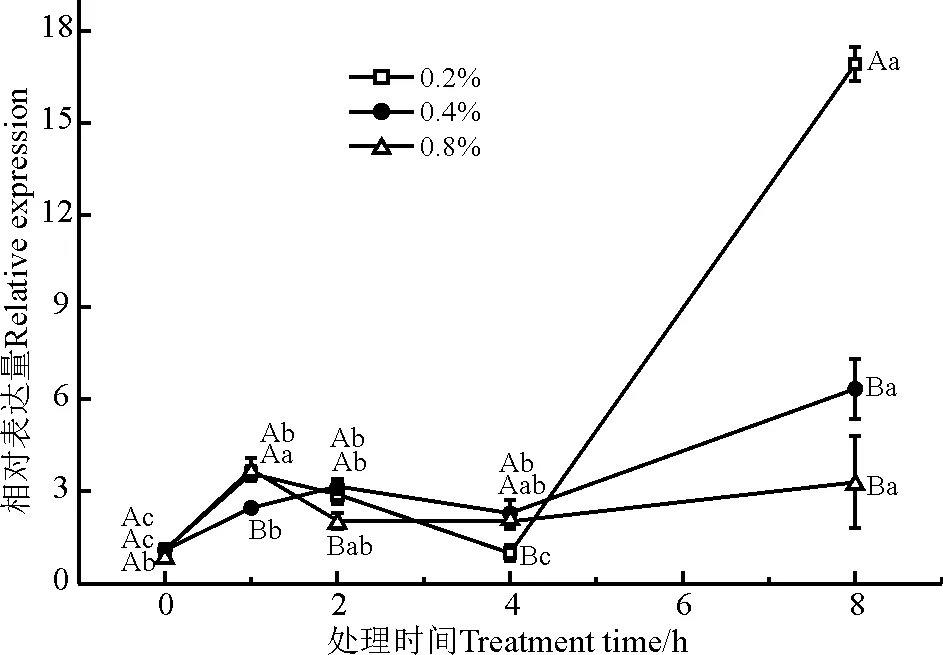
图6 盐胁迫下GDPD基因的相对表达量Fig. 6 Relative expression of GDPD under salt stress
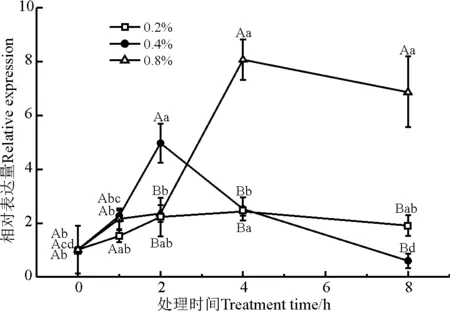
图7 盐胁迫下FBPA基因的相对表达量Fig. 7 Relative expression of FBPA under salt stress
2.7 RRM基因的表达分析
RNA识别基序(RNA recognition motif,RRM),被称为核糖核蛋白共有序列(RNP-CS)或RNA结合结构域,在植物基因表达和调控中起关键作用。如图8所示,NaCl处理浓度和时间对RRM基因的表达量都有显著影响(P<0.05)。0.2% NaCl胁迫下,RRM基因的表达量在胁迫初期有显著上调;0.4% NaCl胁迫下,RRM基因的表达量在2 h大幅上调,4 h表达量达到最大;0.8% NaCl胁迫下,RRM基因的表达量在2 h大幅度上调,8 h的表达量显著高于其他处理浓度(P<0.05)。
2.8 6PGDH 基因的表达分析
6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6PGDH)是戊糖磷酸途径的一个关键的限速酶。如图9所示,NaCl浓度和处理时间对6PGDH基因的表达均有显著影响(P<0.05);在NaCl胁迫处理1 h时,6PGDH基因的表达量均显著增加,且0.4%的浓度处理较其他2个浓度表达量更高;而0.8% NaCl胁迫下,PGDH基因的表达量在2 h后显著上调,在8 h时最大。

图8 盐胁迫下RRM基因的相对表达量Fig. 8 Relative expression of RRM under salt stress

图9 盐胁迫下6PGDH基因的相对表达量Fig. 9 Relative expression of 6PGDH under salt stress
2.9 ALDH基因的表达分析
醛脱氢酶(NAD-dependent aldehyde dehydrogenase family protein,ALDH)是一类依赖NAD(P)+的蛋白酶类。如图10所示,NaCl浓度和处理时间对于ALDH基因的表达均有显著性影响(P<0.05);在受到NaCl胁迫时,ALDH的相对表达量在1 h显著提高,然后逐步下降并在2 h时再次显著上调(P<0.05)。

图10 盐胁迫下ALDH基因的相对表达量Fig. 10 Relative expression of ALDH under salt stress
3 讨论与结论
G6PI参与糖酵解、戊糖磷酸、糖异生、糖原合成和葡萄糖醛酸等途径[16],并且可以作为响应诸如硝酸盐等环境因素的刺激的信使[17]。Eunsoo等[18]通过在烟草(Nicotianatabacum)中短暂过量表达芒草葡萄糖-6-磷酸异构酶基因(G6PI),增强了烟草中的抗氧化代谢相关基因的表达,并且在盐胁迫诱导下G6PI基因表达显著增加。Cui等[19]发现,DsGPI基因受盐度的强烈诱导,且盐度越高,诱导效果越强,表明DsGPI可能在耐盐性中起重要作用。本研究中,盐处理4 h后0.8%和0.4%浓度处理下G6PI基因表达开始下降,0.2%的表达量开始上升,表明高浓度的盐更能诱导G6PI基因的表达,且不同时间的处理对其也有显著影响。
生长素结合蛋白(ABP)通过生长素调节过程中的信号转导途径,参与生长素调节的植物生长发育过程[20]。研究表明,生长素类物质可通过促进幼苗快速生长来缓解盐胁迫[21]。Zolla等[22]研究发现,盐胁迫通过调控生长素浓度梯度和再分配影响拟南芥的侧根数、侧根和初生根生长及根的生长方向。在本研究中,盐处理对ABP19a基因的表达有显著影响,0.2%和0.4%浓度的盐处理对于基因表达量的影响更加显著;盐胁迫1 h时,0.4%的盐浓度的胁迫显著诱导该基因的表达,可能是在受到中浓度的盐胁迫时,该基因参与生长素的调节过程,缓解盐胁迫。
硫氧还蛋白在植物的抗逆系统中起较重要的作用[23]。研究发现,OsTRXhl的表达受盐处理的诱导,在OsTRXhl过表达植株中,盐处理所引起的细胞质外体的活性氧的积累与野生型相比明显减少,而OsTRXhl的RNAi植株的质外体中活性氧含量较多[24]。本研究中,盐胁迫1 h时,0.4%和0.8%盐处理下基因的表达量都显著增加,0.4%盐胁迫下Trx-h1基因的表达量变化更为显著,表明该浓度的盐更能诱导该基因的表达。
PR家族在不同植物中表现为几丁质酶、葡聚糖苷酶、蛋白酶抑制剂、内肽酶和过氧化物酶等,在植物自我防御机制中作为可诱导组分发挥作用[25-26]。研究发现,葡萄(Vitisvinifera)品种Razegui中的RzPR10蛋白受盐胁迫诱导[27]。本研究中PRbet1基因,在盐胁迫1碱h时各个盐胁迫的表达量都有显著的上调,0.4%的NaCl处理上调尤为显著,表明该基因对中高浓度的盐胁迫更加敏感。
GDPD参与甘油及G-3-P代谢,通过水解甘油磷酸二酯为细胞提供所必需的G-3-P[28-29]。在植物中有关GDPD及其相关生理功能的研究报道很少。有研究报道,GDPD-like (glycerophosphodiester phosphodiesterase-like)可能参与了非生物逆境的生理应答[30]。本研究发现,GDPD基因与紫花苜蓿的耐盐性相关,在盐胁迫1 h时各浓度处理下该基因的表达量都显著增加,表明该基因盐胁迫后期对于耐盐机制有重要作用,可能是由于GDPD参与甘油和G-3-P代谢相关。
在植物中,果糖二磷酸醛缩酶参与糖酵解、糖异生以及磷酸戊糖途径,并在碳代谢、糖代谢等过程中发挥着不可或缺的作用[31]。利用芯片杂交技术对干旱和盐胁迫条件下的大麦(Hordeumvulgare)转录水平上的变化研究结果表明,处理后大麦根中的果糖二磷酸醛缩酶的基因表达量发生上调变化[32];而通过Real-Time PCR方法对TaFBPA基因的表达模式的研究结果表明,在短期盐胁迫下,TaFBPA基因发生明显的上调表达[31]。这与本研究中FBPA基因对于盐胁迫的响应一致,基因的表达量在短期盐胁迫下显著上调,表明在盐胁迫初期,低盐更能诱导FBPA基因的表达。
RRM可通过与具有广泛亲和力和序列特异性的RNA结合,参与RNA代谢,并与多种蛋白质结构域相互作用[33],参与植物发育和应激反应,有时用作蛋白质或RNA分子伴侣[34]。Kwak等[35]研究显示,ORRM5表达对冷胁迫或盐胁迫条件有反应,但其对盐处理的反应不太显著。本研究中不同盐浓度和处理时间显著影响RRM基因的表达,表明RRM与多种蛋白质结构域相互作用来参与了盐胁迫的机制。
6PGDH可调节生物代谢产物,抵抗外界环境破坏,进而通过增强糖代谢途径提高作物的抗逆性[36]。有研究显示,苹果6PGDH受到盐胁迫不同程度的诱导[37];也有研究证明,Os6PGDH1的转录水平受高盐、低温、干旱和ABA等非生物胁迫的诱导[38];本研究结果显示,紫花苜蓿中6PGDH受盐胁迫的显著诱导,且中高浓度的盐对于基因的诱导更加显著,可能是通过提高基因的表达增强糖代谢途径,产生耐盐相关物质。
ALDH能够将外源和内生的脂肪醛和芳香醛不可逆的氧化为相应的羧酸,对提高植物抗干旱、抗盐碱和清除活性氧等能力具有重要作用[39-40]。有研究表明,过量表达ALDH的转基因拟南芥,其抗盐胁迫能力提高,且转基因植株的ROS含量显著低于野生型,表明醛脱氢酶在细胞代谢和逆境生理方面可能具有重要作用[41-42]。本研究显示盐胁迫对于该基因的表达有显著的诱导,不同浓度NaCl胁迫下紫花苜蓿ALDH基因的表达量都显著增加,可能是通过基因的表达将体内的一些物质氧化为相应的羧酸,清除活性氧降低其对植物的伤害。
本研究结果表明,处理时间和处理浓度对9个紫花苜蓿耐盐相关基因的表达量均有显著影响,即使同一个基因在不同强度的盐胁迫处理中的表达也不相同,这说明在不同盐胁迫条件下,苜蓿有不同的策略来应对盐胁迫,以保证自身正常的生长和发育。
参考文献References:
[1] 褚冰倩,乔文峰.土壤盐碱化成因及改良措施.现代农业科技,2011(14):309-311.
Chu B Q,Qiao W F.Causes and improving measures of soil salinization.Modern Agricultural Science and Technology,2011(14):309-311.(in Chinese)
[2] 舒朝成,刘彤,王倩,于成,庞晓攀,郭正刚,刘慧霞.不同盐浓度下播种量对紫花苜蓿植物学特性的影响.草业科学,2017,34(9):1889-1897.
Shu C C,Liu T,Wang Q,Yu C,Pang X P,Guo Z G,Liu H X.Effects of seeding rate on botanical characteristics ofMedicagosativeunder different salt concentration.Pratacultural Science,2017,34(9):1889-1897.(in Chinese)
[3] 张昆,李明娜,曹世豪,孙彦.白颖苔草对不同浓度NaCl胁迫的响应及其耐盐阈值.草业科学,2017,34(3):479-487.
Zhang K,Li M N,Cao S H,Sun Y.Response ofCarexrigescensto different NaCl concentrationsand its salinity threshold calculatiion.Pratacultural Science,2017,34(3):479-487.(in Chinese)
[4] 张攀.根瘤提高紫花苜蓿耐盐性的蛋白质组研究.杨凌:西北农林科技大学博士学位论文, 2014.
Zhang P.Root nodules confer salt tolerance upon alfalfa (MedicagosativaL.) plants,proteome analysis.PhD Thesis.Yangling:Northwest A&F University,2014.(in Chinese)
[5] 陈立强,师尚礼.42份紫花苜蓿种质资源遗传多样性的SSR分析.草业科学,2015,32(3):372-381.
Chen L Q,Shi S L.Genetic diversity of 42 alfalfa accessions revealed by SSR markers.Pratacultural Science,2015,32(3):372-381.(in Chinese)
[6] 王雪,李志萍,孙建军,冯长松,李绍钰.中国苜蓿品种的选育与研究.草业科学,2014,31(3):512-518.
Wang X,Li Z P,Sun J J,Feng C S,Li S Y.Progress of alfalfa breeding in China.Pratacultural Science,2014,31(3):512-518.(in Chinese)
[7] Bekki A,Trinchant J C,Rigaud J.Nitrogen fixation(C2H2reduction) byMedicagonodules and bacteroids under sodium chloride stress.Physiologia Plantarum,1987,71(1):61-67.
[8] 张立全,张凤英,哈斯阿古拉.紫花苜蓿耐盐性研究进展.草业学报,2012,21(6):296-305.
Zhang L Q,Zhang F Y,Hasiagula.Research progress on alfalfa salt tolerance.Acta Prataculturae Sinica,2011,21(6):296-305.(in Chinese)
[9] 单雷,赵双宜,夏光敏.植物耐盐相关基因及其耐盐机制研究进展.分子植物育种,2006,4(1):15-22.
Shan L,Zhao S Y,Xia G M.Research progress on the identification of salt-tolerance related genes and molecular mechanism on salt tolerance in higher plants.Molecular Plant Breeding,2006,4(1):15-22.(in Chinese)
[10] Zhu J K.Salt and drought stress signal transduction in plants.Annual Review of Plant Biology,2002,53(53):247-273.
[11] Shao H B,Guo Q J,Chu L Y,Zhao X N,Su Z L,Hu Y C,Cheng J F.Understanding molecular mechanism of higher plant plasticity under abiotic stress.Colloids and Surfaces B:Biointerfaces,2007,54(1):37.
[12] Shao H B,Jiang S Y,Feng M L,Chu L Y,Zhao C X,Shao M A,Zhao X N,Li F.Some advances in plant stress physiology and their implications in the systems biology era.Colloids and Surfaces B:Biointerfaces,2007,54(1):33-36.
[13] Winicov I,Button J D.Accumulation of photosynthesis gene transcripts in response to sodium chloride by salt-tolerant alfalfa cells.Planta,1991,183(4):478-483.
[14] 龙瑞才.紫花苜蓿盐诱导基因MsPBL和MsALD的克隆分析.重庆:重庆大学硕士学位论文,2010.
Long R C.Cloning and characteration of two salt-induced genesMsPBL andMsALDinMedicagosativaL. Master Thesis.Chongqing:Chongqing University,2010.(in Chinese)
[15] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)).Methods(San Diego,Calif.),2012,25(4):402-408.
[16] Yamamoto H,Miwa H,Kunishima N.Crystal structure of glucose-6-phosphate isomerase from Thermus thermophilus HB8 showing a snapshot of active dimeric state.Journal of Molecular Biology,2008,382(3):747-762.
[17] Munjral N,Gupta A K,Kaur N.Studies on glucose-metabolizing enzymes in cytosolic and bacteroidal fractions of mungbean (VignaradiataL.) and lentil (LensculinarisL.) nodules.Indian Journal of Biochemistry & Biophysics,2007,44(3):186-189.
[18] Seong E S,Yoo J H,Lee J G,Kim H Y,Hwang I S,Heo K,Lim J D,Lee D K,Sacks E J,Yu C Y.Transient overexpression of theMiscanthussinensisglucose-6-phosphate isomerase gene (MsGPI) inNicotianabenthamianaenhances expression of genes related to antioxidant metabolism.Plant Omics,2013,6(6):408-414.
[19] Cui L Q,Chai Y R,Li J,Liu H T,Zhang L,Xue L X.Identification of a glucose-6-phosphate isomerase involved in adaptation to salt stress ofDunaliellasalina.Journal of Applied Phycology,2010,22(5):563-568.
[20] 吴顺,萧浪涛,鲁旭东.植物的生长素结合蛋白.植物生理学报,2004,40(2):241-245.
Wu S,Xiao L T,Lu X D.Auxin-binding proteins in plants.Plant Physiology Journal,2004,40(2):241-245.(in Chinese)
[21] 李婧男,刘强,李升.生长素和氯化钙对盐胁迫下沙冬青幼苗的缓解作用.植物研究,2010,30(1):27-31.
Li J N,Liu Q,Li S.Mitigative effect of IBA and CaCl2on under salt stressAmmopiptanthusmongolicusseedlings.Bulletin of Botanical Research,2010,30(1):27-31.(in Chinese)
[22] Zolla G,Heimer Y M,Barak S.Mild salinity stimulates a stress-induced morphogenic response inArabidopsisthalianaroots.Journal of Experimental Botany,2010,61(1):211.
[23] 王玉成,杨传平,刘桂丰,姜静.紫杆柽柳cDNA文库构建与硫氧还蛋白基因的克隆.分子植物育种,2004,2(5):667-673.
Wang Y C,Yang C P,Liu G F,Jiang J.Construction ofTamarixandrossowiicDNA library and cloning of thioredoxin gene.Molecular Plant Breeding,2004,2(5):667-673.(in Chinese)
[24] 张翠军.水稻质外体h型硫氧还蛋白OsTRXh1对水稻生长发育和胁迫反应的调节及其机制.石家庄:河北师范大学博士学位论文,2010.
Zhang C J.Regulation of plant growth and sstress response by Apoplastic h-type thioredoxinOsTRXh1 in Rice.PhD Thesis.Shijiazhuang:Hebei Normal University,2010.(in Chinese)
[25] Loon L C V,Pierpoint W S,Boller T,Conejero V.Recommendations for naming plant pathogenesis-related proteins.Plant Molecular Biology Reporter,1994,12(3):245-264.
[26] Lcvan L,Eavan S.The families of pathogenesis-related proteins,their activities,and comparative analysis ofPR-1 type proteins.Physiological & Molecular Plant Pathology,1999,55(2):85-97.
[27] Jellouli N,Jouira H B,Skouri H,Ghorbel A,Mliki A.Proteomic analysis of Tunisian grapevine cultivar Razegui under salt stress.Journal of Plant Physiology,2008,165(5):471-481.
[28] Larson T J,Ehrmann M,Boos W.Periplasmic glycerophosphodiester phosphodiesterase ofEscherichiacoli,a new enzyme of the glp regulon.Journal of Biological Chemistry,1983,258(9):5428.
[29] 王崇,程玉祥.AtGDPD-Like6和AtGDPD-Like7基因启动子表达特性及AtGDPDLike6蛋白定位.北方园艺,2015(11):90-94.
Wang C,Cheng Y X.The expression patterns ofArabidopsisthalianaGDPDL6 anGDPDL7 and the subcellular localization ofGDPDL6.Northern Horticulture,2015(11):90-94.(in Chinese)
[30] Choi C S,Sano H.Abiotic stress induces demethylation and transcriptional activation of a gene encoding a glycerophosphodiesterase-like protein in tobacco plants.Molecular Genetics & Genomics,2007,277(5):589-600.
[31] 杨亚南.小麦根中盐胁迫响应基因FBPA的克隆及鉴定.济南:山东大学硕士学位论文,2009.
Yang Y N.Isolation and identification of a salt-stress responsive geneFBPAin the root of wheat.Master Thesis.Ji’nan:Shandong University,2009.(in Chinese)
[32] Oztur Z N,Talame V,Deyholos M,Michalowski C B,Galbraith D W,Gozukirmizi N,Tuberosa R,Bohnert H J.Monitoring large-scale changes in transcript abundance in drought- and salt-stressed barley.Plant Molecular Biology,2002,48(5/6):551.
[33] Allain F H.The RNA recognition motif,a plastic RNA-binding platform to regulate post-transcriptional gene expression.The FEBS Journal,2005,272(9):2118.
[34] Wang S,Bai G,Wang S,Yang L,Yang F,Wang Y,Zhu J K,Hua J.Chloroplast RNA-binding protein RBD1 promotes chilling tolerance through 23S rRNA processing inArabidopsis.Plos Genetics,2016,12(5):e1006027.
[35] Kwak K J,Kim Y O,Kang H.Characterization of transgenicArabidopsisplants overexpressingGR-RBP4 under high salinity,dehydration,or cold stress.Journal of Experimental Botany,2005,56:3007-3016.
[36] Hou F Y,Huang J,Yu S L,Zhang H S.The 6-phosphogluconate dehydrogenase genes are responsive to abiotic stresses in rice.Journal of Integrative Plant Biology,2007,49(5):655-663.
[37] Kruger N J,Von S A.The oxidative pentose phosphate pathway:Structure and organisation.Current Opinion in Plant Biology,2003,6(3):236-246.
[38] 苏玲,刘鑫,安建平,李浩浩,赵锦,郝玉金,王小非,曲春香.苹果6-磷酸葡萄糖酸脱氢酶基因Md6PGDH1的克隆和功能分析.园艺学报,2016,43(7):1225-1235.
Su L,Liu X,An J P,Li H H,Zhao J,Hao Y J,Wang X F,Qu C X.Molecular cloning and functional analysis of a 6-phosphoglueonate dehydrogenase geneMd6PGDH1 in apple.Chinese Journal of Horticulture,2016,43(7):1225-1235.(in Chinese)
[39] Kirch H H,Bartels D,Wei Y,Wood A J.TheALDHgene superfamily ofArabidopsis.Trends in Plant Science,2004,9(8):371-377.
[40] 张玉成.葡萄醛脱氢酶(ALDH)和JASMONATE ZIM-Domain(JAZ)基因家族的鉴定和分析.杨凌:西北农林科技大学硕士学位论文,2012.
Zhang Y C.Gendme-wide identification and analysis of grape aldehyde dehydrogenase(ALDH) and jasmonate zim domain(JAZ) gene families.Master Thesis.Yangling:Northwest A & F University,2012.(in Chinese)
[41] Kotchoni S O,Kuhns C,Ditzer A,Kirch H H,Bartels D.Over-expression of different aldehyde dehydrogenase genes inArabidopsisthalianaconfers tolerance to abiotic stress and protects plants against lipid peroxidation and oxidative stress.Plant,Cell & Environment,2006,29(6):1033-1048.
[42] Sunkar R,Bartels D,Kirch H H.Overexpression of a stress inducible aldehyde dehydrogenase gene fromArabidopsisthalianain transgenic plants improves stress tolerance.Plant Journal for Cell & Molecular Biology,2003,35(4):452-464.
