基于可穿戴式传感装置的帕金森运动症状量化评估的研究进展
2018-05-25戴厚德熊永生蔡国恩林志榕叶钦勇
戴厚德 熊永生,2 蔡国恩 林志榕 叶钦勇*
1(中国科学院海西研究院泉州装备制造研究所(中国科学院福建物质结构研究所),福建 泉州 362200)2(中北大学计算机与控制工程学院,太原 030051)3(福建医科大学附属协和医院神经内科,福州 350001)
引言
帕金森病(Parkinson′s disease, PD)是发病率仅次于阿尔茨海默病的神经系统变性疾病[1],震颤、缓慢运动、肌肉僵直、姿势步态障碍等运动症状严重影响了病人的生活质量[2]。据统计,65岁以上人群的帕金森发病率是1%~2%,全球现有患者400万以上,其中一半分布在中国;PD患者数目将随着人口老龄化进程而急剧增加[3]。目前已经有越来越多的PD治疗手段,但是尚无治愈的方法;并且经过一段时间治疗后,会逐渐出现症状波动和异动症等并发症,所以需要长期的运动症状监测[4]。目前,PD症状的严重程度及其治疗效果主要由神经科医生参照PD综合评分量表(UPDRS)等评价标准[5-6],根据电生理以及影像检查手段或者凭经验和感觉进行诊断[7]。这要求评价人员具有较高的专业技能,不同评价者的评价结果也具有个体差异性。典型地,由于没有持久有效监测药效的手段,在药物治疗中对病人的用药剂量大多依据经验判断;症状严重的病人在深脑刺激手术(DBS)中刺激电极放置点和刺激参数的选取至关重要,由于术中磁共振成像技术(iMRI)尚未广泛应用,这就需要医生在手术过程中在目标区域对4个以上目标点逐点进行电极植入测试,通过记录神经核团放电特征参数的微电极记录技术(MER)和对病人运动症状经验性直接观察相结合的方法进行对比判断,进而选取相对最佳的刺激靶点和参数,这也是DBS手术过程需要长达4~6 h的主要原因[8-9]。所以,PD运动症状的量化评估至今是PD治疗中的一个难题[10]。随着基于微机电系统(micro-electro-mechanical systems,MEMS)惯性传感技术为主的运动传感器的发展[11],国内外研究者利用可穿戴式传感装置来客观定量地评估PD运动症状,这是实现PD的早期发现、病情诊断和疗效反馈的有效辅助性工具。下面介绍和讨论用于PD运动症状量化评估的可穿戴式装置及其临床试验等方面的研究进展。
1 MEMS运动传感器技术及可穿戴式系统
国内外的科研人员已经基于传感器和计算机系统来量化评价PD运动症状。患者需要演示规定的若干动作,通过惯性传感器、肌电传感器、电磁传感器或光学传感器等进行病人特定部位的运动跟踪,通过对传感器数据进行分析,得到PD运动症状量化评估值。
随着MEMS惯性感测技术的飞速发展,具有微型化、低功耗和内嵌信号处理算法的MEMS运动传感器(包括磁力计、加速度计和陀螺仪及其组合)应用于消费电子和医疗电子中,测量加速度、倾斜、冲击、振动、旋转等多自由度的线性和旋转运动。标志性的是2006年任天堂公司的游戏机Wii最先广泛采用MEMS加速度计,苹果公司于2010年推出6轴惯性测量单元(IMU,3轴陀螺仪和3轴加速度计组合)的iPad和iPhone,以及各个厂家于2013年开始推出的嵌入9轴航姿参考系统(AHRS)的各种智能手环和手表。与此同时,MEMS惯性感测技术在PD运动症状的量化评估方面占据主导地位[11]。
如图1所示,第一个广泛应用的PD运动症状监测商用产品主要是美国大湖公司(Great Lakes Neurotechnologies, GLN)的Kinesia系列产品,该产品获得美国国家卫生研究院(NIH)资助,并且已经通过美国食品药品监管局(FDA)的批准上市销售[12]。该系统基于病人佩戴的MEMS 传感器模块,并通过运行于平板电脑或手机的软件来监测帕金森病震颤和缓慢运动的严重程度。自2008年以来,美国大湖公司在Parkinsonism & Related Disorders和Movement Disorders等期刊发表了20余篇期刊论文。该系列产品的缺点是没有肌肉僵直和姿态步态障碍的测量功能,并且每次测量结束需要人工在测量系统用户界面点击是否接受测量结果[13]。

图1 美国大湖公司的Kinesia系列产品[13]
如图2、3所示,自2010年开始,慕尼黑工业大学Tim Lueth教授团队(Niazmand、Dai、Zhao和Coy等)[14-24]开发了集成震颤、缓慢运动和肌肉僵直量化评估的可穿戴式系统,并被集成于德国Inomed GmbH公司的DBS手术监测系统,以实现最佳的电极靶点选取和最优化的刺激参数调整。该系统基于MEMS IMU和压力传感器,实现了在DBS手术中对肌肉僵直的实时量化检测。此外,帕金森步态冻结检测与评估系统可以通过MEMS加速度计,检测步态冻结并进行离线分析[21,24]。
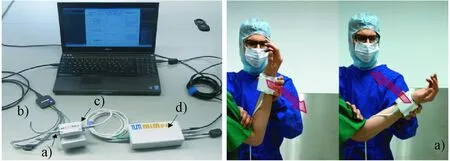
图2 慕尼黑工业大学Lueth教授团队和Inomed公司共同开发的帕金森运动症状量化检测系统[22]

图3 慕尼黑工业大学Lueth教授团队开发的帕金森步态冻结检测与评估系统[24]
美国英特尔公司正在与非营利组织Michael J. Fox Foundation (MJFF) 合作,进行基于云平台的帕金森病人运动症状测量模式的研究。患者利用智能手机内部的运动传感器监测自身的运动信息并上传到云平台,然后研究人员对收集到的信息进行大数据分析[25]。苹果公司和谷歌公司也在进行基于可穿戴设备的类似大数据分析,其中首都医科大学宣武医院等国内外多个医疗机构参与了基于苹果公司可穿戴产品的PD运动症状量化评估研究[26]。
虽然国内在用于运动检测的智能手环等可穿戴式装置的研发和生产方面处于世界领先地位,但用于帕金森运动症状定量评估专用装置的应用较少,其中中科院苏州生物医学工程技术研究所王守岩教授团队已经开发出定量评估帕金森震颤的智能手环,并正在进一步批量化生产[27]。
在科研方面,用于PD运动症状量化评估的系统主要有:Salarian等基于多个陀螺仪传感器的PD震颤、缓慢运动的无线分析评估系统,具有小巧轻便和长时间监测等优点[28];Cole等基于加速度计和肌电传感器的PD震颤和异动症的量化评估系统,该系统运用机器学习算法,提高了评估的准确性[29];Patrick等基于陀螺仪、压力传感器的PD肌肉僵直测量评估系统,得出肘部和手腕的机械阻抗与UPDRS评分,有着较好的相关性[30];Salarian等基于四肢的多个陀螺仪的PD步态障碍监测分析系统,得到了多个相关性较高的量化参数,具有一定的可行性[31]。
由于帕金森4个运动症状严重程度具有较大的波动性,且在长期药物治疗下会表现出异动症和开关效应等副作用,所以现有的帕金森运动症状量化评估系统还不能广泛地应用于临床[32]。这些量化检测系统存在的主要问题是:在单个装置上面,如何准确、稳定和实时地检测所有的帕金森运动症状。下面将详细介绍各个运动症状的检测方法及现有系统达到的准确度,包括基于MEMS运动传感器技术的量化检测方法及其与神经科医生依据UPDRS量表的临床判断的相关性。
2 基于运动传感技术的帕金森运动症状评估方法
帕金森运动症状量化评估系统的算法实现为基于运动传感器信息进行运动跟踪和统计分析,各主要症状对应的参数和计算方法如表1所示。

表1 帕金森病人运动症状量化评估方法
帕金森运动症状量化评估系统依赖于运动跟踪精度和临床实验的统计分析。由表1可知,每个运动症状的参数和计算方法有着显著的差异性,故下面按照各个运动症状及其并发症特性与量化评估方法展开讨论。
2.1 PD震颤的量化评估
德国弗莱堡大学的Timmer教授研究表明,PD震颤表现为非严格周期性的二阶非线性随机振动[33];美国南伊利诺伊大学Elble和哥伦比亚大学、梅奥医学中心、休斯顿Methodist医院以及德国基尔大学合作开展的928例PD样本研究表明,震颤患者的手部震颤幅度与5点式PD震颤临床检测标准成对数关系[34],之后许多研究者在此基础上建立了量化评估模型。大湖公司Giuffrida等对基于IMU信号的20例PD患者指尖震颤数据进行频谱分析,发现传感器信号主频率点附近功率谱分布和神经科专家对震颤的严重程度评价(UPDRS评分)表现为高度相关性(静止性和姿态性震颤决定系数r2分别为0.89和0.90),可以作为震颤的量化参数[35];动作性震颤的信号分析受到病人自身动作信号的影响,运动传感器时域信号的均方根与医生评价得到UPDRS参数的决定系数r2=0.69。Daneault 等对16例PD患者放置于上肢的手机内加速度计信号进行谱分析,得到的静止性和姿态性震颤决定系数r2分别为0.58和0.72[36]。类似的,Kostikis等通过智能手机内部的运动传感器进行基于机器学习算法的PD震颤分析,25例患者的临床实验结果表明,该算法的诊断敏感性和特异性可以达到82%和90%,但是该方法还无法判断出病人的震颤严重等级[37]。Cole等用三轴加速度计和表面肌电传感器采集8例PD患者的震颤数据,通过动态神经网络、动态支持向量机、隐马尔可夫模型3种机器学习方法分别对数据进行分类对比,得到震颤严重程度(轻度、中度、重度)分类的结果准确率都大于95%,相比于传统的频谱分析、回归分析方法在精度上有一定的提升[29]。
中科院苏州医学工程技术研究所王守岩教授团队开发的智能手环可以获得PD患者的运动状态信号,经过频谱分析得到患者手部震颤频率和幅度,再与预先设定的病情表进行对比,以评估其病情的严重程度[27]。南京理工大学郄剑文等利用固定在患者大腿、胸腔和手腕上的3组IMU进行基于决策树特征分类器的震颤分析,30次的试验验证可以达到86.7%的震颤分类识别率[38]。中科院海西研究院戴厚德团队通过MEMS运动传感器采集了7例PD患者的运动症状数据,进行时频分析和回归建模,然后进行稳态分析和频谱分析,得到的震颤量化评估结果和UPDRS评分具有高度相关性(r2=0.96),能够较好地反映震颤的严重程度[20]。
综上所述,震颤信号分析普遍采用功率谱分析方法,目前精度(决定系数r2)低于0.96,尤其是运动性震颤的量化检测还比较困难(r2<0.7)。
2.2 PD缓慢运动的量化评估
临床上评估PD缓慢运动症状的测试动作是在固定时间内反复扣指、手掌张合和摆动手掌等。因为PD病人执行设定动作时的频率和幅度的不稳定性与其缓慢运动症状的严重程度呈现高度相关性,通常利用放置在PD病人肢体末端的惯性传感器来测量角位移,进而分析其幅度和频率[39-42]。
Espay等对85例PD患者的研究表明,基于传感器测量的PD病人手部动作的速度、幅度和节奏特征与病人的缓慢运动症状严重程度有一定的相关性(r2=0.55)[39],可以作为病情评估的参考。大湖公司Heldman等通过放置于脚部的传感器单元采集了42例PD患者的运动数据,再经过多元线性回归分析方法得到脚部缓慢运动症状和医生诊断结果之间的平均决定系数r2=0.55,平均均方根误差为0.47[40];Mentzel等对70例PD患者数据用相似的回归分析方法,得出了其上肢的缓慢运动症状严重程度与医生评分的相关性(r2)为0.67[41],可以较好地评估病人的病情。Martinez-Manzanera等利用9轴Shimmer模块采集了25例PD患者3种动作的运动数据,用特征训练过的支持向量机分类器进行分类再和医生评分对比,实验得到分类的错误率分别为15%~16.5%,9.3%~9.8%,18.2%~20.2%,表明机器学习算法的运用提高了分类评估的稳定性和准确性,更有助于缓慢运动症状的监测和评价[42]。
帕金森缓慢运动的评估动作相对于震颤更好实现,但是其精度(r2)低于0.7。
2.3 PD肌肉僵直的量化评估
肌肉僵直是通过DBS可以明显改善的一个症状,在调节电极刺激参数时4个主要运动症状的改变各不相同,但肌肉僵直症状更难于精确测量[10],需要使用差分式压力传感器或者肌电传感器配合MEMS运动传感器,对关节的外部施力和运动状态进行检测跟踪,然后通过算法得到肘关节或腕关节的机械阻抗及其弹性和黏性分量[43-49]。
Xia[44-45]、Patrick[46]、Fung[47]和Mak[48]等的多个研究表明,基于运动传感器的机械阻抗测量和PD肌肉僵直临床评估结果的相关性(决定系数r2=0.36~0.74)优于基于表面肌电图的测量(r2=0.14~0.62)。Park等开展了涉及45例PD患者的研究,发现从手腕关节机械阻抗测量中提取的多个黏弹性特性(最小平方估计方法求得)和肌肉僵直症状临床评估的相关性(r2)介于0.35~0.8之间,其中相关性最好的是伸展和弯曲动作的平均黏性特征,该结果表明黏性分量可以作为肌肉僵直症状量化评估的主要参数[49]。
帕金森肌肉僵直量化检测的装置最为复杂,其精度也不高于0.8。
2.4 PD姿势步态障碍的量化评估
姿势步态异常通常表现为步态不稳和冻结。通过双脚鞋跟佩戴的两个运动传感器的组合,可以得到双脚运动的三维姿态角及其运动角度轨迹;通过步态频率和幅度的稳定性测量,可以得到姿势步态异常参数[50-53]。
Kaminsky等、Hundza等的研究表明,基于运动传感器信号的特征分析,可以检测出PD病人步态不稳和步行冻结[50-51]。Demonceau等通过对采集的64例PD患者运动数据的统计分析,得到步态特征和医生评分相关性r约为-0.3,P<0.05,评估的准确性还有待提高[52]。如图3所示,Zhao等通过内嵌裤子的多个加速度计信号进行频谱分析,得到步态冻结的实时信息,并通过激光束引导、肩部的震动和声音提示来辅助病人恢复正常步态[21-22]。Nancy等提出一种Q反向传播时延神经网络分类器来建立分类模型,通过反向传播训练算法和权重调整等处理来分类和预估PD姿势步态障碍症状,93例PD患者和73例健康人的实验分类结果的平均准确率为91%,这种改进的机器学习算法明显优于其他算法,推动了PD步态障碍量化评估的进展[53]。
2.5 PD症状波动对运动症状影响及异动症量化评估的影响
中晚期帕金森病患者会出现症状波动和异动症等运动并发症,其中症状波动(motor fluctuation)包括疗效减退(wearing-off)和开关效应(ON-OFF phenomenon)[32]。受药效开关效应、环境及患者心理等多重因素的影响,通常帕金森病人的症状严重程度具有较大的波动性,例如即使在数秒时间内震颤幅度也会有较大波动。所以,对传感器信号进行稳态分析就非常重要,症状评估时应记录已服药时间间隔等相关信息,并去除处于非稳态的运动症状测量。戴厚德团队开发了帕金森症状量化评估系统,通过对固定时间长度内的震颤频率和幅度的稳定性进行判断,提高了检测数据的有效性[18,20,54],如图4、5所示。

图4 中科院海西研究院(福建物质结构研究所)戴厚德团队开发的帕金森症状量化评估系统[54]

图5 某病人的震颤波动(UPDRS震颤评级: (a)时域无效,Vt=0.16; (b)频域无效,Vf=0.69; (c)时域有效,Vt=0.77; (d)频域有效,Vf=0.91[20]
异动症信号类似于动作性震颤信号,表现为周期性振动;但是异动症信号主频率(0.25~3.25 Hz)远低于震颤信号主频率(3.5~7.5 Hz)[55]。所以,可以将震颤和异动症的规范动作结合在一起,通过对运动传感器信号进行带通滤波,分离出异动症信号,然后同样进行频谱分析,就可以得到异动症参数。
Griffiths等、Pulliam等通过佩戴于PD患者手腕和小腿的运动传感器信号,进行频谱特征分析并建立回归模型,得到的量化结果和神经科医生异动症评分的相关性(r2)分别为0.64(35例患者)、0.74(15例患者),能够粗略地评估异动症症状[56-57]。Tsipouras等、Lopane等、Ramsperger等采用了机器学习的方法,对76例PD患者、34例健康人身体的运动信号进行特征提取、训练分析,得到的分类精度为93%~96%,可以较好地对异动症患者进行识别分类,但是还不能准确地对症状严重程度进行区分[58-60]。机器学习算法对于异动症的检测精度优于传统的统计分析方法,有利于研究者更好地开展异动症的量化评估研究。
3 结论及展望
目前,PD运动症状量化检测系统普遍处于临床试验阶段,且存在一些亟需解决的问题。首先,大多只针对单个或者某些症状,其中运动性震颤、肌肉僵直、姿势步态障碍和异动症的量化评估研究偏少;其次,用于肌肉僵直量化评估的可穿戴式装置机械机构及其测量方法还需要进一步优化;再次,症状波动对测量结果的影响考虑得比较少,测量结果的稳定性和系统的实用性有待进一步提高。
此外,其他关键性非运动症状(如构音障碍和睡眠障碍等)检测也有必要加入帕金森量化检测系统,以实现更加完整和综合的评价。同时,更多的临床实验和进一步的统计分析,特别是软测量技术、机器学习及基于云平台的大数据分析,将极大提高量化诊断的精确性和智能化水平,可以检测出不易被人眼观察到的细微运动症状变化,这将对帕金森病患者的病情诊断和疗效反馈提供极大的帮助。
[1] Parkinson J. An Essay on the shaking palsy[J]. J Neuropsychiatry Clin Neurosci, 2002, 14(14): 223-236.
[2] Jankovic J. Parkinson′s disease: clinical features and diagnosis[J]. J Neurol Neurosurg Psychiatry, 2008, 79(4): 368-376.
[3] 刘疏影, 陈彪. 帕金森病流行现状[J]. 中国现代神经疾病杂志, 2016, 16(2): 98-101.
[4] 中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第三版)[J]. 中华神经科杂志, 2014, 47(6): 428-433.
[5] Goetz CG, Tilley BC, Shaftman SR. Movement disorder society-sponsored revision of the unified Parkinson′s disease rating scale (MDS-UPDRS): Scale presentation and clinimetric testing results[J]. Mov Disord, 2008, 23(15): 2129-2170.
[6] 中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病的诊断标准(2016版)[J]. 中华神经科杂志, 2016, 49(4): 268-271.
[7] Massano J, Bhatia KP. Clinical approach to Parkinson′s disease: features, diagnosis, and principles of management [J]. Cold Spring Harb Perspect Med, 2012, 2(6): a008870-a008870.
[8] Okun MS. Deep-brain stimulation for Parkinson′s disease [J]. N Engl J Med, 2013, 368(5): 483-484.
[9] Miocinovic S, Somayajula S, Chitnis S, et al. History, applications, and mechanisms of deep brain stimulation[J]. JAMA Neurol, 2013, 70(2): 163-171.
[10] Pahwa R, Lyons KE. Handbook of Parkinson′s Disease[M]. (Fifth Edition). New York: CRC Press, 2013.
[11] Shaeffer DK. MEMS inertial sensors: A tutorial overview [J]. IEEE Commun Mag, 2013, 51(4): 100-109.
[12] 帕金森病监测仪[J]. 中国医疗器械杂志, 2014(3): 189-189.
[13] Kinesia-Great Lakes Neuro Technologies. Objective Parkinson′s assessment: Wearables, ambulatory monitoring, & telemedicine [EB/OL]. http://glneurotech.com/kinesia/.html, 2016-12-01/2017-01-10.
[14] Niazmand K, Tonn K, Kalaras A, et al. Quantitative evaluation of parkinson′s disease using sensor based smart glove[C] // 24th International Symposium on Computer-Based Medical Systems (CBMS). Bristol: IEEE, 2011: 1-8.
[15] Dai HD, D′Angelo LT. Quantitative assessment of tremor during deep-brain stimulation using a wearable glove system[C] //IEEE International Workshop of Internet-of-Things Networking and Control (IoT-NC). New Orleans: IEEE, 2013: 81-85.
[16] Dai HD, D′Angelo LT. A portable system for quantitative assessment of parkinsonian bradykinesia during deep-brain stimulation surgery[C] //2nd International Conference on Advances in Biomedical Engineering (ICABME). Tripoli: IEEE, 2013: 77-80.
[17] Dai HD, Otten B, Mehrkens JH, et al. A portable system for quantitative assessment of parkinsonian rigidity[C] //35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). Osaka: IEEE, 2013: 6591-6594.
[18] Dai HD, Otten B, Mehrkens JH, et al. A novel glove monitoring system used to quantify neurological symptoms during deep-brain stimulation surgery[J]. IEEE Sens J, 2013, 13(9): 3193-3202.
[19] Dai HD, Lin HJ, Lueth TC. Quantitative assessment of parkinsonian bradykinesia based on an inertial measurement unit[J]. Biomed Eng Online, 2015, 14: 68-68.
[20] Dai HD, Zhang PY, Lueth TC. Quantitative Assessment of Parkinsonian Tremor Based on an Inertial Measurement Unit[J]. Sensors, 2015, 15: 25055-25071.
[21] Zhao Y, Anhalt F, Fietzek UM, et al. Multi-Cue Unit: An independent device and actuator of a wearable system for gait-support in Parkinson patients[C] //IEEE International Conference on Microwaves, Communications, Antennas and Electronics Systems (COMCAS). Tel Aviv: IEEE, 2013, 143(6): 1-5.
[22] Coy JA, Pfeiffer JH, Krieger YS, et al. Mechatronic device for the optimization of the DBS-electrode placement[C] //6th IEEE International Conference on Biomedical Robotics and Biomechatronics (BioRob). Singapore: IEEE, 2016: 214-219.
[23] Coy JA, Mehrkens JH, Roppenecker DB, et al. Finding the center of Parkinson′s disease. A novel measurement device for quantifying motor symptoms during DBS-surgery[C] //IEEE International Conference on Robotics and Biomimetics (ROBIO). Bali: IEEE, 2014: 1691-1696.
[24] Zhao Y, Ramesberger S, Fietzek UM, et al. A novel wearable laser device to regulate stride length in Parkinson's disease[C] //35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). Osaka: IEEE, 2013: 5895-5898.
[25] Intel Corporation. The Michael J. Fox Foundation and Intel Join Forces to Improve Parkinson′s Disease Monitoring and Treatment through Advanced Technologies. https://newsroom.intel.com/news-releases/.html,2014-08-13/2017-01-10.
[26] Apple Incorporated. ResearchKit and CareKit-Empowering medical researchers, doctors, and you. [EB/OL]. http://www.apple.com/researchkit/.html, 2015-03-10/2017-01-10.
[27] 中国科学院苏州生物医学工程技术研究所. 一种用于定量评估帕金森患者运动功能的智能手环[P]. 中国: 201510020813.1, 2015-04-22.
[28] Salarian A, Russmann H, Wider C, et al. Quantification of tremor and bradykinesia in Parkinson′s Disease using a novel ambulatory monitoring system[J]. IEEE Trans Biomed Eng, 2007, 54(2): 313-322.
[29] Cole BT, Roy SH, De Luca CJ, et al. Dynamical learning and tracking of tremor and dyskinesia from wearable sensors[J]. IEEE Trans Neural Syst Rehabil Eng, 2014, 22(5): 982-991.
[30] Patrick SK, Denington AA, Gauthier MJ, et al. Quantification of the UPDRS rigidity scale [J]. IEEE Trans Neural Syst Rehabil Eng, 2001, 9(1): 31-41.
[31] Salarian A, Russmann H, Vingerhoets FJ, et al. Gait assessment in Parkinson′s disease: toward an ambulatory system for long-term monitoring[J]. IEEE Trans Biomed Eng, 2004, 51(8): 1434-1443.
[32] Jankovic J. Motor fluctuations and dyskinesias in Parkinson′s disease: clinical manifestations[J]. Mov Disord. 2005, 20 Suppl 11: S11-S16.
[33] Timmer J, Haussler S, Lauk M, et al. Pathological tremors: Deterministic chaos or nonlinear stochastic oscillators? [J]. Chaos, 2000, 10(1): 278-288.
[34] Elble RJ, Pullman SL, Matsumoto JY, et al. Tremor amplitude is logarithmically related to 4-and 5-point tremor rating scales [J]. Brain, 2006, 129(10): 2660-2666.
[35] Giuffrida JP, Riley DE, Maddux BN, et al. Clinically deployable KinesiaTMtechnology for automated tremor assessment [J]. Mov Disord, 2009, 24(5): 723-730.
[36] Daneault JF, Carignan B, Codère CÉ, et al. Using a smart phone as a standalone platform for detection and monitoring of pathological tremors[J]. Front Hum Neurosci, 2013, 6(2): 357-357.
[37] Kostikis N, Hristu-Varsakelis D,Arnaoutoglou M, et al. A Smartphone-Based Tool for Assessing Parkinsonian Hand Tremor [J]. IEEE J Biomed Health Inform, 2015, 19(6): 1835-1842.
[38] 郄剑文, 贾方秀, 鲁鹏威. 基于MEMS的帕金森病震颤实时评估系统[J]. 电子技术应用, 2016, 42(2): 42-45.
[39] Espay AJ, Giuffrida JP, Chen R, et al.Differential response of speed, amplitude, and rhythm to dopaminergic medications in Parkinson′s disease[J]. Mov Disord, 2011, 26(14): 2504-2508.
[40] Heldman DA, Filipkowski DE, Riley DE, et al. Automated motion sensor quantification of gait and lower extremity bradykinesia[C] //Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). San Diego: IEEE, 2012: 1956-1959.
[41] Mentzel TQ, Lieverse R, Levens A, et al. Reliability and validity of an instrument for the assessment of bradykinesia[J]. Psychiatry Res, 2016, 238: 189-195.
[42] Martinez-Manzanera O, Roosma E, Beudel M, et al. A Method for Automatic and Objective Scoring of Bradykinesia Using Orientation Sensors and Classification Algorithms [J]. IEEE Trans Biomed Eng, 2016, 63(5): 1016-1024.
[43] Kwon Y, Park SH, Kim JW, et al. Quantitative evaluation of parkinsonian rigidity during intra-operative deep brain stimulation [J]. BioMed Mater Eng, 2014, 24(6): 2273-2281.
[44] Xia R, Sun J, Threlkeld AJ. Analysis of interactive effect of stretch reflex and shortening reaction on rigidity in parkinson′s disease [J]. Clin Neurophysiol, 2009, 120(7): 1400-1407.
[45] Xia R, Muthumani A, Mao ZH, et al. Quantification of neural reflex and muscular intrinsic contributions to parkinsonian rigidity[J]. Exp Brain Res, 2016, 234(12): 3587-3595.
[46] Patrick SK, Denington AA, Gauthier MJ, et al. Quantification of the UPDRS rigidity scale [J]. IEEE Trans Neural Syst Rehabil Eng, 2001, 9(1): 31-41.
[47] Fung VS, Burne JA, Morris JG. Objective quantification of resting and activated parkinsonian rigidity: A comparison of angular impulse and work scores [J]. Mov Disord, 2000, 15(1): 48-55.
[48] Mak MK, Wong EC, Hui-Chan CW. Quantitative measurement of trunk rigidity in parkinsonian patients[J]. J Neurol, 2007, 254(2): 202-209.
[49] Park BK, Kwon Y, Kim JW, et al.Analysis of viscoelastic properties of wrist joint for quantification of parkinsonian rigidity [J]. IEEE Trans Neural Syst Rehabil Eng, 2011, 19(2): 167-176.
[50] Kaminsky TA, Dudgeon BJ, Billingsley FF, et al. Virtual cues and functional mobility of people with Parkinson's disease: a single-subject pilot study [J]. J Rehabil Res Dev, 2007, 44(3): 437-448.
[51] Hundza SR, Hook WR, Harris CR, et al. Accurate and Reliable Gait Cycle Detection in Parkinson′s Disease[J]. IEEE Trans Neural Syst Rehabil Eng, 2014, 22(1): 127-137.
[52] Demonceau M, Donneau AF, Croisier JL, et al. Contribution of a trunk accelerometer system to the characterization of gait in patients with mild-to-moderate Parkinson′s Disease[J]. IEEE J Biomed Health Inform 2015, 19(6): 1803-1808.
[53] Nancy JY, Khanna NH, Arputharaj K. A Q-backpropagated time delay neural network for diagnosing severity of gait disturbances in Parkinson′s disease [J]. J Biomed Inform, 2016, 60: 169-176.
[54] Lin ZR, Dai HD, Xiong YS, et al. Quantification assessment of bradykinesia in Parkinson's disease based on a wearable device[C] // 39th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). Seogwipo: IEEE, 2017, 803-806.
[55] Burkhard PR, Shale H, Langston JW, et al.Quantification of dyskinesia in Parkinson′s disease: validation of a novel instrumental method[J]. Mov Disord, 1999, 14(5):754-763.
[56] Griffiths RI, Kotschet K, Arfon S, et al. Automated Assessment of bradykinesia and dyskinesia in Parkinson′s disease[J]. J Parkinsons Dis, 2012, 2(1): 47-55.
[57] Pulliam CL, Burack MA, Heldman DA, et al. Motion sensor dyskinesia assessment during activities of daily living[J]. J Parkinsons Dis, 2014, 4(4): 609-615.
[58] Tsipouras MG1, Tzallas AT, Rigas G, et al. Automated Levodopa-induced dyskinesia assessment[C] //2010 Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). Buenos Aires: IEEE. 2010, 2411-2414.
[59] Lopane G, Mellone S, Chiari L, et al. Dyskinesia detection and monitoring by a single sensor in patients with Parkinson′s disease[J]. Mov Disord, 2015, 30(9): 1267-1271.
[60] Ramsperger R, Meckler S, Heger T, et al. Continuous leg dyskinesia assessment in Parkinson′s disease -clinical validity and ecological effect [J]. Parkinsonism Relat Disord. 2016, 26: 41-46.
