山药抗性糊精的微波预处理-酶解制备及其性质研究
2018-05-25徐佩琳罗水忠潘丽华
徐佩琳,罗水忠,潘丽华,郑 志
抗性糊精属于膳食纤维范畴,具有降低血糖、调节血脂和促进肠道益生菌生长繁殖等生理功能,以及良好的溶解性、热稳定性等食品加工性能[1],受到国内外的广泛关注。目前,制备抗性糊精多采用酸热法[2-3],该方法是一种随机转化机制,没有办法精确控制产品组分的分布,而且经过高温加热,经常会伴随着一些不利于工业生产的副反应。与酸热法相比,酶法工艺具有条件温和、副反应少、不需要酸碱中和等优点。酶法更易于产生相对分子质量较低的抗性糊精产品。在酶法制备的基础上,通过微波预处理淀粉能够更好地制备抗性糊精,是由于微波能够很大程度地影响酶切位点,提高淀粉对酶的敏感性,使淀粉自身的性质产生了巨大的改变[4],微波处理后淀粉将会出现爆裂孔,这些爆裂孔为酶从外部进入淀粉内部提供了有效的通道,提高了酶解速率,得到更均匀、抗性含量更高、抗消化性能更好的抗性糊精[5-6]。
淀粉是制备抗性糊精的良好原料,以玉米淀粉[2]、马铃薯淀粉[7]、木薯淀粉[8]、大米淀粉[9]和糯米淀粉为原料制备抗性糊精已有报道,然而,尚未有以山药淀粉为原料制备抗性糊精的研究成果。
山药为薯蓣科(Discoreaceae) 植物薯蓣的干燥根茎,被认为是一种能改善胃脾功能的高级中草药,山药的主要活性成分是黏蛋白、薯蓣皂苷、胆碱、植物甾醇、必需氨基酸、低聚糖和尿囊素等[10],近年来,从山药中分离活性成分的研究十分活跃,而提取后所剩余的残渣(主要成分为淀粉) 的利用却并未得到足够的重视[2],并且由于山药易腐烂、易褐变、不耐储存、不便运输等特性,如何更好地发挥山药的综合价值一直以来是学者研究的难点[11]。事实上,充分利用山药淀粉制备抗性糊精等活性功能产品,不仅能丰富淀粉种类,而且能拓宽山药的利用范围,提高其附加值;不但丰富山药的产品种类,而且扩大了其经济价值,对提升山药产品质量、提高山药加工新途径、扩大原材料的资源利用率、延长山药的贮藏期、提高产品的附加值等都有很好的帮助[12]。
通过微波辅助酶解的方法来制备山药抗性糊精,并且通过高效液相色谱(HPLC)、差示扫描量热仪(DSC)和体外消化率来对其进行理化性质研究,为山药的综合利用提供理论基础。
1 材料与方法
1.1 材料与仪器
山药,安徽省众德食品有限公司提供;碱性蛋白酶(CAS:9014-01-1 200 000 U/g),北京索莱宝科技有限公司提供;耐高温α-淀粉酶(CAS:9000-85-5 40 000 U/g),江苏锐阳生物科技有限公司提供;耐高温β-淀粉酶(CAS:9000-91-3 700 000 U/g),江苏锐阳生物科技有限公司提供;转苷酶(CAS:9001-42-7 300 000 U/g),Sigma公司提供。
FK-A型组织捣碎机,江苏金坛市金城国盛实验仪器厂产品;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司产品;Q200型差示扫描量热仪,美国TA公司产品;NJL07-3型微波实验炉,南京杰全微波设备有限公司产品。
1.2 山药淀粉的提取
参照Falade K O等人[13]的方法,并略作改动。新鲜山药清洗、去皮、切片(2 cm×2 cm×2 cm),于90℃条件下水浴热烫3 min,取200 g打浆后置于5 L烧杯中,浆液过胶体磨3次后,用浓度1.5 mol/L的NaOH溶液调节pH值至9.5~10.0,置于41℃恒温水浴锅中,并用数显搅拌器不断搅拌,加入一定量的碱性蛋白酶提取一定时间后,使用160目滤布过滤3次,收集滤液。以3 500 r/min转速离心10 min,弃去上清液,洗涤过程重复3次。将沉淀物真空冷冻干燥24 h,碾磨过筛即得白色山药淀粉。山药淀粉得率为29.5±3.9 g/100 g。
1.3 山药抗性糊精的制备
配置20%(W/V)的山药淀粉溶液,加入原料质量0.5%的CaCl2,磁力搅拌20 min,以不同微波功率(0~80 W) 进行微波处理0~10 min,取出后以浓度0.1 mol/L的盐酸调节pH值至5.5,分别加入耐高温α-淀粉酶40 U/g,耐高温β-淀粉酶用量0~40 U/g,葡萄糖转苷酶用量20~40 U/g搅拌均匀,密封后放入恒温水浴锅中反应10~30 min,反应结束后加盐酸调节pH值至2.0,放入水浴锅灭酶3 min后取出,迅速将其用冰水浴冷却至室温,冷冻干燥,即得抗性糊精粗品。
(1)山药抗性糊精含量的测定。参考Kapusniak J等人[2]的方法,稍作修改。将样品1.000 0 g分散于20 mL的Mes-Tris缓冲溶液中,然后加入热稳定性的α-淀粉酶溶液(500 U),蛋白酶(30 U) 和糖苷酶;消化后,加入4倍体积的乙醇(体积分数95%,预热至60℃);在具有干燥硅藻土床作为助滤剂的焦油烧结玻璃坩埚中过滤沉淀;用乙醇和丙酮洗涤固体残余物,将残留的坩埚在110℃的烘箱中干燥过夜,在干燥器中冷却至室温,称质量。干燥残余物与干燥样品的初始质量的比例为抗性糊精含量。
(2) 葡萄糖当量(DE值) 的测定。准确称取样品1.000 0 g置于烧杯中,用去离子水稀释至50 mL,然后放入水浴锅中进行糊化处理,冷却稀释至1000mL,进行葡萄糖含量的测定。

1.4 物化性质的测定
(1) 溶解度的测定。参考Kapusniak J等人[2]的方法,略有改动。在室温下称取1 g(精确到0.000 1)样品于100 mL的锥形瓶中,用蒸馏水稀释至50 mL,磁力搅拌使其充分溶解,将悬浮液以转速5 000 r/min离心30 min,在60℃烘箱中干燥过夜,然后在105℃烘箱中烘干至恒质量,称量上清液中干物质的质量。

(2)热力学性质测定。山药淀粉和山药抗性糊精的热力学性质用DSC测定,参照Ashri A等人[15]的方法,略有改动。准确称取一定量的抗性糊精样品(按干基计)于液体坩埚中,按1∶2的比例加入去离子水,加盖压紧、密封,在4℃条件下平衡24 h。平衡后的样品在DSC中糊化,仪器通N2,速率50 mL/min,以10℃/min的速率升温,温度从20℃升到150℃,通过图谱计算样品起始温度(To),峰值温度(Tp),结束温度(Tc) 和糊化焓(ΔH)。
(3) 相对分子质量的测定。高效液相色谱法(HPLC) 是测量多糖相对分子量常用的方法之一。试验根据Pan L H等人[16]描述的测定分子量的方法,进行简单修改。所用色谱装置为:色谱柱为TSK G5000PWxl(7.8 mm×300 mm) 和 TSK G54000PWxl(7.8 mm×300 mm)串联,以超纯水为流动相进行色谱分析;检测器为示差折光检测器,柱温30℃,流速0.5 mL/min,进样量20 μL;采用一系列葡聚糖T标准品校准分子量测定的校准曲线,包括T-1000,T-500,T-100,T-50和T-20;平均分子量由Breeze软件版本3.3(Waters Co.Ltd.)计算。
1.5 体外模拟人工胃液与人工肠液
根据2015年“中国药典”制备人造胃液(AGJ)和人造肠液(AIF)。按照Shi M M等人[17]所述人工模拟胃肠消化,并稍作修改。消化过程中,取0.5 g抗性糊精于5 mL人造胃液/肠液。配置好消化液,分别对应于人造胃液条件下消化30,60,120,240 min;人造肠液消化0,30,90,180,360 min时取出等分试样(0.5 mL),并最终用苯酚-硫酸法进行总碳水化合物测定。制作葡萄糖含量与吸光度的标准曲线。
平均消化率根据下式计算:
总碳水化合物消化产物(CHO)=C×D×(425-S) ×0.001

式中:CHO——总碳水化合物消化产物,mg;
C——碳水化合物在0.5 mL稀释透析液中参照标准曲线;
D——稀释倍数;
425——整个系统的体积,mL;
S——从400 mL稀释透析液0.5 mL,mL;
0.001——毫克级的转换;
W——样品质量,mg。
1.6 数据分析
上述所有试验至少进行3次。结果表示为平均值±标准偏差 (SD)。使用 SPSS 19软件 (IBM Corporation,Armonk,NY,USA),方差分析 (ANOVA)和Duncan's检验以95%显著性水平进行统计分析。用Origin 8.6绘制相关图表。
2 结果与分析
2.1 微波预处理-酶解制备山药抗性糊精的工艺研究
微波预处理制备条件对山药抗性糊精含量和DE值的影响见图1。
由图1可知,山药抗性糊精含量随着微波功率和微波时间的增加呈现先逐渐增大后减小的趋势,微波功率60 W,微波时间6 min时达到抗性糊精含量的最大值,为40.33%。当继续增加微波功率和时间,淀粉易形成凝胶,从而不利于形成山药抗性糊精。微波预处理的过程使得直链淀粉更易发生降解,聚合度降低,产品分支度增高,且淀粉经过微波作用,影响其酶切位点,有利于小分子的重新聚合,生成更多不被酶消化的抗性糊精。DE值表示淀粉水解程度,随着微波功率和微波时间的增加,酶解程度不断增加,DE值也不断增加[7]。
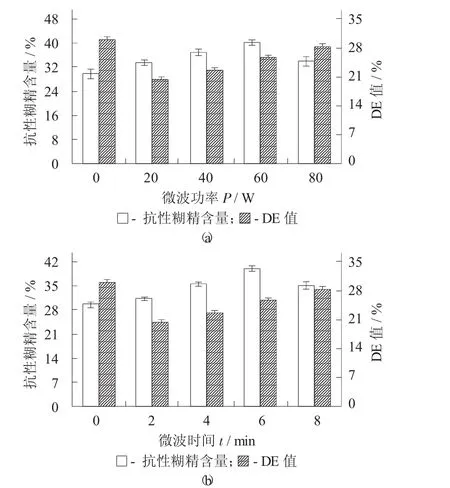
图1 微波预处理制备条件对抗性糊精含量和DE值的影响
酶解制备条件对抗性糊精含量和DE值的影响见图2。
由图2(a) 可知,抗性糊精含量随着酶解温度的升高和加热时间的增加而呈现先增加后减少的趋势,酶解温度75℃,加热时间20 min时达到最大值,抗性糊精含量为30.59%。当酶解温度继续升高、酶解时间延长,抗性糊精含量开始急剧降低,这可能是加快了α-淀粉酶内切淀粉α-1,4糖苷键的速率,形成快速降解,不利于形成抗性糊精。
由图2(c) 可知,抗性糊精含量随着β-淀粉酶用量增加而呈现先增加后减小的趋势,在酶用量达到20 U/g时,达到最大值,而后因为β-淀粉酶用量过大,导致其切开α-1,4糖苷键的速度过快,不易形成抗性糊精。β-淀粉酶是一种外切酶,遇1,6键或取代集团就酶解停止,保留了淀粉原来的枝杈结构,增加形成抗性糊精的分支度,从而得到抗性糊精,Tester R F等人[18]对此进行了较为详细的研究与报道。
由图2(d)可知,随着转苷酶用量的不断增加,其抗性不断增强。当酶用量达到35 U/g时,增加趋于缓慢。转苷酶能够增强抗性的原因可能是因为转苷酶能够将游离于溶液中的葡萄糖、麦芽糖等小分子通过其他键的结合形式结合于糊精分子上形成潘塘、异麦芽糖和其他分歧低聚糖等,而这部分也是抗性成分,从而形成抗性糊精[14]。Wang Y J等人[19]也进行了相关研究,转苷酶从高直链玉米淀粉中获得酶抗性糊精。
随着酶解温度、酶解时间和β-淀粉酶酶用量增加,山药淀粉的酶解程度和酶的活性不断增强,酶解程度相应随之增加,即DE值不断增大。
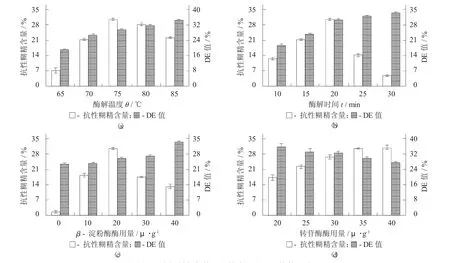
图2 酶解制备条件对抗性含量和DE值的影响
综上所述,出于经济成本的考虑,在下面的研究中,以微波预处理功率60 W和微波时间6 min,通过酶解温度75℃,酶解时间20 min,添加β-淀粉酶20 U/g和转苷酶35 U/g作为山药抗性糊精制备条件,进行后续试验研究。
2.2 物化性质的分析
抗性糊精与山药淀粉的分子量和热特性分析见表1。
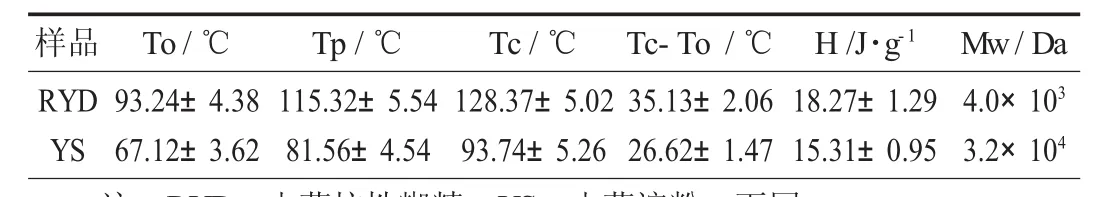
表1 抗性糊精与山药淀粉的分子量和热特性分析
由表1可知,山药淀粉的相转变温度为67.12℃,而以此制备的山药抗性糊精的相转变温度为93.24℃,说明淀粉的基本结构已不存在,形成了新的结构,该物质的热稳定性很高,这种吸热转变归因于山药淀粉制备山药抗性糊精过程中分子的重新聚合和转糖基作用[17,20]。通过高效液相色谱测定抗性糊精与山药淀粉的相对分子量,根据分子量与保留时间之间的标准曲线,计算微波辅助酶解制备得到的抗性糊精和山药淀粉的相对分子量分子量(Mw)约为4.0×103Da和3.2×104Da(见表1)。由于抗性糊精在形成过程中发生解聚,造成严重的主链结构(α-1,4糖苷键)解聚,以及在酶和微波预处理的共同作用形成新的分支,所以抗性糊精的分子量比山药淀粉显著降低[21]。
山药抗性糊精含量对山药淀粉溶解度的影响见图3。
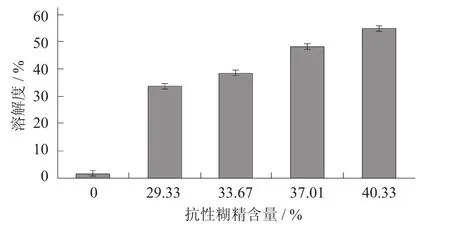
图3 山药抗性糊精含量对山药淀粉溶解度的影响
由图3可知,抗性糊精抗性含量越高,溶解度越好,与原山药淀粉相比,溶解度提高了47.01%,此时抗性糊精含量为40.33%,抗性糊精溶解度好的原因或许是在形成糊精的过程中,山药淀粉颗粒的无定形区和结晶区都被破坏,山药淀粉的空间结构也被破坏,使山药淀粉分子降解得到了很多的可溶性小分子物质[7]。良好的水溶性使得山药抗性糊精能够更好地应用在食品行业中。
2.3 山药抗性糊精体外消化性分析
人工胃液(AGJ) 和人工肠液中(AIF) 中抗性糊精和山药淀粉的体外消化率见表2。
表2显示了山药淀粉及其制备得到的抗性糊精样品在人造模拟胃液中处理240 min和在人造肠液中处理360 min的体外消化情况。结果表明,在人工胃液消化阶段,所有样品消化缓慢,随着消化时间的延长,消化率均小于1%。在人造肠液消化阶段,山药淀粉在人造肠液中消化率显著增加,山药抗性糊精在人造肠液中的消化率远低于山药淀粉。人工胃液对山药淀粉和抗性糊精微量的消化作用,可能是因为胃液具有较强的酸性,对其具有轻微水解作用和侵蚀作用[22]。据报道,淀粉分子在形成抗性糊精时,分子重新聚合形成不易消化的1,2-、1,3-或具有高分支度的糊精分子,对酶消化具有抗性[23],故而山药抗性糊精在人工肠液中消化缓慢。
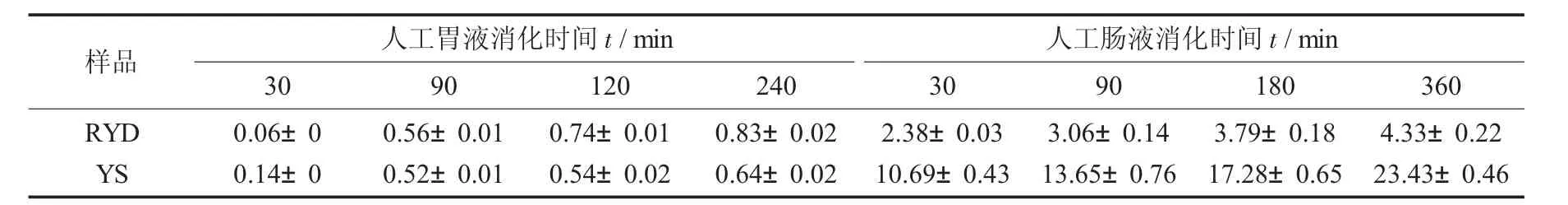
表2 人工胃液(AGJ)和人工肠液中(AIF)中抗性糊精和山药淀粉的体外消化率/%
3 结论
在微波功率60 W,微波时间6 min预处理淀粉的基础上,酶解温度75℃,酶解时间20 min,β-淀粉酶酶用量20 U/g,葡糖糖转苷酶酶用量35 μ/g的制备条件下所制备的山药抗性糊精含量和溶解度分别达到了40.33%和47.01%,具有较低分子量约为4 000 Da,还具有较好的热稳定性和对人造胃液或小肠液的高耐受性,这些特点使得由山药淀粉制备得到的抗性糊精更适合应用于食品行业中。今后,还需要对抗性糊精展开进一步研究,以更好地认识其结构和形成机理,并验证其是否具有作为膳食纤维和益生元的可能性。
参考文献:
[1]袁琨.抗性糊精成为开发富含膳食纤维新品种的宠儿[J].食品开发,2012(6):41-42.
[2]Kapusniak J,J L Jane.Preparation and characteristics of enzyme-resistant dextrins from corn starch[J].Polish Journal of Food&Nutrition Sciences, 2007, 57 (4):261-265.
[3]Fouache C,P Duflot,P Looten.US:Branched maltodextrins and method of preparing them[P].2003.
[4]徐仰丽,刘亚伟,任伟豪.抗性糊精的研究进展 [J].河南工业大学学报(自然科学版),2008,29(4):67-71.
[5]G L,J T,F J.Effect of microwave radiation on physicochemical properties and structure of cereal starches[J].Carbohydrate Polymers,2000,42 (2):193-199.
[6]李晓玺,陈玲,邹芳建,等.微波对高链玉米淀粉颗粒抗消化性能的影响 [J].食品科学,2007,28(10):105-108.
[7]Kapusniak K,E Nebesny.Enzyme-resistant dextrins from potato starch for potential application in the beverage industry[J].Carbohydrate Polymers,2017 (5):152-158.
[8]Azeez O S.Production of dextrins from cassava starch[J].Leonardo Journal of Sciences,2005 (7):9-16.
[9]Wang Y,H Li,X Wu,et al.Acid-thermal dextrin prepared from rice starch:structure and encapsulation properties[J].International Journal of Biological Macromolecules,2013,60 (6):178-180.
[10]Chen Y F,Q Zhu,S Wu.Preparation of oligosaccharides from Chinese yam and their antioxidant activity[J].Food Chemistry,2015 (4):1 107-1 110.
[11]何海玲,单承莺,张卫明,等.山药研究进展 [J].中国野生植物资源,2006,25(6):1-6.
[12]Chen X,J Lu,X Li,et al.Effect of blanching and drying temperatures on starch-related physicochemical properties,bioactive components and antioxidant activities of yam flours[J].LWT-Food Science and Technology,2017 (2):303-310.
[13]Falade K O,O E Ayetigbo.Effects of annealing,acid hydrolysis and citric acid modifications on physical and functional properties of starches from four yam(Dioscorea spp).cultivars[J].FoodHydrocolloids,2015 (1):529-539.
[14]陈磊.功能淀粉糊精的制备及其应用研究 [D].广州:华南理工大学,2014.
[15]Ashri A,M S M Yusof,M S Jamil,et al.Physicochemical characterization of starch extracted from Malaysian wild yam(Dioscorea hispida Dennst).[J].Emirates Journal of Food&Agriculture,2014,26 (8):652-658.
[16]Pan L H,B J Feng,J H Wang,et al.Structural characterization and anti-glycation activity in vitro of a water-soluble polysaccharide from dendrobium huoshanense[J].Journal of Food Biochemistry,2013,37 (3):313-321.
[17]Shi M M,Q Y Gao.Physicochemical properties,structure and in vitro digestion of resistant starch from waxy rice starch[J].Carbohydrate Polymers,2011 (3):1 151-1 157.
[18]Tester R F,X Qi.β-limit dextrin-properties and applications[J].Food Hydrocolloids,2011,25 (8):1 899-1 903.
[19]Wang Y J,R Kozlowski,G A Delgado.Enzyme resistant dextrins from high amylose corn mutant starches[J].Starch-Starke,2015,53 (1):21-26.
[20]Shin S,J Byun,K H Park,et al.Effect of partial acid hydrolysis and heat-moisture treatment on formation of resistant tuber starch[J].Cereal Chemistry,2004(2):194-198.
[21]滕健.微波法抗性麦芽糊精的制备及其性质和应用的研究 [D].无锡:江南大学,2009.
[22]曾红华.抗性淀粉的理化性质及其益生效应 [D].长沙:长沙理工大学,2013.
[23]Kapusniak J, K Kapusniak, S Ptak, et al.Products of thermolysis of potato starch treated with hydrochloric and citric acids as potential prebiotics[J].Quality Assurance&Safety of Crops&Foods,2014 (3):347-356.◇
