胶原/高分子量壳聚糖复合纤维的制备及其性能
2018-05-24丁长坤杜建华程博闻
李 倩, 丁长坤, 张 静, 杜建华, 程博闻
(天津工业大学 天津市先进纤维与储能技术重点实验室, 天津 300387)
胶原是一种天然纤维蛋白质,占人体或其他动物总蛋白含量的30%左右,广泛存在于动物皮肤、骨、肌腱、韧带和角膜等组织中,是动物体内含量最丰富的结构蛋白质。胶原有很多其他合成材料无法比拟的优良性能,如低免疫原性,良好的生物相容性、生物可降解性,在烧伤治疗、创面止血、药物载体、可吸收手术缝合线和化妆品等领域有重要的应用[1-3],但胶原力学性能较差,在体内降解时受局部因素影响较大,生物可降解性较难调节,单独用于基质材料还难以达到理想要求[4]。
壳聚糖是甲壳素脱乙酰基的产物,是自然界唯一的碱性多糖,具有良好的生物相容性,其降解产物安全无毒,并有显著的抗菌、止血功效[5]。不少研究者发现,胶原和壳聚糖具有较强的相互作用,将二者复合可得到不同的生物医用材料。最近有研究将胶原和壳聚糖共混来制备海绵[6],以及研究胶原蛋白-壳聚糖复合敷料的促愈合效果并评价了其生物安全性[7]。
本文将鼠尾肌腱胶原蛋白与高分子量壳聚糖进行共混,通过湿法纺丝技术制备胶原/壳聚糖复合纤维,以期通过高分子量壳聚糖提高胶原纤维的力学性能,为开发胶原基可吸收手术缝合线等高端生物医用纤维材料提供理论参考。
1 实验部分
1.1 原料与试剂
鼠尾肌腱胶原蛋白,实验室自制;壳聚糖,相对分子质量为1.1×106,脱乙酰度为93%,山东省桓台县金湖甲壳制品有限公司;冰乙酸、丙酮、氨水,分析纯,均来自天津市科密欧化学试剂有限公司。
1.2 实验仪器
DW-Ⅰ型无级调速搅拌器,巩义市予华仪器有限责任公司;TG16-WS型高速离心机,湖南湘仪实验仪器开发有限公司;JW-2019HR型高速冷冻离心机,安徽嘉文仪器装备有限公司;乌氏黏度计,S4800型场发射扫描电子显微镜,日本日立公司;D/MAX-2500型X射线衍射仪,日本理学公司;TENSOR37型傅里叶变换红外光谱仪,德国布鲁克科技有限公司;LLY-06型电子单纤维强力仪,莱州电子仪器有限公司。
1.3 纤维制备
将质量分数分别为4%和2%的胶原和壳聚糖分别溶解于0.5 mol/L的冰醋酸中,保持溶液温度在4~6 ℃ 之间,搅拌,溶解时间约8 h。待二者溶解完全后离心脱泡,然后将胶原与壳聚糖按不同质量比(9∶1、8∶2、7∶3、6∶4和5∶5)混合,保持溶液温度在4~6 ℃ 之间,混合溶液搅拌8 h,然后再次离心脱泡得到纺丝液。将丙酮、氨水和去离子水按一定比例配制凝固浴,通过湿法纺丝技术制备胶原/壳聚糖复合纤维,并将其悬挂自然风干。
1.4 结构表征与性能测试
胶原/壳聚糖相容性测试:将一定浓度的胶原和壳聚糖溶液依次稀释1~4倍得到不同浓度的溶液,分别采用乌氏黏度计测定其黏度,测试温度为25 ℃,每个不同浓度的溶液流出时间测量3 次,取其平均值,采用乌氏黏度计测得的数据根据Huggins公式[8]进行计算:
ηsp/c=[η]+bc
b=kH[η]2
(1)
式中:ηsp为增比黏度;c为溶液质量浓度,g/dL;[η]为特性黏度,dL/g;b为常数,表示一定浓度的2种高分子间的相互作用;kH为Huggins参数,值为0.4。
复合纤维形貌表征:采用S-4800型场发射扫描电子显微镜观察复合纤维的表面与断面形貌。测试前对纤维进行干燥、喷金处理,加速电压为10 kV。
结晶性能测试:将纤维真空干燥后,采用D/MAX-2500型X射线衍射仪对复合纤维的结构进行分析,Cu/Kα辐射源,扫描速度为5(°) /min,扫描角度为5°~40°。纤维的结晶度公式为
(2)
式中:X为结晶度,%;∑Ic为结晶峰衍射强度,a.u.;∑Iα为非结晶峰衍射强度,a.u.。
红外光谱测试:采用TENSOR37型傅里叶变换红外光谱仪对纤维进行红外测试,测试波数范围为4 000~400 cm-1,间隔为2 cm-1。
力学性能测试:采用LLY-06型电子单纤维强力仪测试纤维的力学性能,夹距长度为10 mm,拉伸速率为10 mm/min,温度为25 ℃,相对湿度为75%。
2 结果与讨论
2.1 胶原/壳聚糖相容性分析
表1、2示出胶原溶液和壳聚糖液的黏度数据。

表1 胶原溶液的黏度数据Tab.1 Viscometric data of collagen solution
注:醋酸流出时间t0为38.33 s,ηr=t/t0,ηsp=ηr-1。

表2 壳聚糖溶液的黏度数据Tab.2 Viscometric data of chitosan solution
注:醋酸流出时间t0为38.33 s,ηr=t/t0,ηsp=ηr-1。
将2种溶液的ηsp/c对c作图,结果如图1所示。
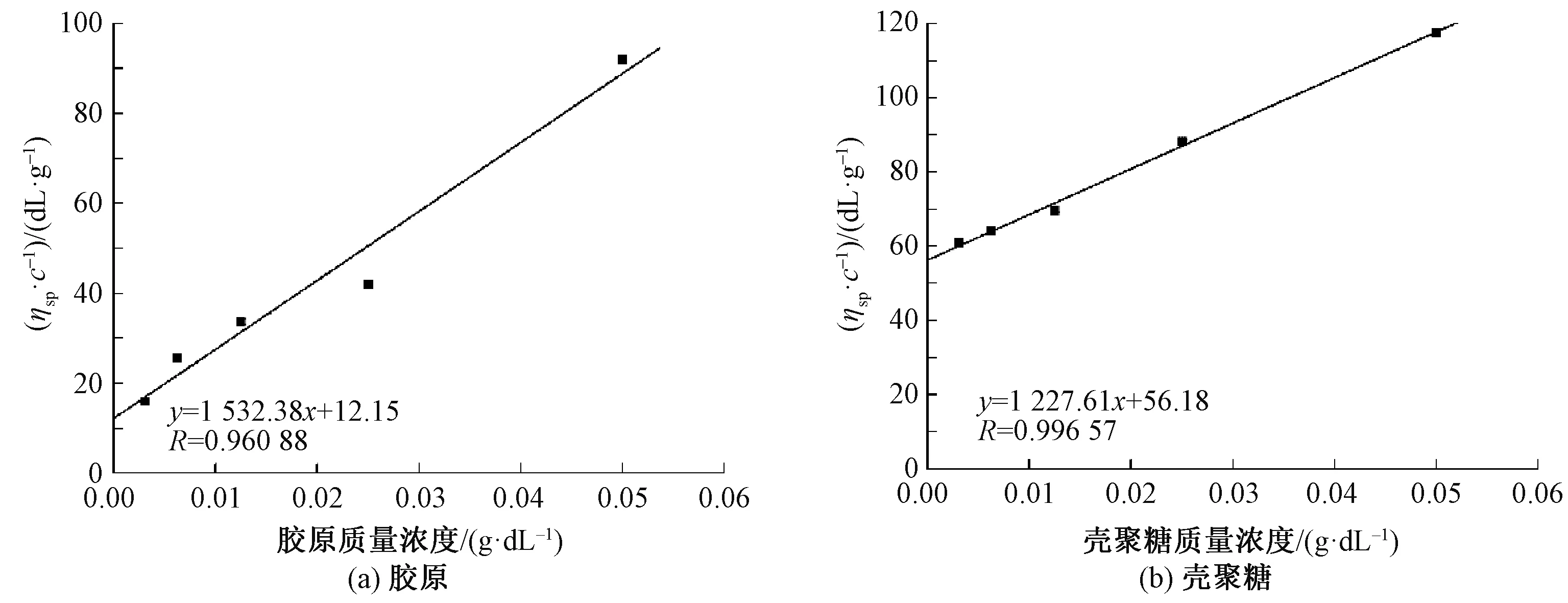
图1 溶液质量浓度与ηsp/ c关系图Fig.1 Relations between concentration and ηsp/c of collagen (a) and chitosan (b) solution
根据Zhu[9]所描述的方法,胶原/壳聚糖共混体系的b值计算公式为
bm=(b22c22+b33c32+2b23c2c3)/c2
(3)
式中:下角标2表示胶原溶液体系;下角标3表示壳聚糖溶液体系;bm表示一定浓度的胶原和壳聚糖溶液分子间的相互作用,(dL/g)2。
相容性的判定标准为
(4)
式中:若Δb≥0,表示共混体系两相相容;若Δb<0,表示共混体系两相不相容。

图2 不同质量比的胶原/壳聚糖复合纤维表面的SEM照片(×600)Fig.2 Surface SEM images of collagen/chitosan composite fibers (×600)
根据式(3)、(4)计算,所得数据见表3。由表可知:当胶原与壳聚糖质量比为9∶1、8∶2、7∶3、6∶4和5∶5时,共混体系为相容体系;而当二者的质量比为4∶6、3∶7、2∶8和1∶9时,共混体系为不相容体系,因此,本文选择二者相容时的比例制备复合纤维。
2.2 纤维形貌分析
图2、3分别为胶原/壳聚糖复合纤维的表面和断面扫描电子显微镜照片。由图2可看出:纯胶原纤维表面相对粗糙,有明显的褶皱,这主要是胶原纤维分子柔性较大,在双扩散成型过程中丙酮脱水导致;随着壳聚糖含量的增加,复合纤维表面形成褶皱的程度逐渐减弱,光滑平整性逐渐增强,这主要是因为壳聚糖分子链的刚性较强,模量较大;当胶原和壳聚糖质量比为5∶5时,复合纤维表面光滑性与纯壳聚糖纤维基本相同。

表3 胶原/壳聚糖共混体系的黏度数据Tab.3 Viscometric datas of collagen/chitosan blends
注:—表示没有数值。

图3 不同质量比的胶原/壳聚糖复合纤维断面的SEM照片(×20 000)Fig.3 Cross sectional SEM images of collagen/chitosan composite fibers (×20 000)
从图3可看出:纯胶原纤维的断面呈现出胶原分子典型的棒状结构特征,且胶原分子之间应该形成了一定程度的自组装结构[10-12],即胶原分子在分子间作用力、氢键、疏水作用力等综合作用下发生了侧向融合与规整排列,也有可能形成一定程度的轴向排列。同时,纤维通过喷丝孔时受到剪切力的作用,导致整个分子沿流动方向(纤维轴向)有一定程度的有序排列,有序程度越高越有利于提高纤维的力学性能。加入壳聚糖组分后,当胶原与壳聚糖质量比为9∶1时,可看到更明显的胶原分子棒状结构。这是因为二者是相容体系(部分相容),壳聚糖分子均匀地分布在胶原分子之间,胶原分子原来相对紧密堆积的排列结构受到影响,使分子间距离变大。随着壳聚糖含量进一步增加,胶原与壳聚糖质量比为8∶2时,复合纤维截面仍然以胶原分子棒状结构为主要特征。当胶原与壳聚糖质量比为7∶3时仍可见规整性较高的胶原分子排列,但连续相的壳聚糖分子已经比较明显。当胶原与壳聚糖质量比为6∶4时,壳聚糖相的连续性进一步提高,而胶原分子的有序排列程度降低。胶原与壳聚糖质量比为5∶5时,观察到以脆性较大的壳聚糖连续相为主,胶原分子在断面露出较少。
2.3 纤维结晶性能分析

图4 胶原与壳聚糖纤维的X射线衍射曲线Fig.4 XRD patterns of collagen and chitosan fibers
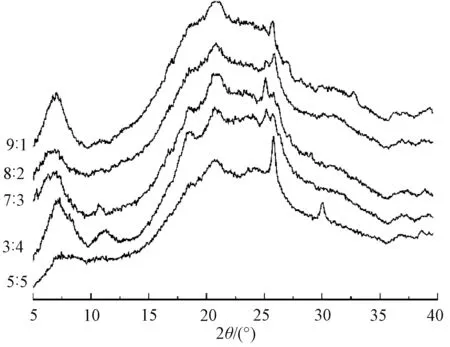
图5 不同质量比的胶原/壳聚糖复合纤维的X射线衍射曲线Fig.5 XRD patterns of collagen/chitosan composite fibers
图4示出纯胶原与壳聚糖纤维的X射线衍射曲线。可看出,纯胶原纤维在7.2°和20.4°处出现衍射峰,其中7.2°的衍射峰对应胶原纤维分子链之间的距离。用Jade软件进行曲线拟合,根据式(2)计算得到纯胶原纤维的结晶度为23.28%[13-14]。壳聚糖纤维在9.8°和20.9°附近出现较宽的衍射峰,分别对应其(100) 和(102) 衍射晶面。
图5示出胶原/壳聚糖复合纤维的X射线衍射曲线。
可看出,胶原/壳聚糖复合纤维的衍射峰没有纯胶原纤维衍射峰强度高,经计算得到不同比例胶原/壳聚糖复合纤维结晶度均低于20%,说明复合纤维的结晶度均低于纯胶原纤维。这主要是因为胶原在溶解过程中原有的天然结晶结构被破坏,分子也被拆散,而在胶原纤维再成型的过程中,原来高度规整的结晶结构难于形成,只能得到低有序的结构,所以复合纤维的衍射峰强度变低且峰宽变宽[15]。其次,在低角度区,胶原纤维分子链间距离的衍射峰在大约6.7°和7.5°之间出现偏移,说明胶原分子和壳聚糖分子之间存在一定的相互作用,壳聚糖对胶原分子的排列结构产生影响,这与纤维断面照片的特征相一致。
2.4 复合纤维结构分析


图6 胶原与壳聚糖纤维的红外光谱图Fig.6 FT-IR spectra of collagen and chitosan fibers
图7示出胶原/壳聚糖复合纤维的红外谱图。可看出,复合纤维的红外谱图均出现酰胺Ⅲ带特征峰,且其峰位与胶原纤维相比发生了不同程度的偏移,这说明胶原与壳聚糖间有氢键相互作用[17]。
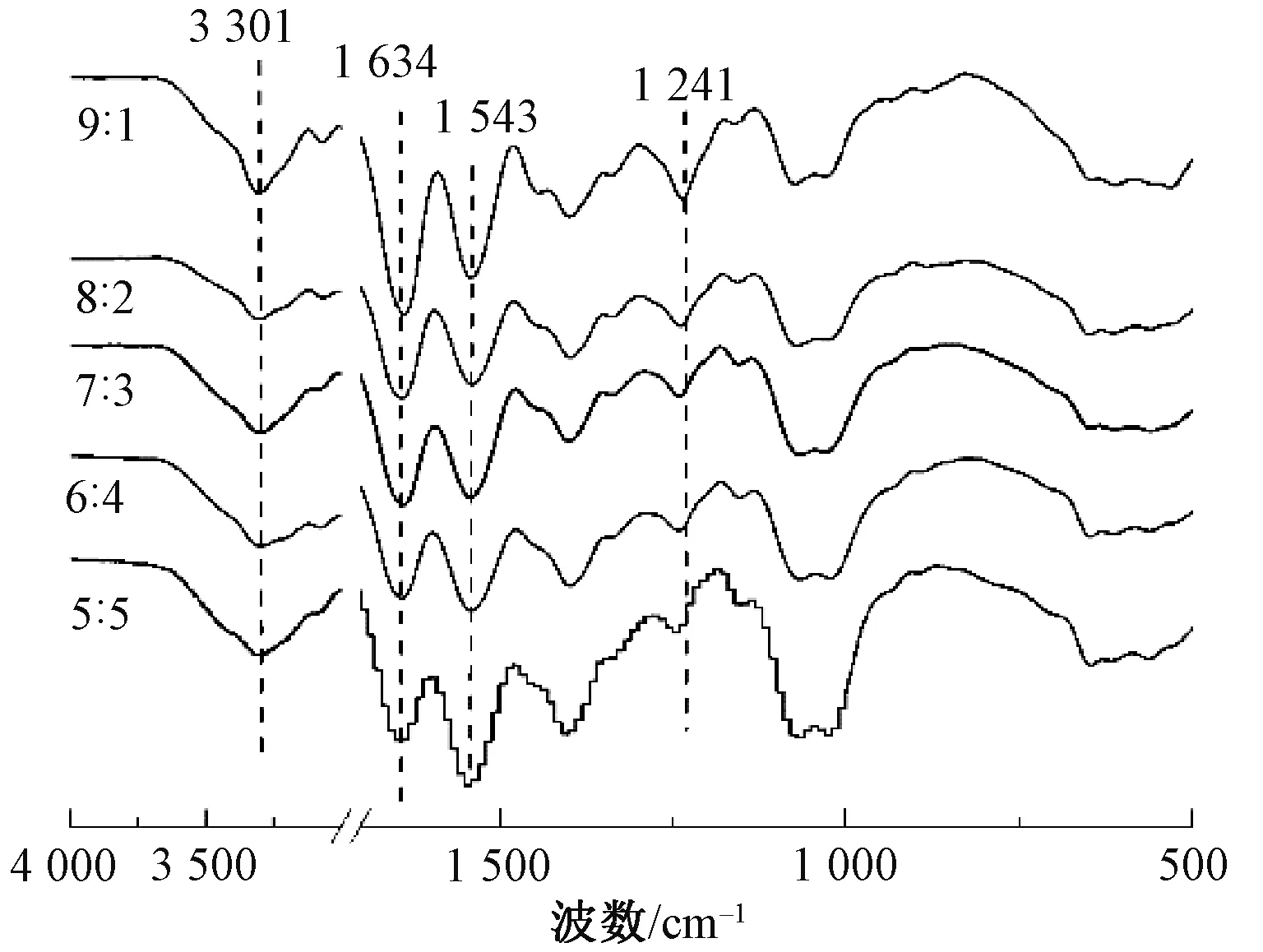
图7 不同质量比的胶原/壳聚糖复合纤维的红外光谱图Fig.7 FT-IR spectra of collagen/chitosan composite fibers
2.5 纤维力学性能分析
表4示出胶原/壳聚糖复合纤维的力学性能随壳聚糖含量的变化。可看出,复合纤维的断裂强度随壳聚糖含量的增加出现先增加后下降趋势。当胶原与壳聚糖质量比小于8∶2时,复合纤维断裂强度明显增加,这主要是因为该比例下胶原与壳聚糖二者相容性较好,二者间一定的相互作用利于纤维内部分子链的有序排列,强度相对较大的壳聚糖对胶原的增强作用明显,表现为复合纤维强度提高[18]。当胶原与壳聚糖质量比为8∶2时,二者相容性达到最佳,复合纤维断裂强度为1.047 4 cN/dtex,与纯胶原纤维相比提高了31.3%。当壳聚糖含量继续增加时,由于二者相容性开始下降,复合纤维断裂强度逐渐降低。此外,复合纤维的断裂伸长率也随壳聚糖含量的增加出现先增加后下降的趋势。综上,说明壳聚糖的加入使复合纤维达到了增强增韧的效果。
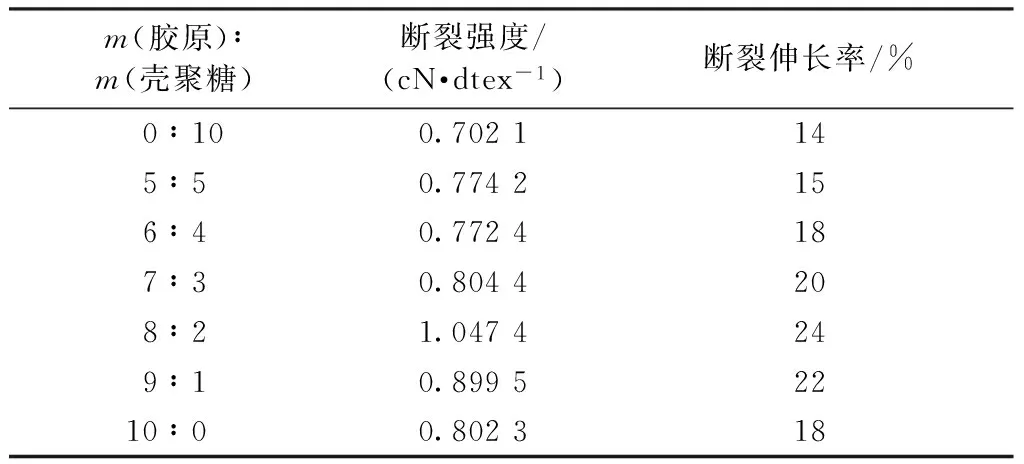
表4 复合纤维的力学性能Tab.4 Mechanical properties of composite fibers
3 结 论
1) 当胶原与壳聚糖质量比为9∶1、8∶2、7∶3、6∶4和5∶5时,共混体系为相容体系;当二者的质量比为4∶6、3∶7、2∶8和1∶9时,共混体系为不相容体系。
2) 胶原纤维的断面出现胶原分子的棒状有序结构和一定的自组装结构,胶原/壳聚糖复合纤维的这种结构特征随壳聚糖含量的增加而变化,即随壳聚糖连续性的提高,胶原分子的有序排列程度降低。
3) 纯胶原与壳聚糖纤维具有一定的结晶结构,而复合纤维中分子的有序排列程度降低。胶原和壳聚糖之间存在氢键相互作用,当胶原与壳聚糖质量比为8∶2时,二者相容性最好,复合纤维断裂强度与纯胶原纤维相比提高了31.3%。
参考文献:
[1] LIMA C G A, DE OLIVEIRA R S, FIGUEIRO S D, et al. DC conductivity and dielectric permittivity of collagen-chitosan films [J]. Materials Chemistry and Physics, 2006, 99(2): 284-288.
[2] CHEN R N, WANG G M, CHEN C H, et al. Development of N,O-(carboxymethyl) chitosan/collagen matrixes as a wound dressing [J]. Biomacromolecules, 2006, 7(4): 1058-1064.
[3] 姚理荣,林红,陈宇岳. 胶原蛋白纤维的性能与应用 [J]. 纺织学报, 2006, 27(9): 105-107.
YAO Lirong, LIN Hong, CHEN Yuyue. Properties of the collagen fiber and its application [J]. Journal of Textile Research, 2006, 27(9): 105-107.
[4] 但卫华,周文常,曾睿,等. 胶原-壳聚糖共混纺丝液的制备 [J]. 中国皮革,2006, 35(7): 35-38.
DAN Weihua, ZHOU Wenchang, ZENG Rui, et al. The preparation of collagen-chitosan blended spinning solution [J]. China Leather, 2006, 35(7): 35-38.
[5] CHIAPPISI L, PREVOST S, GRILLO I, et al. Chitosan/alkylethoxy carboxylates: a surprising variety of structures [J]. Langmuir, 2014, 30(7): 1778-1787.
[6] 卢静,王雨佳,凌炜诗,等. 林蛙皮胶原/壳聚糖复合海绵的制备及性质 [J]. 中国组织工程研究,2017, 21(14): 2227-2233.
LU Jing, WANG Yujia, LING Weishi, et al. Preparation and properties of collagen/chitosan composite sponge from forest frog skin [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(14): 2227-2233.
[7] 谢海霞,沈先荣,葛卫红,等. 胶原蛋白-壳聚糖-海藻酸盐复合敷料的促愈合作用 [J]. 药物生物技术,2016, 23(6): 495-502.
XIE Haixia, SHEN Xianrong, GE Weihong, et al. Promoting healing of collagen-chitosan-alginate composite dressings[J]. Pharmaceutical Biotechnology, 2016, 23(6): 495-502.
[8] KAMINSKA A, SIONKOWSKA A. Photochemical transformations in collagen in the presence of β-carotene[J]. Journal of Photochemistry and Photobiology A: Chemistry, 1996, 96(1): 123-127.
[9] ZHU P P. A new criterion of polymer-polymer miscibility detected by viscometry [J]. European Polymer Journal, 1997, 33(3): 411-413.
[10] GEORGE D P, DAVID L C, RAJ P, et al. Self-assembly of collagen fibers. Influence of fibrillar alignment and decorin on mechanical properties [J]. Biophysical Journal, 1997, 73(4): 2164-2172.
[11] FANG M, GOLDSTEIN E L, MATICH E K, et al. Type I collagen self-assembly: the roles of substrate and concentration [J]. Langmuir, 2013, 29(7): 2330-2338.
[12] WANG L, GUO Y, LI P C, et al. Anion-specific effectson the assembly of collagen layers mediated by magnesium ion on mica surface [J]. Journal of Physical Chemistry B, 2014, 118(2): 511-518.
[13] 王雪娟,唐屹,吴炜誉,等. 戊二醛交联胶原蛋白/PVA 复合纤维的结构与性能 [J]. 纺织学报, 2007, 28(11):13-16.
WANG Xuejuan, TANG Yi, WU Weiyu.et al. Research on collagen/PVA composite fibers with glutaraldehyde as cross-linker [J]. Journal of Textile Research, 2007, 28(11):13-16.
[14] 王响,靳向煜. 再生牛皮胶原蛋白复合纤维的性能 [J]. 纺织学报,2015, 36(4): 1-6.
WANG Xiang, JIN Xiangyu. Study on properties of regenerated cattle skin collagen fiber [J]. Journal of Textile Research, 2015, 36(4):1-6.
[15] 姜晓,吴炜誉,唐诗俊,等. 胶原蛋白/PVA/碳纳米管复合纤维的结构与性能 [J]. 合成纤维工业,2009, 32(5): 9-12.
JIANG Xiao, WU Weiyu, TANG Shijun, et al. Structure and properties of collagen/PVA/carbon nanotube composite fibers [J]. China Synthetic Fiber Industry, 2009, 32(5):9-12.
[16] YAN M, LI B, ZHAO X, et al. Characterization of acid-soluble collagen from the skin of walleye pollock (Theragrachalcogramma) [J]. Food Chemistry, 2008, 107(4):1581-1586.
[17] 周文常. 胶原的提取及其复合纺丝液的制备 [D]. 成都:四川大学, 2004: 44-45.
ZHOU Wenchang. Extraction of collagen and preparation its blend spinning solution [D]. Chengdu: Sichuan University, 2004: 44-45.
[18] 温永堂,付国瑞. 聚对二氧环己酮医用可吸收缝合线纺丝工艺研究 [J]. 中国纺织大学学报,1997, 23(4): 21-25.
WEN Yongtang, FU Guorui. Study on spinning process of medical absorbable suture with poly (pdioxan-one) [J]. Journal of China Textile University, 1997, 23(4): 21-25.
