红花注射液体外抗凝血、抗氧化活性初步研究
2018-05-21王凯红梁萌萌张立伟
王凯红,梁萌萌,张立伟*
(1.山西大学 分子科学研究所,山西 太原 030006;2.山西大学 中医药现代研究中心,山西 太原 030006)
0 引言
红花注射液具有活血化瘀的功效。用于治疗闭塞性脑血管疾病、冠心病、脉管炎[1-2]。现代研究表明,红花注射液具有抗氧化活性[3],可以治疗心脑血管疾病。目前针对红花注射液的临床研究和药理研究报道较多[4-6],但基于红花注射液活性的化学物质研究相对较少并主要集中于羟基红花黄色素A(HSYA)的研究[7-9]。刘倩、赵剑锋等[10-11]以抗小鼠体内血栓形成的保护率和家兔体外血小板聚集抑制率为评价指标,筛选出总黄酮和HSYA、山柰酚-3-O-β-芸香糖苷、(8Z)-癸烯-4,6-二炔-1-O-β-D-葡萄糖苷、山柰酚-3-O-β-槐糖苷等为红花注射液抑制血栓形成和血小板聚集的化学物质基础。根据文献调研,红花注射液的活血化瘀功效与其抗凝血、抗氧化活性有关,如前面所述,对红花注射液的体外活性及其物质基础的研究集中于体外抑制血栓形成以及抑制血小板聚集作用,而体外延长活化部分凝血活酶时间(APTT)和抗氧化活性的化学物质基础鲜有报道。因此,为了进一步丰富红花注射液的体外生物活性以及药效物质基础研究,本研究评价了红花注射液体外延长APTT和抗氧化的活性,并比较分析了体外延长APTT和抗氧化的活性与其总黄酮、总多酚及主要化学成分HSYA含量之间的相关性。
1 仪器与试药
1.1 仪器
Agilent 1260高效液相色谱仪,美国Agilent公司;Venusil MP C18色谱柱(250 mm×4.6 mm,5 μm);Sysmex CA-50半自动凝血分析仪,日本Sysmex公司;HB.67-UNICO 7200可见分光光度计,美国尤尼柯(上海)仪器有限公司;Ohaus先行者分析天平;HH-4恒温水浴锅,国华仪器公司;微孔滤膜 (0.45 μm),上海市新亚净化仪器器件厂;移液枪,宁波拓普森科学仪器有限公司。
1.2 试药
不同企业生产的红花注射液购自药店(批号16042661,1031604204,16071011,170106,17011111,160808301,20170309)。
山柰酚对照品、羟基红花黄色素A (天津一方科技有限公司,批号1506284,201609);没食子酸对照品 (成都曼思特生物科技有限公司,批号MUST-17022801);人正常血浆 (山西生物技术研究所提供);APTT试剂盒 (上海太阳生物有限公司);1,1-二苯基-2-三硝基苯肼自由基 (DPPH·) (阿拉丁试剂有限公司);色谱乙腈 (美国Fisher Scientific);生理盐水 (河南科伦药业有限公司);其余试剂均为国产分析纯;实验用水为双蒸水。
2 实验方法
2.1 延长APTT活性测定
样品待测液配制:将7个企业的红花注射液(H-1~H-7)用生理盐水分别稀释成(V/V:100%,85%,72%,61%,52%)5个体积百分浓度作为样品待测液,剂间比0.85。
APTT活性测定[12]:取人正常血浆,加入3.8%的枸橼酸钠溶液抗凝,按9∶1比例混匀,2 500 r·min-1下离心10 min,得到的上清液即为贫血小板血浆(platelet-poor plasma,PPP)。25 mmol·L-1CaCl2溶液在37℃预热5~10 min。分别在凝血杯中加入50 μL PPP,50 μL样品待测液,将凝血杯放入凝血聚集仪,预热1 min后,快速加入50 μL APTT试剂,继续预热3 min,加50 μL 25 mmol·L-1CaCl2溶液,开始测定凝血时间,平行测定6次,记录测定结果。同时,分别以等体积的血浆及20%的LHII作为空白对照和阳性对照。凝血时间的延长百分率按下述公式计算:
D(%)=[(Ta-Tb)/Tb]×100%
(1)
其中,D为凝血时间延长百分率,Ta为样品组凝血时间,Tb为空白对照组凝血时间。
2.2 DPPH·清除能力测定
样品待测液配制:准确吸取7个不同企业的红花注射液(H-1~H-7)(5,25,45,65,85,105,130)μL于10 mL的棕色容量瓶中,无水乙醇稀释至刻度,得到系列浓度的待测溶液备用。
DPPH·清除率测定方法依据参考文献进行[13],略作修改。准确称取DPPH·9.86 mg,用无水乙醇溶解并定容到250 mL棕色容量瓶中,冷藏,作为DPPH·储备液备用。准确移取2 mL DPPH·储备液于试管中,加入2 mL待测溶液,避光反应40 min后,在517 nm下测定吸光度,每份样品平行测定3次。清除率按下述公式计算:
K(%)=[1-(Ai-Aj)/A]×100%
(2)
其中,K为清除率,A为空白对照的吸光度,Ai为加入待测液后的吸光度,Aj为待测液自身的吸光度。
2.3 总黄酮含量检测
样品总黄酮含量测定的方法,参考三氯化铝比色法进行[14],略作修改。
标准曲线制备:取山柰酚对照品适量,精密称定,加甲醇配制成每1 mL中含0.1 mg山柰酚的溶液,得对照品储备液。分别精密量取对照品储备液0.4,0.8,1.2,1.6,2.0,2.4 mL于10 mL容量瓶中,加甲醇定容至刻度,摇匀,得山柰酚对照品工作液。分别精密量取山柰酚对照品工作液2 mL,置于10 mL EP管中,各加0.1 mol·L-1三氯化铝溶液1.0 mL,甲醇2.0 mL,摇匀,置于40 ℃水浴中加热20 min,取出,冷却至室温,用甲醇代替工作液作为空白,用紫外可见分光光度计,在422 nm的波长处测定吸光度,每组平行测定3次,以吸光度值为纵坐标,山柰酚浓度为横坐标绘制标准曲线,得回归方程,线性范围为:4 ~24 μg·mL-1。
样品总黄酮含量测定:准确移取不同企业的红花注射液0.5 mL,加甲醇定容到10 mL的容量瓶中,待测。按 “标准曲线制备”项下山柰酚测定方法进行操作,待测液本底溶液做空白对照,平行测定3次,测得的吸光度值取平均值,利用绘制的山柰酚标准曲线的回归方程求出样品溶液中的总黄酮含量,以山柰酚当量计。
2.4 总多酚含量检测
样品总多酚含量测定的方法,参考Folin-Ciocalteu比色法进行[15],略作修改。
没食子酸标准曲线绘制:准确称取没食子酸标准品10 mg,用双蒸水溶解并定容到10 mL的容量瓶中,得到标准品母液。准确吸取(20,40,60,80,90,100,120)μL标准品母液于10 mL的容量瓶中。分别加6 mL双蒸水,摇匀,加入0.5 mL Folin-Ciocalteu试剂,摇匀,静置1 min后加入1.5 mL 20%(W/V)的无水碳酸钠,用双蒸水定容到10 mL。在75℃水浴中加热10 min,冷却,于760 nm下测得吸光度值。每组平行测定3次,标准品本底溶液做空白对照。以吸光度A为纵坐标,没食子酸浓度C为横坐标拟合标准曲线,得到回归方程,线性范围为:2~12 μg·mL-1。
样品总酚含量测定:分别准确移取不同企业的红花注射液15 μL于10 mL的棕色容量瓶中,按上述步骤进行测定,以样品空白做对照,平行测定3次。利用绘制的没食子酸标准曲线的回归方程求出样品中总多酚含量,以没食子酸当量计。
2.5 羟基红花黄色素A含量测定
红花注射液HPLC分析条件根据文献[16]略有改动。
HPLC分析条件:Venusil XBP C18(2)色谱柱(250 mm×4.6 mm,5 μm)。流动相为乙腈(A)-0.5%磷酸水溶液(B),梯度洗脱(0~10 min:5%~11%A;10~16 min:11%~14% A;16~23 min:14%~14% A;23~30 min:14%~20% A;30~70 min:20%~35% A)。流速为1 mL·min-1,检测波长402 nm,柱温35 ℃,进样量10 μL。
样品溶液的制备:取等体积7个不同企业的红花注射液,均用双蒸水稀释3倍,过0.45 μm的微孔滤膜后进行高效液相分析。
标准曲线绘制:精密称取0.60 mg羟基红花黄色素A,双蒸水溶解并定容至1mL容量瓶中,得到对照品储备液。用移液枪分别吸取对照品储备液0.04,0.08,0.15,0.32,0.50,0.64,1.0 mL并用双蒸水定容至5 mL容量瓶中,得到对照品工作液,分别过0.45 μm的微孔滤膜后进行高效液相分析。
2.6 数据处理方法
实验所得数据用mean ± SD表示;用SPSS 16.0进行方差分析,Duncan’s 法进行多重比较,显著水平为P<0.05;Pearson’s 法进行相关性分析。
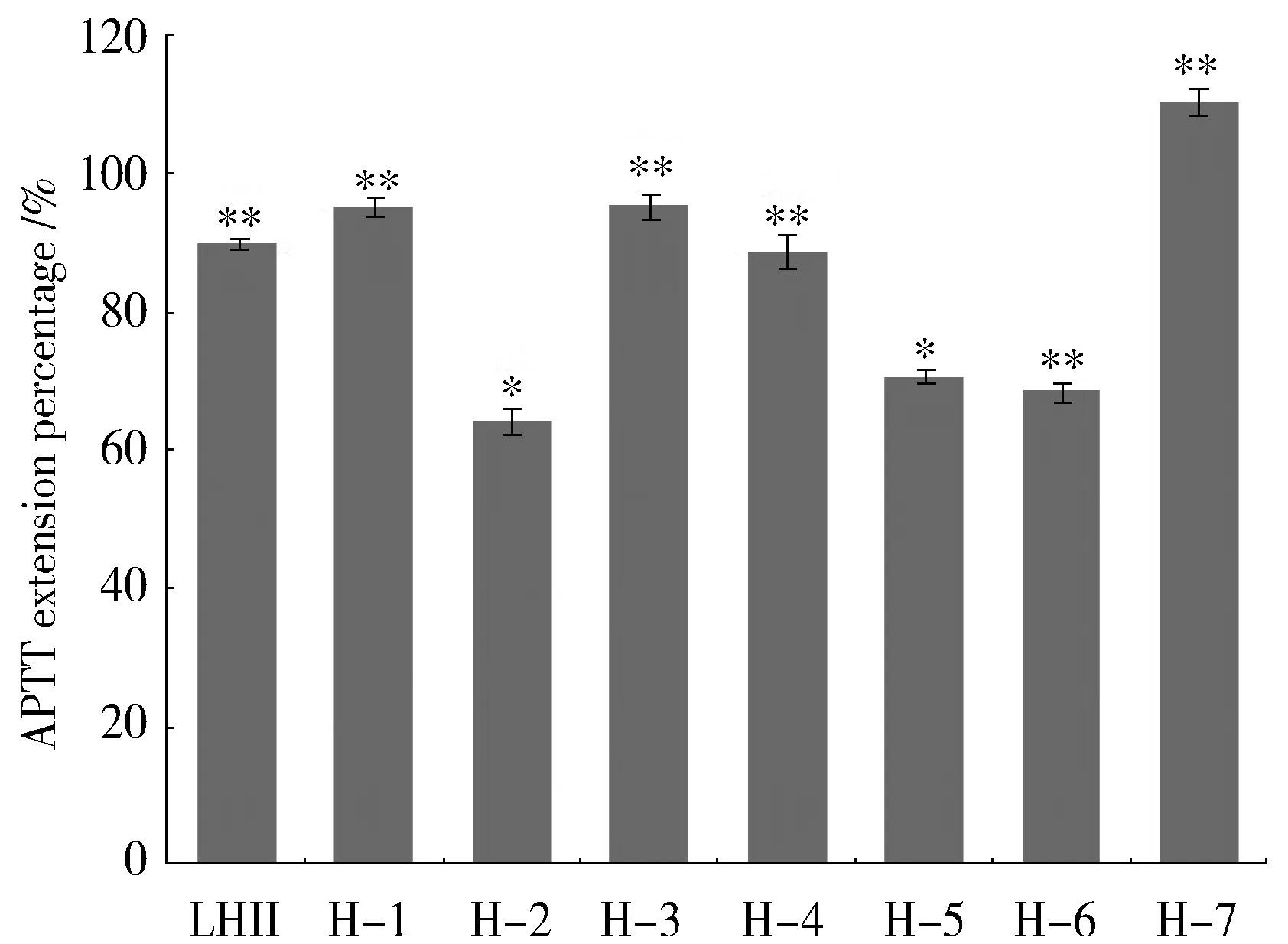
Fig.1 APTT extension percentage of Safflower injection/%图1 红花注射液APTT延长百分率注:图中的APTT延长百分率是测试浓度范围内的最大延长百分率(此时红花注射液为100%体积百分浓度)。与空白组比较,“*”表示P<0.05, “**” 表示P< 0.01。LHII为阳性对照组,H-1~H-7指7个不同企业的红花注射液
3 结果与讨论
3.1 APTT延长百分率
不同企业的红花注射液对人血浆体外APTT测定结果如图1所示。其中横坐标为样品编号,纵坐标为各厂家红花注射液在52% ~ 100%体积百分浓度范围内对APTT的最大延长率。结果显示,7个不同生产企业的红花注射液均对APTT具有延长作用,且都具有量效关系(图略)。不同企业的红花注射液对APTT的最大延长百分率在64%~110%范围内变化,与空白组比较,均具有显著性差异(P<0.05)。结果表明红花注射液能够影响内源性凝血途径,具有抗凝血作用。此外,在用量相同的情况下,各企业的APTT活性具有一定差异,见表1,可能是由于各企业使用的原料来源不同或生产工艺控制参数有差异而导致的。

Fig.2 DPPH·scavenging rate of Safflower injection/%图2 红花注射液DPPH·清除率/%注:H-1~H-7指7个不同企业的红花注射液。图中实验结果均具有统计学意义(P<0.05)。
3.2 DPPH·清除率
以每毫升反应液中红花注射液所含红花生药量为横坐标,DPPH·清除率为纵坐标作图,结果如图2。分析可知,不同企业的红花注射液均对DPPH·具有清除作用,且具有量效关系。不同企业生产的红花注射液对DPPH·的清除作用有一定差异,如表1所示。差异形成的原因与APTT活性差异相同。
3.3 总黄酮和总酚含量
依据山柰酚标准曲线回归方程Y=0.027 3X-0.012 5(R2=0.999 5,线性范围为4~24 μg·mL-1)和没食子酸标准曲线回归方程A=0.075 1C+0.024 1(R2=0.9998,线性范围为1~6 μg·mL-1),各企业样品总黄酮含量和总多酚含量如表1所示。7个企业的红花注射液总黄酮含量在0.48~0.64 mg·mL-1范围内,总多酚含量在(3.88 ± 0.10)~(4.43±0.15) mg·mL-1范围内。利用Duncan’s 法进行多重比较分析,不同企业的红花注射液总黄酮含量和总多酚含量具有显著性差异(P<0.05),见表1。
3.4 相关性分析
为进一步探讨红花注射液总黄酮、总多酚含量与APTT延长能力和DPPH·清除能力的内在关系,利用Pearson’s法进行了相关性分析。相关性分析结果表明(见表1),总黄酮含量与APTT延长百分率呈显著相关(R2=0.797,P<0.05),而与DPPH·清除率相关性不显著(R2=0.494,P>0.05)。因此,红花注射液中的黄酮类物质可能是其延长APTT作用的化学物质基础。总多酚含量与DPPH·清除率具有显著相关性(R2=0.856,P<0.05),而与APTT延长百分率相关性不显著(R2=0.722,P>0.05),可能是因为多酚分子中含有的大量酚羟基结构是其抗氧化性能的关键,酚羟基作为氢的供体,捕捉氧化过程中产生的自由基,从而终止自由基引发的氧化进程[17]。说明红花注射液中多酚类物质与其抗氧化能力间的关系密切,是红花注射液中起抗氧化作用的化学物质基础。

表1 不同企业红花注射液的总黄酮、总多酚含量以及APTT延长百分率、DPPH·清除率Table 1 Total flavonoid content, total polyphenol content, APTT extension percentage and DPPH·scavenging rate of different manufacturers of Safflower injection
3.5 羟基红花黄色素A含量与APTT延长百分率的关系
为进一步探讨羟基红花黄色素A的含量与APTT延长能力的内在关系,选取了红花注射液总黄酮含量呈规律性变化的5个样品,利用Pearson’s 法对5个样品的羟基红花黄色素A的含量与APTT延长能力进行了相关性分析。结果(见表2)表明,5个样品的总黄酮含量与APTT延长百分率呈显著相关(R2=0.934,P< 0.05),羟基红花黄色素A在黄酮类成分中占有较大比重,但羟基红花黄色素A 含量与APTT延长百分率之间无明显量效关系。尤其是虽然H-4中羟基红花黄色素A含量明显高于其他企业,但APTT延长百分率并没有明显增强,因此可以认为羟基红花黄色素A不是红花注射液延长APTT作用的主要活性成分,该结果与文献报道[18]一致。

表2 羟基红花黄色素A含量与APTT延长百分率的关系Table 2 Relationship between the content of hydroxysafflor yellow A and APTT prolonging rate
4 结论
4.1 临床观察已经证明红花注射液具有活血化瘀作用,而本实验研究结果表明红花注射液体外具有显著的延长APTT作用,提示红花注射液对内源性凝血系统的改善作用,是其具有活血化瘀功效可能的一个机制。相关性分析表明黄酮类物质可能是红花注射液抗凝血作用的有效化学物质基础。
4.2 红花注射液体外具有显著抗氧化活性,也可能是红花注射液具有活血化瘀作用的原因之一。此外,总多酚含量是红花注射液体外具有显著抗氧化活性的有效化学物质基础。
参考文献:
[1] 胡谋波,吕军影.红花注射液的临床应用进展[J].湖北民族学院学报(医学版),2017,34(1):68-70.DOI:10.13501/j.cnki.42-1590/r.2017.01.022.
[2] 高天红.红花提取物活血化瘀作用及抗血栓作用机制的实验研究[D].太原:山西医科大学,2011.DOI:10.7666/d.Y1949127.
[3] 蒋旭宏,黄小民.红花注射液对急性肝损伤大鼠抗氧化作用的实验研究[J].中华中医药学刊,2010,28(4):832-834.DOI:10.13193/j.archtcm.2010.04.162.jiangxh.054.
[4] 钟月平.红花注射液药理作用和临床应用研究进展[J].内蒙古中医药,2009,28(12):96-98.DOI:10.3969/j.issn.1006-0979.2009.12.098.
[5] 邹礼军.红花注射液的临床应用研究[J].中国医院用药评价与分析,2017(5):718-720.DOI:10.14009/j.issn.1672-2124.2017.05.050.
[6] 陈培栋,房利勤.红花注射液和注射用红花黄色素药理作用研究[J].世界中医药,2016,11(2):308-310.DOI:10.3969/j.issn.16737202.2016.02.034.
[7] Fan L,Pu R,Zhao H Y,etal.Stability and Degradation of Hydroxysafflor Yellow A and Anhydrosafflor Yellow B in the Safflower Injection Studied by HPLC-DAD-ESI-MSn[J].JChinPharmacolSci,2011,20(1):47-56.DOI:10.5246/jcps.2011.01.007.
[8] 刘燕,于健东,戴忠,等.红花注射液质量控制研究[J].药物分析杂志,2010,30(9):1732-1734.DOI:10.16155/j.0254-1793.2010.09.010.
[9] 王培娜,梁振褔.红花注射液在大耳兔体内药动参数的测定[J].河南大学学报(医学版),2011,30(2):99-100.DOI:10.15991/j.cnki.41-1361/r.2011.02.007.
[10] 刘倩,陈晨,戴忠,等.红花注射液有效成分的确定及不同厂家中量效关系的比较[J].药物分析杂志,2012,32(7):1158-1161.DOI:10.16155/j.0254-1793.2012.07.008.
[11] 赵剑锋,刘静,郭颖,等.红花注射液化学成分及其活性研究[J].中国中药杂志,2014,39(16):3102-3106.DOI:10.4268/cjcmm20141619.
[12] 王碧松,王志斌,高阳,等.血凝仪-APTT法测定肝素的效价[J].药物分析杂志,2012,32(7):1154-1157.DOI:10.16155/j.0254-1793.2012.07.030.
[13] Sharma O P,Bhat T K.DPPH Antioxidant Assay Revisited[J].FoodChem,2009,113(4):1202-1205.DOI:10.1016/j.foodchem.2008.08.008.
[14] 马陶陶,张群林,李俊,等.三氯化铝比色法测定中药总黄酮方法的探讨[J].时珍国医国药,2008(1):54-56.DOI:10.3969/j.issn.1008-0805.2008.01.029.
[15] 程启斌,李石飞,张立伟.连翘不同部位总酚含量测定及抗氧化活性比较研究[J].化学研究与应用,2016,28(5):610-616.DOI:10.3969/j.issn.1004-1656.2016.05.008.
[16] 王若菁,杨滨,付梅红.红花药材的质量评价[J].中国中药杂志,2008,33(22):2642-2646.DOI:10.3321/j.issn:1001-5302.2008.22.017.
[17] 马承慧,王群,刘牧.7种松科植物松针提取物的体外抗氧化活性比较[J].东北林业大学学报,2016,44(6):45-48.DOI:10.3969/j.issn.1000-5382.2016.06.012.
[18] 王碧松.生物活性测定法用于活血化瘀类中药注射剂质量控制的研究[D].北京:北京中医药大学,2010.
