逆境胁迫下植物磷脂酶D的生理功能和作用机制综述
2018-05-18何雪梅李昌宝零东宁饶川艳肖占仕盛金凤郑凤锦
李 丽,孙 健,何雪梅,李昌宝,零东宁,饶川艳,肖占仕,盛金凤,郑凤锦,易 萍
(1.广西农业科学院农产品加工研究所,广西南宁530007;2.广西果蔬贮藏与加工新技术重点实验室培育基地,广西南宁530007)
磷脂酶D(phospholipase D,简称PLD),全称磷脂酰胆碱磷脂水解酶(EC3.1.4.4),是一类催化磷酸二酯键水解和碱基交换的酶的总称,能水解不同膜磷脂产生磷脂酸(phosphatidic acid,简称PA)和各种头部基团,如胆碱或乙醇胺等。PLD可以在植物各个组织器官(根、茎、叶、种子、果实等)中广泛表达,且集中于生长代谢旺盛的部位,如成熟初期的种子和萌芽初期的幼苗[1-2]。前期研究表明,PLD在脂类代谢和细胞调控方面有多重功能,参与了从激素信号传递到环境胁迫响应的胞内及亚细胞内的各种动态过程[3-4]。PLD水解磷脂产物PA还可作为第二信使,参与胞内信号传递过程,触发胞内与抗性(抗逆性和抗病性等)相关的“程序化反应”来响应逆境[5]。因此,PLD是兼具水解作用和信息传递作用的双重功能酶,在植物生长发育和抗逆过程中起到重要的作用。
PLD参与植物对环境逆境胁迫的响应,研究表明,逆境胁迫(机械损伤、冷害、干旱、高盐、营养不良及病虫害)等均能诱导植物PLD的活性发生变化,从而导致磷脂降解、膜通透性改变,最终造成植物伤害甚至死亡[6]。如果能在适当范围内对PLD的活性进行调控,能在一定程度上改变植物对逆境的响应,有助于细胞膜结构的保持和细胞内区域化结构的完整,减少植物受到的伤害。本文结合作者的研究工作,通过对磷脂酶D与植物逆境胁迫关系的论述,探讨PLD在机械损伤、低温、干旱和微生物等不同非生物、生物胁迫下的响应机制,为进一步针对植物逆境胁迫调控方法的研究提供参考。
1 磷脂酶D基因差异表达特性
磷脂既是生物膜的骨架成分,又能通过水解产物来参与多种生理过程和环境刺激诱发的细胞反应。磷脂酶是催化磷脂水解第一步的关键酶,根据水解磷脂部位的不同将磷脂酶分为 5类,即磷脂酶 A1(PLA1)、磷脂酶 A2(PLA2)、磷脂酶 B(PLB)、磷脂酶 C(PLC)和磷脂酶 D(PLD)[7]。磷脂酶的催化活性表现在脂类代谢、膜再建、脂类信号分子(如三磷酸肌醇、二酰基甘油、磷脂酸)和游离脂肪酸等的产生方面[8]。近年来的研究表明,磷脂酶几乎在植物所有生命阶段及对环境的应答中起着非常重要的作用[9-14],而PLD在组织衰老及果实采后老化的细胞膜降解过程中起重要作用。在许多植物中,如黄瓜、蓖麻、番茄、猕猴桃、甘蓝、烟草、玉米、豇豆、草莓、龙眼等老化的果实中都观察到了PLD活性的增强和PA的形成[15]。前期研究发现,通过调节磷脂酶D活性,可降低水果果实贮藏期间的褐变与感病指数,减缓果皮褐变及采后果实衰老劣变[16-17]。
PLD参与细胞膜的降解及生物合成,因而它对保持细胞膜稳定性及生理功能起着重要的调控作用。植物中包含多个不同类别的PLD基因,但各种PLD在不同植物种类、器官、组织和细胞类型中表现出特异性和不同的作用调控机制,如不同的PLD能特异性地降解不同的膜磷脂。此外,PLD参与膜的生物合成及降解,它被激活后能够改变细胞膜中脂质组分,从而影响细胞膜在不同环境条件下的稳定性[6]。国内外研究发现,植物中PLD的总体结构域相似,但是在某些单元上不同类型之间存在重要的差异,它们各具独特的生物化学特性,因此,不同的PLD在不同胁迫条件下表现出特异的功能[18]。Katagiri等在对拟南芥PLD活性的研究中发现,PLDδ与质膜紧密相连,并在老叶、茎、花及根中具有相对高的表达活性[19]。You等研究表明,PLDδ基因在不同组织中的有明显的特异性表达(花芽<花、幼叶<老叶),其中在相对表达差异最大的成花组织中,花的相对表达量为花芽的2.86倍[20]。综合上述结果表明,PLD在植物生长发育的不同阶段及响应外界环境因子刺激的信号转导过程中均起着重要的调节作用。
2 磷脂酶D基因在植物逆境胁迫信号转导中的作用
2.1 病原菌微生物侵染
植物在受到病原微生物逆境胁迫时,通常也会发生一系列的抗逆反应。研究发现,PLD会富集于微生物与质膜的接触部位,引起酶活性及亚细胞定位发生变化,以抵御病原菌的侵染,PLD在植物抵御病害的防卫信号产生中不可或缺[21]。在植物与病原菌的相互作用过程中,短时间内改变PLD活性可能会引起植物对病原菌的敏感性发生变化,而长期改变PLD活性则可能会引起细胞骨架改变和膜的重新组装(或降解)。
病原菌侵染植物体时,会激活植物的PLD,使其活性发生变化,并且参与到植物抵御病原侵染时的超敏反应(hypersensitive response)过程中[22-23]。Young等用黄单胞菌侵染水稻抗性株和敏感株时,敏感株的PLD蛋白在第5天就很难被检测到,此时植株表现出病斑扩大、叶片发黑干枯的感病表型,而抗性株的PLD活性则一直保持较高水平[22]。王莲莲采用荧光标记PLD观察的结果表明,在病原菌侵染敏感性水稻叶片后24 h内,PLD在质膜内侧均匀分布,而侵染抗性植株12 h后,PLD在病原菌侵染的细胞质膜一侧集中分布,这表明PLD的分布和表达差异可能造成植株抗病性的差异[24]。当白叶枯病病原菌侵染水稻时,PLDα活性明显提高,且抗病性品种更为显著,PLDα聚集于病原菌与植物接触的质膜部位,暗示PLDα可能在抵御病菌的过程中起作用[25]。用真菌激发子木聚糖酶处理烟草细胞时,PLDβ和PLDγ水解的产物N-乙酰乙醇胺(N-acetylethanolamine,简称NAE)很快释放,说明PLDβ和PLDγ在抗病中具有一定的作用[26-27]。在豆类幼苗期,致瘤因素(包括病原菌微生物)能激活PLD,通过减少受n-丁醇抑制根毛的变形而促进PA的合成[28]。
2.2 干旱胁迫
干旱胁迫导致的植物代谢紊乱与PLD活性变化密切相关,但是其作用机制与机械损伤和低温胁迫相比又有所不同。植物激素脱落酸(简称ABA)在调节植物渗透胁迫应答中起着重要作用。在渗透胁迫下,会诱导植物内源脱落酸浓度增加并激活PLD(图1),而PLD活性的增加主要是为了响应脱落酸信号[29]。脱落酸浓度增加的同时诱导叶片保卫细胞气孔关闭,这一过程有利于维持干旱胁迫下叶片水势和植物的存活[30]。保卫细胞中脱落酸促进钙离子通道对 Ca2+的摄入,Ca2+作为植物PLD活性的一个调节因子,能够激活PLD并促进PLDα与质膜的结合[31]。研究表明,脱落酸可诱导保卫细胞中PLD活性的增强[32]。由此可见,PLD可能是Ca2+浓度发生变化后作用的底物之一,而该变化响应植物干旱胁迫并使细胞中脱落酸水平增加。因此,PLDα通过参与脱落酸诱导的气孔运动而正调控植物对水分胁迫的应答反应。ABA、Ca2+等信号分子在应对不同逆境胁迫响应中的作用方向一致,而PLDα在响应干旱和低温胁迫应答中的作用截然相反,这源于PLDα在这2种逆境胁迫反应中有着不同的作用机制。在干旱胁迫应答中,PLDα主要通过转导脱落酸信号来调控气孔运动进而影响植物的抗旱性。
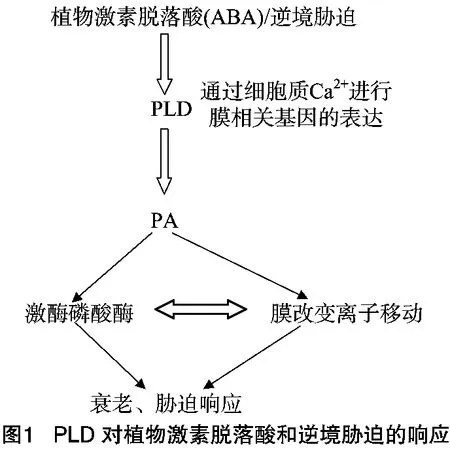
许多植物在高渗透胁迫环境下,例如番茄、紫花苜蓿、绿藻和拟南芥脱水叶片中的PLD活性及其产物PA均会增加[33]。高渗透诱导PLD活性增加有可能是对脱落酸的响应,也可能是PLD参与了脱落酸信号传递途径。渗透胁迫与PA水平升高有关[34]。在绿藻、番茄和紫花苜蓿的悬浮细胞系中,在盐(NaCl)胁迫情况下,PA会迅速积累;采用其他渗透物,如蔗糖、甘露醇等也有类似作用,说明高渗透压是导致PA快速累积的效应器。当绿藻处于干旱胁迫下时,数分钟内能特异地诱导PLD表达,同时增强其活性[35-36]。用脱落酸处理植物时则没有相似现象发生,表明脱落酸处理和干旱激活不同类型的PLD。外源脱落酸的施加可将干燥条件下果实失水率降低近30%,此时PLD基因的表达也有所增强。
当植物受到干旱胁迫时,为了维持体内充足的水分,脱落酸诱导的气孔关闭的敏感性将会提高,从而降低蒸腾并减少水分的流失。前期研究表明,PLD在脱落酸介导的信号转导途径中也起着重要作用。干旱胁迫会激活PLD,进而促进脱落酸诱导气孔关闭,减少植株体内的水分流失,从而适应干旱条件。Sang等研究表明,干涉PLD的植株叶片的蒸腾失水率显著高于野生型对照[33]。孙磊研究表明,PLD的活性增强能显著降低植物的气孔导度,减少水分丧失,从而提高抗旱能力[37]。由此可见,PLD主要通过参与调节水分胁迫条件下的气孔导度来影响植物的抗旱性。
2.3 机械损伤
机械损伤是造成采后果蔬品质劣变的最严重胁迫之一,可使果蔬细胞组织受到严重的破坏,引起品质下降,贮藏期缩短。机械损伤能够改变果蔬的生理代谢过程,使细胞膜受到破坏,导致磷脂降解产生自由脂肪酸和大量的磷脂酸的积累。番木瓜鲜切后,PLD、细胞壁结构蛋白基因表达量增加并伴随酶活性增加,导致细胞壁软化加速,进而加快果实软化[38]。赵宇瑛对黄瓜的研究表明,机械损伤诱导黄瓜的PLD基因表达量增加[39]。
机械损伤会激活PLD并导致磷脂的水解。PLD的激活促进其产物PA的生成,并伴随游离胆碱水平的升高,表明磷脂酰胆碱是反应的底物。研究表明,抑制拟南芥PLDα的活性可同时减少机械损伤诱导的PA及参与调控许多防御反应的茉莉酸(简称JA)的积累[5]。在大豆中,PA能诱导一种机械损伤激活的49 ku分裂素激活的蛋白激酶(简称MAPK),通过n-丁醇降低PA的形成可以抑制这种诱导作用,该结果表明PLD的产物PA在MAPK信号转导中具有信使的功能[40-41]。受到机械损伤刺激后,胞质中的PLD会聚集到膜上,导致膜结合PLD瞬间增加,该过程与磷脂的减少密切相关[42]。进一步研究表明,与膜结合PLD的增加会加速脂质降解。例如,辐射处理后的花椰菜小花会快速引起膜结合PLD活性的增强,并进一步加速细胞膜的降解。蓖麻叶片中膜结合PLD的增加也会影响磷脂降解的速率及叶片的衰老[43]。由此可见,机械伤害引起的PLD活性增强是由膜结合的PLD聚集引起的,其原因可能是PLD与膜的结合会增加其与底物结合的机会,进而促进其作用底物脂质的水解。
PLD活性的增强不是由其mRNA转录或蛋白水平的提高造成的,而是PLD蛋白质由胞质向细胞膜转移造成的[21]。向原生质体培养缓冲液中添加生理浓度的Ca2+可以增强这种向微粒体的转移作用,原因之一可能是机械伤害诱导原生质膜中PLD、PLA的协同激活,进而增加了叶绿体中游离脂肪酸的释放量、促进茉莉酸的生物合成并激活其下游防御基因。近年来的研究表明,受到机械伤害的蓖麻叶游离亚麻酸的增加与由PLD介导的磷脂水解有关,间接说明PLD与PLA在蓖麻叶在受到机械伤害后的信号转导过程中起着协同作用。该结果与前人的研究结果一致,表明多种植物在受到机械伤害的数分钟内PLA、PLD的作用产物均会增加[33]。
植物受到机械损伤后,其损伤信号可从损伤部位传递至未损伤部位,同时诱发一系列生理生化反应。其中最主要的生理反应之一是细胞膜完整性的损坏,机械损伤后会加快植物膜脂分解代谢,通过增强PLD对产物的水解来响应机械胁迫。有关黄瓜果实机械损伤的研究表明,机械损伤会导致黄瓜细胞膜结合的Ca2+含量降低,从而促进PLD基因的表达,同时PLD活性的增强,进一步造成其底物PI、PC含量下降和产物PA含量快速上升,并在10 h增长速率达到56.49%[44]。机械损伤会促进植物细胞膜中的Ca2+向细胞质中的流动,从而诱导PLD基因的表达,提高PLD的活性,最终破坏细胞膜的完整性。此外,黄瓜对机械损伤的响应程度因果实部位的不同而存在一定的差异,采后果蔬的成熟度对机械损伤所引起的PLD的响应程度具有明显影响,越是成熟的部位PLD变化对损伤越敏感[39,45]。
2.4 低温及冷害胁迫
低温条件能够降低植物细胞的代谢速率,延缓果蔬等植物的成熟衰老过程,然而,某些植物由于对温度的敏感性,不能适应低温而容易遭受冷害[46]。冷害信号同样能够从损伤组织传递到未损伤组织,从而诱发植物一系列的生理反应。前期研究表明,细胞膜是维持细胞正常代谢和功能的关键亚细胞器,而PLD是细胞膜磷脂水解的起始酶类,它既能通过水解细胞膜磷脂调节膜的结构和功能,也能通过其反应产物如PA、二酰基甘油(简称DAG)等参与低温胁迫条件下细胞的信号转导[47-48]。黄瓜受到低温及冷害胁迫时,PLD通过降解细胞膜及其产物参与信号转导以响应冷害[49]。黄瓜冷害初始反应的首要步骤是激活PLD,随后PLD活性增强,PLD基因表达与其活性呈现平行关系,且当PLD的转录水平达到峰值时,相应的PLD活性大大提高,这时黄瓜对低温胁迫的感应非常强烈,最终结果就是冷害的形成。黄瓜微粒体膜中与线粒体膜中的PLD基因在接受热处理时会受到抑制,从而使该基因的表达及活性均有所降低[50-51]。黄瓜果实PLD底物磷脂酰肌醇(PI)、磷脂酰胆碱(PC)含量会在低温贮藏过程中下降,其产物PA含量则升高,且在冷害开始发生时PA含量会有一个大幅度升高的过程。PA会破坏膜脂的稳定性,其过量积累会直接导致冷害发生[52]。对桃PLDα基因表达的分析表明,低温会诱导果实中PLD的表达,因此推测PLD可能作为一种信号分子在果实对低温、冷害信号的感应与识别中起着重要作用[23]。在植物低温驯化过程中,会积累大量脯氨酸、可溶性糖等渗透调节物质,降低细胞渗透势,以保护细胞免受胞间结冰导致的原生质的脱水胁迫。
3 展望
PLD参与了植物胁迫信号的转导并在该过程中起着重要作用。细胞膜上的细胞内信号途径以及磷脂代谢途径均具有一定程度的复杂多样性,现阶段针对于外界胁迫和传递信号过程中的PLD具体功能与途径并没有得到确定。采用最新分子生物学方法,深入探究PLD在植物生长和成熟衰老中的作用机制,既能揭示PLD的调控机制及生理功能,又能阐明植物感应和适应环境因子的机制。但是由于PLD基因表达调控模式及其作用机制的复杂性,PLD的亚型鉴定、纯化及其表达模式与组织细胞或生长阶段的相关性还未得到阐明,各亚型的调控机制及其参与到其他信号系统的作用方式有待深入探究。通过整合基因编辑技术、生化分析,转录组结合蛋白组及脂质代谢组等现代生物技术,将明确各个PLD基因在某一特异信号转导途径或者特异细胞过程中的功能,从而系统地揭示PLD在植物中的生物学功能和作用机制,这也将为我们对脂质信号转导机制及其在逆境或激素的信号传递网络作用中的进一步解析奠定基础。植物受到逆境胁迫时,会在基因表达、信号转导、代谢物形成和蛋白表达等多个层次进行响应,随着高通量测序技术、现代分析技术和生物信息学的发展,在未来研究中将基因组学、蛋白质组学与代谢组学有机结合,能够更全面和系统地阐述植物在逆境胁迫下、成熟衰老过程中生理生化过程的关系及相关分子机制,对控制水果、蔬菜等采后品质、探索有效的采后保鲜技术具有重要的科学意义。
参考文献:
[1]Lan W W,Tong L.Focus on molecules:phospholipase D[J].Experimental Eye Research,2012,103:121-122.
[2]Romero P,Gandía M,Alférez F. Interplay between ABA and phospholipases A2and D in the response of citrus fruit to postharvest dehydration[J].Plant Physiology and Biochemistry,2013,70:287-294.
[3]李 丽,游向荣,孙 健,等.植物磷脂酶D基因表达与衰老的关系[J].热带亚热带植物学报,2012,20(1):99-106.
[4]李杰民,孙 健,李昌宝,等.磷脂酶D抑制剂处理对采后龙眼果实贮藏性质的影响[J].南方农业学报,2013,44(9):1534-1537.
[5]Wang X.Phospholipase D in hormonal and stress signaling[J].Current Opinion in Plant Biology,2002,5(5):408-414.
[6]Oblozinsky M,Bezakova L,Mansfeld J,et al.The transphosphatidylation potential of a membrane-bound phospholipase D from poppy seedlings[J].Phytochemistry,2011,72(2/3):160-165.
[7]Wang X.Plant phospholipases[J].Annual Review of Plant Physiology and Plant Molecular Biology,2001,52(4):211-231.
[8]林 芳,许智宏,薛红卫.植物信号传导中的磷脂酶[J].植物学报,2001,43(10):991-1002.
[9]Pinhero R G,Almquist K C,Novotna Z,et al.Developmental regulation of phospholipase D in tomato fruits[J].Plant Physiology and Biochemistry,2003,41(3):223-240.
[10]Zhang W,Yu L,Zhang Y,et al.Phospholipase D in the signaling networks of plant response to abscisic acid and reactive oxygen species[J].Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids,2005,1736(1):1-9.
[11]Bargmann B O R,Munnik T.The role of phospholipase D in plant stress responses[J].CurrentOpinion in Plant Biology,2006,9(5):515-522.
[12]HafsiC,Russo M A,SgherriC,etal.Implication of phospholipase D in response of Hordeumvulgare root to short-term potassium deprivation[J].Journal of Plant Physiology,2009,166(5):499-506.
[13]Wan SB,Zhang B,Zhan JC,et al.In silico cloning and sequence analysis of phospholipase D α gene from peach fruit[J].Agricultural Sciences in China,2009,8(11):1293-1300.
[14]Alderete L G S,Racagni G,Agostini E,et al.Phospholipid turnover and phospholipase D activity in tobacco hairy roots exposed to phenol[J].Environmental and Experimental Botany,2012,77(2):141-145.
[15]袁海英,陈力耕,何新华,等.磷脂酶D在果实发育和成熟过程中的作用[J].园艺学报,2005,32(5):933-938.
[16]Sun J,You X R,Li L,et al.Effects of a phospholipase D inhibitor on postharvest enzymatic browning and oxidative stress of litchi fruit[J].Postharvest Biology and Technology,2011,62(3):288-294.
[17]Li L,Li JM,Sun J,et al.Effects of 2-butanol on quality and physiological characteristics of longan fruit stored at ambient temperature[J].Postharvest Biology&Technology,2015,101(3):96-102.
[18]张 充,蒋继志,廖祥儒,等.植物中的磷脂酶D[J].植物生理学通讯,2005,41(5):691-697.
[19]Katagiri T,Takahashi S,Shinozaki K.Involvement of a novel Arabidopsis phospholipase D,AtPLDδ,in dehydartion-inducible accumulation of phosphatidic acid in stress signaling[J].The Plant Journal,2001,26(6):595-605.
[20]You X R,Zhang Y Y,Li L,et al.Cloning and molecular characterization of phospholipase D(PLD)delta gene from longan(Dimocarpus longan Lour.)[J].Molecular Biology Reports,2014,41(7):4351-4360.
[21]Chapman K D.Phospholipase activity during plant growth and development and in response to environmental stress[J].Trends in Plant Science,1998,3(11):419-426.
[22]Young SA,Wang X,Leach JE.Changes in the plasma membrane distribution of rice phospholipase D druing resistantions with Xanthomonasory zaepvoryzae[J].Plant Cell,1996,8(6):1079-1090.
[23]王 涛,梅旭荣,钟秀丽,等.磷脂酶Dδ参与植物的低温驯化过程[J].植物学报,2010,45(5):541-547.
[24]王莲莲.磷脂酶C和磷脂酶D在核黄素诱导烟草悬浮细胞防卫反应中的作用[D].泰安:山东农业大学,2009.
[25]Li M Y,Hong Y Y,Wang X M.Phospholipase D- and phosphatidic acid-mediated signaling in plants[J].Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids,2009,1791(9):927-935.
[26]Munnik T,Arisz S A,de Vrije T,et al.G-protein activation stimulates phospholipase D signaling in plants[J].The Plant Cell,1995,7(12):2197-2210.
[27]Munnik T,Irivine R F,Musgrave A.Phospholipid signalling in plants[J].Biochimica et Biophysica Acta- Lipids and Lipid Metabolism,1998,1398(3):222-272.
[28]Hartog M D,Musgrave A,Munnik T.Nod factor-induced phosphatidic acid and diacylglycerol pyrophosphate formation:a role for phospholipase C and D in root hair deformation[J].The Plant Journal:for Cell and Molecular Biology,2001,25(1):55-65.
[29]王海燕.磷脂酶Ds在植物干旱胁迫反应中的功能与作用机理[D].北京:中国农业科学院,2011.
[30]Blatt M R.Ca2+signaling and control of guard-cell volume in stomatalmovements[J].Curr Opin Plant Biol,2000,3(3):196-204.
[31]Hamilton DW,Hills A,Kohler B,etal.Ca2+channels at the plasma membrane of stomatal guard cells are activated by hyperpolarization and abscisic acid[J].Proc Natl Acad Sci USA,2000,97(9):4967-4972.
[32]Jacob T,Ritchie S,Assmann S M,et al.Abscisic acid signal transduction in guard cells ismediated by phospholipase D activity[J].Proc Natl Acad Sci USA,1999,96(21):12192-12197.
[33]Sang Y,Cui D,Wang X.Phospholipase D and phosphatidic acidmediated generation of superoxide in Arabidopsis[J].Plant Physiol,2001,126(4):1449-1458.
[34]Frank W,Munnik T,Kerkman K,et al.Water deficit triggers phospholipase D activity in the res urrection plant Craterostigma plantagineum[J].Plant Cell,2000,12(1):111-124.
[35]Sciorra V A,Rudge S A,Prestwich G D,et al.Identification of a phosphoinositide bindingmotifth atmediatesactivation ofmammalian and yeast phospholipase D isoenzymes[J].EMBO J,1999,18:5911-5921.
[36]Sciorra V A,Rudge S A,Wang J,et al. Dual role for phosphoinositides in regulation of yeast and mammalian phospholipase D enzymes[J].JCell Biol,2002,159(6):1039-1049.
[37]孙 磊.磷脂酶 Dα1基因调控植物抗旱性的作用途径研究[D].北京:中国农业科学院,2012.
[38]Karakurt Y,Huber D J.Characterization of wound-regulated cDNAs and their expression in fresh-cut and intact papaya fruit during low-temperature storage[J].Postharvest Biology and Technology,2007,44(2):179-183.
[39]赵宇瑛.黄瓜磷脂酶D和抗氧化系统对采后机械损伤胁迫的响应[D].杭州:浙江大学,2011.
[40]Lee SM,Suh S,Kim S,et al.Systemic elevation of phosphatidic acid and lysophospholipid levels in wounded plants[J].Plant J,1997,12(3):547-556.
[41]Wang X.Regulatory functions of phospholipase D and phosphatidic acid in plant growth,development,and stress responses[J].Plant Physiology,2005,139(2):566-573.
[42]Ryu SB,Wang XM.Activation of phospholipase D and the possible mechanism of activation in wound-induced lipid hydrolysis in caster bean leaves[J].Biochimica et Biophysica Acta,1996,1303(3):243-250.
[43]Ryu S B,Wang X M.Increase in free linolenic and linoleic acid associated with phospholipase D-mediated hydrolysis of phospholipids in wounded castor bean leaves[J].Biochimica et Biophysica Acta,1998,1393(1):193-202.
[44]彭 燕.采后黄瓜对机械损伤和低温胁迫的响应机制研究[D].杭州:浙江大学,2012.
[45]王秀娟,高 山,王国泽.磷脂酶D的抗逆特性及其活性检测研究[J].湖北农业科学,2014,53(5):998-1000,1003.
[46]许佳妮,邓丽莉,曾凯芳.磷脂酶D在果蔬采后逆境胁迫及衰老过程中的作用[J].食品工业科技,2015,36(5):392-395,399.
[47]Campos P S,Quartin V,Rmaalho JC.Electrolyte leakage and lipid degradation account for cold sensitivity in levaes of Coffea sp.plants[J].JPlant Physiol,2003,160(3):283-292.
[48]Barman K,Asrey R,Pal R K,et al.Postharvest nitric oxide treatment reduce chilling injury and enhances the shelf-life of mango(Mangifera indica L.)fruit during low-temperature storage[J].Journal of Pomology and Horticultural Science,2014,89(3),253-260.
[49]宋颖琦,杨 谦.磷脂酶在植物逆境胁迫信号传导中的作用[J].哈尔滨工业大学学报,2006,38(2):243-246.
[50]Mao L C,Wang G Z,Zhu CG,etal.Involvementof phospholipase D and lipoxygenase in response to chilling stress in postharvest cucumber fruits[J].Plant Science,2007,172(2):400-405.
[51]Mao L C,Pang H Q,Wang G Z,et al.Phospholipase D and lipoxygenase activity of cucumber fruit in response to chilling stress[J].Postharvest Biology and Technology,2007,44(1):42-47.
[52]王国泽.磷脂酶D感应和接受低温胁迫的功能及在黄瓜冷害中的作用[D].杭州:浙江大学,2006.
