一株梭鲈源无乳链球菌的分离、鉴定及分子分型分析
2018-05-17赵长臣江小燕刘春花张德峰曾伟伟陈总会黄志斌
赵长臣,江小燕,刘春花,张德峰,罗 霞,曾伟伟,陈总会,2,黄志斌
(1.中国水产科学研究院珠江水产研究所 广州 510380;2.广州普麟生物制品有限公司 广州 510380)
梭鲈(Luciopercalucioperca)原分布于咸海、黑海、波罗的海水系的河流、湖泊中,经过多次繁殖已遍及欧洲各国,我国仅自然分布于新疆伊犁河水系和额尔齐斯河水系[1]。上世纪90年代我国梭鲈人工繁育获得成功,至今东北、华北、华东、华南地区均有养殖,已成为我国重要的名优淡水养殖鱼类。梭鲈易发生车轮虫、指环虫等寄生虫病害,但在鱼苗或养成阶段,抗病能力较强,不易患病,目前在我国尚未发现梭鲈病毒性及细菌性病害发生的报道。梭鲈为掠食性鱼类,饲料以鲜活饵料鱼为主,但近年来为了降低养殖成本,广东顺德等地出现了以冰鲜鱼代替鲜活饵料鱼的现象,加大了梭鲈感染外来病原微生物的潜在威胁。2017年3月广东省佛山顺德一工厂化养殖场出现梭鲈发病并死亡的现象,一口养殖了4 000 kg梭鲈的内循环水养殖池,水温20~25 ℃,pH 7.2,鱼重200 g左右,鱼发病率高达30%以上,日死亡50~100条,至取样时死亡持续期已延续10日以上。病鱼的主要症状为双眼凸出且虹膜充血,体表正常,剖检可见脾脏肿大,肝脏、肠、肾等器官未见异常,腹内无积水,无异味。通过光学显微镜观察排除真菌及寄生虫感染。
自1976年Pier等[2]第一次从鱼体上分离到致病链球菌,至今致病性无乳链球菌在水生动物宿主中被广泛发现,主要分布于温带和亚热带养殖的鱼类中,南美洲、亚洲、大洋洲等许多国家均有报道[3-7],感染鱼类包括罗非鱼(Oreochromisspp)、虹鳟(Oncorhynchusmykiss)、牙鲆(Paralichthysolivaceus)、真鲷(Pagrosomusmajor)等多种水生动物[8-13]。自2007年以来,中国南方地区陆续有罗非鱼无乳链球菌病暴发的报道,给我国水产养殖业造成重大损失。
本研究利用从濒死梭鲈体内分离得到的优势菌株对健康梭鲈进行人工回归感染,确定其致病性,通过形态观察、溶血测定、生理生化特性测定以及结合生物学16S rRNA基因序列的系统发育学分析等方法对病原菌进行分类鉴定,同时进行了耐药性分析实验,以期为梭鲈的病原研究及发病机理、防治措施提供参考。
1 材料与方法
1.1 病原菌的分离与纯化
1.1.1 材料来源
梭鲈样品于2017年3月取自佛山顺德某工厂化养殖场,体长35~40 cm,质量(250±10)g,患病梭鲈眼睛双侧明显凸出,虹膜出血,体表正常,脾脏肿大,其他内脏组织未见异常。
1.1.2 细菌分离
分别从患病梭鲈眼、肝脏、脾脏取材接种于血平板,28 ℃培养36~48 h,做细菌分离,所检的5条病鱼不同部位均分离到数量不同的优势生长单菌落,菌落特征呈半透明、乳白色,光滑圆形,单菌落0.5 mm左右,γ溶血,选取单菌落进一步在血平板上划线纯化,直至获得纯的培养菌株,命名为SL170/株,转接到加脑心浸液培养基(BHI)琼脂斜面4 ℃保存备用。
1.2 回归感染梭鲈、罗非鱼实验
1.2.1 材料来源
健康梭鲈购自广东佛山顺德,规格为(200±10)g,实验鱼均暂养于珠江水产研究所水生实验动物房内,分离得到的纯培养菌株接种于BHI液体培养基中,28 ℃恒温培养36 h,离心收集菌体,用0.65%的无菌生理盐水进行稀释,实验共分6组菌液梯度,4.5×108、4.5×107、4.5×106、4.5×105、4.5×104、0 CFU/mL。
1.2.2 注射感染
实验用鱼选用暂养一周后的健康梭鲈胸鳍基部腹腔注射,每组梯度菌液注射梭鲈10尾,每尾注射0.2 mL,各组实验鱼均分别隔离养殖于实验鱼池内,养殖环境温度为25~28 ℃,每隔4 h观察一次,并记录感染后的发病及死亡情况。对发病的梭鲈进行细菌再分离培养,以能够引起梭鲈发病死亡并能重新分离到原感染菌作为分离致病菌的判定标准。
1.3 细菌的形态观察及生理生化特性
将分离得到的纯培养菌进行涂片革兰氏染色,并镜检,同时纯培养菌株分别划线接种于LB、HBI、5%新生牛血清+HBI、血平板上等培养基,置28 ℃恒温培养36~48 h,观察生长情况;参照卢迈新等[14]的鉴定方法采用法国梅里埃自动生化鉴定仪及API 32 STEP快速自动生化鉴定条及其他微生物微量生化鉴定管进行细菌生理生化特性的测定,并根据测定结果对致病菌的种属进行判定。
1.4 细菌的分子鉴定
菌株经BHI液体培养基培养48 h后,5 000 r/min离心10 min,收集菌体,按Bacterial DNA Extraction Kit说明书提取细菌基因组DNA,以细菌16S rRNA通用引物进行PCR扩增反应,引物序列为:
上游引物F:5′-AGAGTTTGATCCTGGTCAGAACGAACGCT-3′,
下游引物R:5′-TACGGCTACCTTGTTACGACTTCACCCC-3。
反应程序为:94 ℃下预变性3 min;然后94 ℃下变性30 s,50 ℃退火30 s,72 ℃延伸90 s,共进行30个循环;最后72 ℃延伸10 min。PCR反应体系为:天根2×Taq PCRMastermix 25 μL,10 μmol/L浓度上游引物F 1 μL,10 μmol/L浓度下游引物R 1 μL,ddH2O 22 μL,DNA模板1 μL,总体系为50 μL,PCR产物进行电泳检测后送广州艾基生物技术有限公司进行测序。将分离菌的所测16S rRNA序列通过NCBI中的Blast工具进行序列比对及同源性分析,并从中选取同源性较高的序列,利用Cluster X5.0分析序列的同源性并利用邻接法(Neighbor-Joining)构建系统进化树。
1.5 分离菌株的血清型及MLST分型测定
病原菌的分子血清型检测参考Poyart等[15]方法,采用特异性分型引物,以分离菌株的基因组DNA为模板进行扩增,回收PCR产物后进行测序分析,根据测序结果通过NCBI中的Blast工具进行序列比对,获得分离菌株的血清型。
分离菌株的多位点序列分型(MLST)参考Jones等[16]方法,分别对adhP、pheS、atr、glnA、sdn、glcK、tkt七个基因特异性片段进行PCR扩增,片段长度为459~519 bp,扩增引物均引自MLST分型网站http://pubmlst.org/,扩增产物进行回收测序,然后将相应序列上传网站得到唯一等位基因数值序列,再将该数值序列上传致网站,获得分离菌株的ST序列分型。
1.6 病原菌的耐药性实验
采用常规的琼脂扩散(纸片)法对经过鉴定的菌株进行30种常用抗生素的耐药性检测。药敏片购自杭州天和微生物有限公司,于28 ℃恒温培养36~48 h后进行观察,并记录实验结果,根据抑菌圈的大小对病原菌的耐药性进行判定。
2 结果
2.1 病原菌形态观察及培养特性
血平板上,病原菌菌落为圆形,表面光滑,边缘整齐,中央隆起状,半透明,微呈乳白色,γ溶血,培养36~48 h菌落直径多在1 mm以内。 BHI培养基上,病原菌菌落为圆形,乳白色,表面光滑,边缘整齐,半透明,培养36~48 h菌落直径1 mm左右。革兰氏染色显示,被检细菌为革兰氏阳性,球状,多以链状形式存在。在营养肉汤液体培养基中28 ℃培养36~48 h不生长,在BHI液体培养基培养36~48 h可见浑浊。
2.2 对健康梭鲈的致病性及病原重分离
健康梭鲈人工感染分离菌株后,梭鲈感染不同浓度梯度的菌液发病及死亡程度不同, 4.5×108、4.5×107、4.5×106CFU/mL均出现急性死亡,2 d后就出现死亡现象,4 d内接近100%死亡;4.5×105、4.5×104CFU/mL浓度死亡率明显降低,全部实验鱼7 d后基本可稳定,未再发生死亡现象;对照组梭鲈在实验期内均健康存活,未见异常。感染死亡状况见表1。死亡梭鲈均可复制出自然发病症状,取死亡梭鲈进行病原分离,革兰氏染色镜检,并做生理生化特性鉴定,结果发现分离得到的感染菌在外部形态、生理生化特性与初始分离得到的感染菌完全一致。
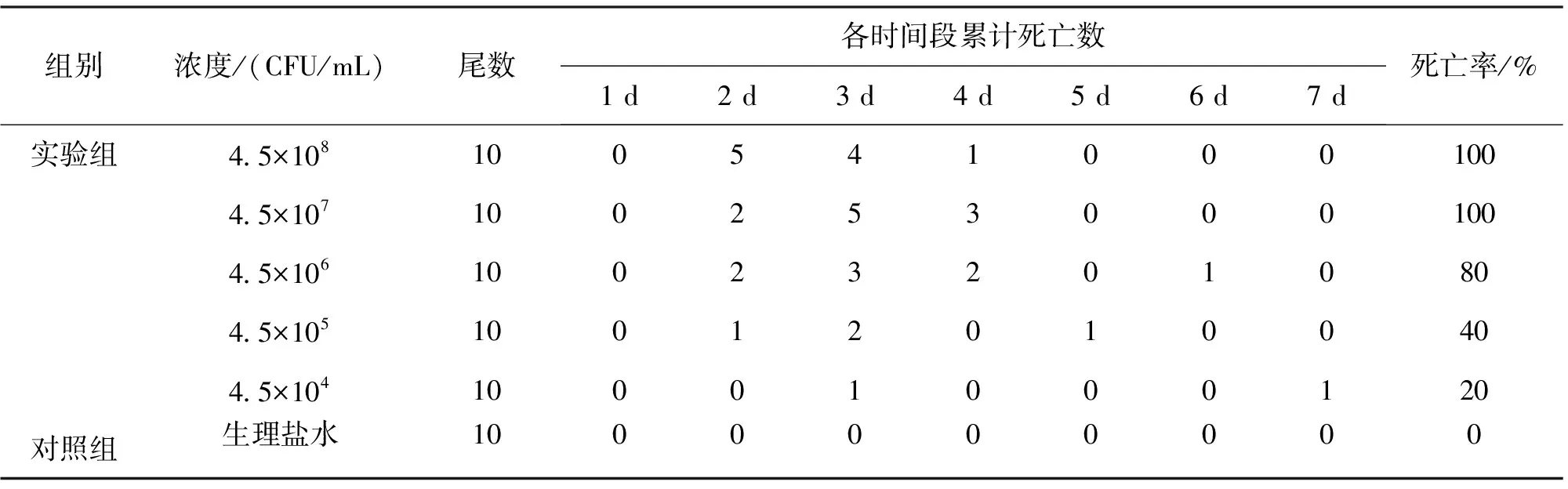
表1 分离菌株梭鲈感染结果Tab.1 Artificial infection results of the isolated strains
2.3 病原菌生理生化特性
分离菌株ID32 Strep检验结果与常见的β溶血无乳链球菌有5项不同或有疑问,根据生化鉴定结果及机器判读,所分离到的菌株初步判定为无乳链球菌Steptococcusagalactiae(表2)。核糖发酵等部分结果与张德峰等[17]和Evans等[18]已报道的γ溶血无乳链球菌生化鉴定结果也存在差异,因此该菌株的种属鉴定还需要利用分子生物学的方法进一步验证。

表2 ID 32 Strep 生理生化鉴定结果Tab.2 Physiological and biochemical identification results for isolated strains by ID 32 Strep
注:+:阳性,-:阴性,-/+:结果不确定。
2.4 16S rRNA基因同源性分析
分离菌株PCR扩增16S rRNA基因得到一长度为1 500 bp的核酸序列,与预期目的条带大小一致,将所得核酸片段进行测序后,将所得序列通过NCBI上BLAST工具进行序列比对,结果显示,分离菌株与无乳链球菌Streptococcusagalactiae的16S rRNA基因高度同源,同源性达99%~100%,与停乳链球菌S.dysgalactiae同源性96%~98%,与海豚链球菌S.iniae的同源性为96%~98%,所测序列与GenBank中已知已登录的其他链球菌16S rRNA同源序列进行匹配,构建系统进化树(图1),结果表明分离菌株SL1701序列与无乳链球菌聚为一枝,其他海豚链球菌S.iniae、停乳链球菌S.dysgalactiae等各聚为一枝。

图1 根据无乳链球菌等的16S rRNA基因构建的系统进化树Fig.1 Phylogenetic tree based on 16S r RNA gene of S.agalactia and other bacterial strains
2.5 分离菌株的分子血清型及MLST分型
按照Poyart等[15]方法,分离菌株基因组DNA利用Ib引物扩增出了一条770 bp左右大小条带,表明SL1701菌株分子血清型为Ib型。

表3 分离菌株药物敏感性实验结果Tab.3 The antibiotic sensitivity test of the isolates
注:S:敏感,I:中度敏感,R:耐药。
分离菌株SL1701的7个管家基因测序结果MLST分析表明,adhP、pheS、atr、glnA、sdnA、glcK、tkt 7个等位基因的等位基因类型的赋值分别为54、17、31、4、26、25、19,根据此数值序列得到的分离菌株MLST分型为ST261型。
2.6 药敏实验
用30种抗生素对致病菌株进行了药敏实验,实验表明:分离菌株对供试的氟苯尼考、氟罗沙星、磺胺异恶唑等17种药物敏感,对强力霉素、阿奇霉素等5种药物中度敏感,对氨苄青霉素、四环素、复达欣等8种药物不敏感(表3)。
3 讨论
本研究是我国发现并报道的第一例梭鲈细菌性病害,也是我国第一例无乳链球菌感染冷水鱼类的报道。在我国南方无乳链球菌感染多发生在罗非鱼,大多数发病罗非鱼类表现症状为游动异常,单侧或双侧眼球突出,角膜发白浑浊虹膜充血,体表不同程度充血、出血,剖检后腹内多有黄色腹水,胆囊肿大,脑膜充血等症状[19]。而本次分离得到的病原菌仅表现出眼球凸出,虹膜充血,脾脏肿大的症状,未见其他体表及内脏异常,发病梭鲈只是游动缓慢,未发现狂游、打转等异常现象。之所以与罗非鱼症状不同可能是以下两个方面的原因:一是发病鱼池最高水温在25 ℃左右,罗非鱼一般在30 ℃以上才会出现大面积发病感染,25 ℃以下罗非鱼养殖鲜有无乳链球菌感染发病的报道,温度是无乳链球菌致病能力的一个重要因素,刘志刚等[7]研究表明,温度在25~37 ℃时,无乳链球菌的生长速度、粘附能力、入侵和转运能力、致病能力均与温度呈正相关,37 ℃为无乳链球菌最适生长温度,因此在相对低温环境下发病机制可能也有所不同。二是不同血清型无乳链球菌致病机制可能也不完全相同,我国南方罗非鱼无乳链球菌感染主要集中于Ia血清型,仅有少数Ib型感染报道。
本研究所分离病原菌溶血活性测定结果为γ溶血,而国内所分离无乳链球菌绝大多数为β溶血[20-22],目前国内仅有3次报道γ溶血型无乳链球菌[15,23-24],本研究所分离的菌株SL1701血清型为Ib-ST271,与张德峰等[17]分离得到的无乳链球菌WT1451血清型相同,但WT1451株为强致病性毒株,致病菌的浓度为4.5×103CFU/mL 时,死亡率为85%,而SL1701菌株的浓度为4.5×104CFU/mL 时,死亡率仅为20%,毒力明显低于张德峰等研究结果,这可能由于回归感染实验温度不同所致。本研究生理生化鉴定实验结果与β溶血无乳链球菌具有一定差异,主要表现为核糖、海藻糖、VP实验等生化项目呈阴性,而β溶血无乳链球菌这些项目均呈阳性,但与张德峰、黎娅等[17,23]研究结果相比除VP项目外,其他生化项目均相符,本研究病原VP反应阴性,张德峰等结果为阳性,黎娅等结果为阴性,这也再次证明了γ溶血与β溶血的无乳链球菌具有不同的生化反应谱。Rosinski-Chupin等[25]研究表明γ溶血型无乳链球菌的碳源运输系统和降解多糖相关酶等基因出现缺失或失活,导致其丧失不同碳源的利用能力,这一定程度上也解释了为何γ溶血无乳链球菌生理生化实验中过多碳源反应为阴性的原因。
目前,当细菌性疾病暴发时,化药经常是重要治疗手段,但由于水产养殖业大量化药的使用,造成了病原菌出现不同程度的耐药性,本研究所分离无乳链球菌因为γ溶血,国内鲜有报道该类型菌株的耐药实验,本研究分离菌株与国内分离的β溶血链球菌相比,耐药性具有一定的差异,如2008年张新燕等[13]从广东分离的无乳链球菌及2012年周清等[26]从海南分离的无乳链球菌均对青霉素敏感,而本研究所分离病原对青霉素极度耐受,不形成任何抑菌圈;霍欢欢等[27]对2010—2011年从海南省各地分离的24株菌株进行耐药性研究,结果表明所分离无乳链球菌对氨基糖苷类(庆大霉素、链霉素、新霉素等)敏感性不高,但本研究病原菌对这些药物较为敏感。之所以出现上述现象可能跟菌种差异和菌株地域来源不同有关。在实际用药时应结合耐药实验,针对性的施用有效药物,用于治疗及预防该细菌性疾病的发生,同时应避免滥用、过量施用鱼药,导致加速微生物耐药变异、药物残留等副作用的发生。
参考文献:
[1]陈嘉毅,叶元土,张伟涛.不同脂肪(能量)蛋白比饲料对梭鲈幼鱼生长的影响[J].水产学报,2010,34(3):474-479.
[2]Pier G B,Madin S H.Streptococcusinaesp.nov.,abeta-hemolyticStreptococcusisolated from an Amazon Freshwater Dolphin[J].Inia geoffrensis.inia .Int J Syst Bacteriol,1976,(26):545-553.
[3]Pereira U P,Rpdrigues D S A,Hassan S S,et al.Complete genome sequence ofStreptococcusagalactiaestrain SA 20-06,a fish pathogen associated to meningoencephalitis outbreaks[J].Stand Genomic Sci,2013,8(2):188-197.
[4]Jafar Q A,Sameer A Z,Salwa A M,et al.Molecular investigation ofStreptococcusagalactiaeisolates from environmental samples and fish specimens during a massive fish kill in Kuwait Bay[J].Pak J BiolSci,2008,11(21):2500-2540.
[5]Suwannasang A,Suanyuk N,Tantikitti C.Phenotypic and genotypic characterization ofStreptococcusagalactiaeisolates from cultured tilapia in Thailand[J].Fish & Shell Fish Immunology,2013,34(6):1741.
[6]Amal M N,Zamri-Saad M,Iftikhar A R,et al.An outbreak ofStreptococcusagalactiaeinfection in cagecultured golden pompano,Trachinotusblochii(Lacepede),in Malaysia[J].J Fish Dis,2012,35(11):849-852.
[7]刘志刚, 可小丽, 卢迈新,等.温度对尼罗罗非鱼无乳链球菌毒力的影响[J].水产学报,2013,37(11):1733-1741.
[8]Geng Y,Wang K Y,Huang X L,et al.Streptococcusagalactiae,an emerging pathogen for culturedYa-fish,Schizo-thorax prenanti,in China[J].Transbound Emerg Dis,2012,59:369-375.
[9]Liu L,Li Y W,He R Z,et al.Outbreak ofStreptococcusagalactiaeinfection in barcoo grunter,Scortumbarcoo (McCulloch & Waite),in an intensive fish farm in China[J].J Fish Dis,2014,37:1067-1072.
[10]黄 婷,李莉萍,王 瑞,等.卵形鲳鲹感染无乳链球菌与海豚链球菌的研究[J].大连海洋大学学报,2014,29(2):161-166.
[11]杭小英,周冬仁,叶雪平,等.牛蛙无乳链球菌病病原的分离鉴定[J].水生生物学报,2012,36(2):361-364.
[12]黄木珍,黎 炯,潘忠超,等.宝石鲈无乳链球菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2014,41(10):247-251.
[13]张新艳,樊海平,钟全福,等.罗非鱼无乳链球菌的分离、鉴定及致病性研究[J].水产学报,2008,32(5):772-779.
[14]卢迈新,黎 炯,叶 星,等.我国罗非鱼源新型无乳链球菌的分离、鉴定极其分子特征[J].水产科学,2015,22(5):1044-1054.
[15]Poyart C,Tazi A,Réglier-Poupet H,et al.Multiplex PCR assay for rapid and accurate capsular typing of group B streptococci[J].J Clin Microbiol,2007,45(6):1985-1988.
[16]Jones N,Bohnsack J F,Takahashi S,et al.Multilocus sequence typing system for group B streptococcus[J].J Clin Microbiol,2003,41(6):2530-2536.
[17]张德峰,刘礼辉,任 燕,等.我国罗非鱼源新型无乳链球菌的分离、鉴定及其分子特征[J].水产科学,2015,22(5):1044-1054.
[18]Evans J J,Bohnsack J F,Klesius P H,et al.Phylogenetic relationships among Streptococcus agalactiae isolated from piscine,dolphin,bovine and human sources:a dolphin and piscine lineage associated with a fish epidemic in Kuwait is also associated with human neonatal infections in Japan[J].J Med Microbiol,2008,57:1369-1376.
[19]邓永强,汪开毓.鱼类无乳链球菌病的研究进展[J].中国畜牧兽医,2016,43(9)2490-2495.
[20]郭玉娟,张德锋,樊海平,等.中国南方地区罗非鱼无乳链球菌的分子流行病学研究[J].水产学报,2012,36(3):399-406.
[21]Ye X,Li J,Lu M,et al.Identification and molecular typing ofStreptococcusagalactiaeisolated from pond-culturedti-lapia in China[J].Fish Sci,2011,77:623-632.
[22] Zhang D,Li A,Guo Y,et al.Molecular characterization ofStreptococcusagalactiaein diseased farmed tilapia in China[J].Aquaculture,2013,412-413:64-69.
[23]黎 娅,罗福广,左 跃,等.罗非鱼源 γ 溶血性无乳链球菌的分离鉴定[J].淡水渔业,2014,44(4):63-76.
[24]刘理辉,张德峰,李宁求,等.鲮鱼源无乳链球菌的鉴定、血清型分析及药敏实验[J].南方农业学报,2015,46(11):2053-2058.
[25]Rosinski-Chupin I,Sauvage E,Mairey B,et al.Reductive evolution inStreptococcusagalactiaeand the emergence of a host adapted lineage[J].BMC Genom,2013,14:252.
[26]周 清,沈锦玉,徐 洋,等.海南罗非鱼无乳链球菌分离鉴定及其特性研究[J].生物学杂志,2012,29(2):27-30.
[27]霍欢欢,可小丽,卢迈新,等.海南罗非鱼无乳链球菌血清型及耐药性研究[J].中国预防兽医学报,2013,35(5):350-354.
