MOG抗体相关性视神经炎合并脑膜炎1例报告☆
2018-05-16曾文双肖海兵蔡继福涂柳褚晓凡
曾文双 肖海兵 蔡继福 涂柳褚晓凡
特近年来关于髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体相关性炎性脱髓鞘疾病 (MOG antibody associated inflammatory demyelinating disorders,MOG-IDDs)的报道越来越多。MOG-IDDs临床表现形式多样,可以表现为水通道蛋白4(aquaporin-4,AQP4)抗体阴性的视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)、急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)、 视神经炎(optic neuritis,ON)或长节段横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM),但合并急性脑膜炎的病例相对少见,早期容易误诊为中枢神经系统感染。本文就一例MOG抗体相关性ON(MOG-ON)合并急性脑膜炎患者的诊治经过予以报导,同时探讨其临床特点及可能的发病机制,为今后更好地诊断和治疗该类疾病提供借鉴。
1 临床资料
患者男性,24岁,因“发热头痛14 d,右眼视力下降11 d”入院。入院前14 d出现发热、头痛,3 d后出现右眼胀痛伴视力下降,其间曾服用口服抗生素(具体不详),上述症状无改善,1周后至当地医院神经内科住院治疗。神经系统查体发现颈强,腰穿脑脊液(cerebrospinal fluid,CSF)检查:压力、白细胞、蛋白显著升高(具体见表1)。该院初步诊断:急性感染性脑膜炎,予抗细菌 (左氧氟沙星+特治星)、抗病毒(阿昔洛韦)治疗,2 d后加用“异烟肼(H)、利福平(R)、吡嗪酰胺(Z)”口服抗结核治疗。其间曾有几天发热、头痛症状缓解,但治疗6 d后发热、头痛再发加重,遂转至我院治疗。患者入院前40余天曾出现左眼视力下降,在某眼科诊所就诊,未获充分诊治,后自觉视力有轻度改善。
体格检查:体温 38.8℃,颈强,Bruzinski’s征(+),余内科及神经系统查体无明显阳性发现。辅助检查:腰穿CSF检查:压力 280 mmH2O,清亮透明,白细胞计数 112×109/L(参考范围 1~5×109/L),淋巴细胞比率 72%,蛋白 882 mg/L(参考范围 120~600 mg/L),葡萄糖 2.1 mmol/L(参考范围2.2~3.9 mmol/L),氯化物 116 mmol/L(参考范围 120~130 mmol/L);眼科检查:视力右 0.08/左 0.01,右视盘水肿,左视盘萎缩;其它阴性的辅助检查有:血及CSF细菌、真菌涂片及培养,血及CSF隐球菌抗原,血及CSF单纯疱疹病毒、带状疱疹病毒、巨细胞病毒DNA,血及CSF结核DNA,HIV、梅毒血清学。
诊疗过程:结合患者症状、体征及脑脊液特点,初步诊断考虑急性感染性脑膜炎(累及右侧视神经),因其入院前接受过抗细菌、抗病毒、抗结核治疗,可能对入院后的病原学结果造成影响,导致病原学诊断困难,遂予头孢曲松+万古霉素抗细菌(疗程2周),继续予H+R+Z方案抗结核,同时加用地塞米松20 mg静脉滴注每天1次,减轻鞘内炎症反应。治疗3 d后头痛缓解,体温降至正常。1周后右眼视力显著改善,颅脑MRI平扫及增强未见明显异常(具体见图1)。此后激素剂量每周减半。入院11 d后复查腰穿CSF检查:压力 160 mmH2O,清亮透明,白细胞计数 82×109/L,淋巴细胞比率 80%,蛋白739 mg/L,氯化物 121 mmol/L。2周后眼科复查视力,右眼由0.08升至0.7,左眼由0.01升至0.05;视觉诱发电位提示双侧潜伏期延长,左侧为著;视神经光学相干断层扫描 (optical coherence tomography,OCT)提示双眼视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度变薄,以左侧为著(具体见图 2);血 AQP4及MOG抗体结果尚未回复。无其他症状体征,因结核性脑膜炎诊断尚不能完全除外,遂于治疗后2周带口服药“H+R+Z抗结核、地塞米松5 mg口服 每天1次”出院。出院后相关抗体结果回报:血AQP4抗体(-)、MOG抗体(++1:32)。结合患者发病前1月余有左眼视力下降,本次发热、头痛数天后再出现右眼视神经炎的病史特点及激素治疗反应,最终诊断:复发性MOG抗体相关性视神经炎。
门诊随访:停用口服抗结核药物,考虑患者视神经炎已进入恢复期,但仍存在较高的复发风险,建议其接受长期免疫抑制治疗(激素+硫唑嘌呤)。
2 讨论
MOG是免疫球蛋白超家族的成员,也是髓鞘的组成部分,通常在髓鞘表面和少突胶质细胞胞膜外表达[1]。近年来通过基于细胞的免疫荧光检测 (cell based assay,CBA)已经证实MOG在中枢神经系统脱髓鞘中的作用,但是目前关于其具体致病机制的文献并不多。有限的临床和动物实验的结果表明,MOG抗体可以激活NK细胞和补体系统,通过抗体和补体介导的细胞毒效应对髓鞘和少突胶质细胞造成损伤[2-3]。
MOG-IDDs目前尚缺乏统一的诊断标准,其临床表现与其他类型的IDDs也存在一定的重叠,但更多地表现为复发性ON或LETM,其中又以ON最为常见,有多达75%的病例以ON为首发表现,有83.8%的患者在病程中有ON发作。MOG抗体相关性ON在临床上主要表现为双眼同时或快速贯序受累,可出现球后疼痛或转眼时疼痛,急性期视力受损严重,表现为视力下降、视野缩小、视盘水肿。视神经磁共振可见长节段的视神经损害,钆增强后显像与AQP4抗体阳性ON不同,主要表现为:以视神经前部强化为主,视交叉和视束较少出现强化;视神经鞘及周围脂肪组织强化更为常见,视神经中轴强化相对少见[4-5]。如急性期及时予以激素治疗,视力往往可以得到较好地恢复,但仍有部分病人会遗留显著的视力受损,视觉诱发电位(visual evoked potential,VEP)提示受累侧潜伏期延长、波幅降低,OCT可出现受累眼RNFL广泛变薄[6]。
本例患者符合MOG-ON的典型特征:临床上表现为双眼快速贯序受累,急性期视力下降伴眼痛,第一次错过激素治疗,遗留左眼严重功能残疾,第二次得到及时激素治疗后,右眼视力基本恢复;发病时血MOG抗体滴度显著增高;VEP、OCT提示以左侧为著的视神经受损及RNFL广泛变薄。唯一遗憾的是,其颅脑MRI并未发现显著的视神经鞘及周围脂肪组织强化,考虑与接受检查前已使用激素、炎症反应明显减轻有关。值得注意的是,此例患者在病程中有显著发热、头痛、颈强、颅内压增高、脑脊液炎性改变等急性脑膜炎表现,这与近期周磊等报道部分MOGIDDs患者急性期可出现颅内压升高(18.2%)、CSF蛋白增高(54.5%)、白细胞增多(36.4%)及前驱发热、头痛症状相符[7]。我们推测,急性脑膜炎可能是MOG-IDDs疾病本身的表现,亦可能是该病在发作前的前驱感染症状。但目前上述两种推测仍然存在争议:动物试验提示,MOG可以在CD28缺乏的C57BL/6小鼠身上诱导出无菌性脑膜炎表现[7],这提示无菌性脑膜炎可以是MOG-IDDs的直接表现;然而也有文献提出,前驱病毒感染可以通过活化淋巴细胞、破坏血脑屏障促发儿童MOG抗体相关性ADEM的发生[6,8],这提示急性脑膜炎也可以是前驱病毒感染的表现,但成人MOG-IDDs是否存在类似机制尚未见报道。
综上,我们认为,在患者出现显著的脑膜炎且合并视神经炎表现时,一定要在鉴别诊断中纳入MOG-ON,而不应仅仅将思维局限于感染所继发的视神经损害,从而避免延误患者的免疫治疗,改善其神经功能预后。
图1 颅脑磁共振增强未见显著的脑膜及视神经鞘强化表现
入院后一周颅脑磁共振增强未见显著的脑膜及视神经鞘强化表现。
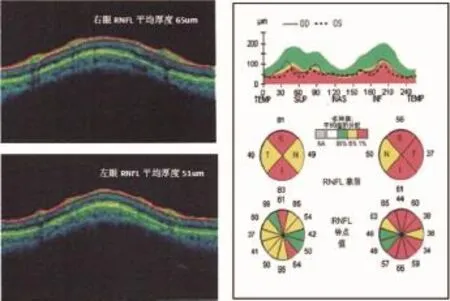
图2 视神经光学相干断层扫描(OCT)
入院后第二周OCT提示双侧视网膜神经纤维层(RNFL)平均厚度变薄,以左侧视网膜上下象限为著。
[1] RAMANATHAN S,DALE RC,BRILOT F.Anti-MOG antibody:The history,clinical phenotype,and pathogenicity of a serum biomarker for demyelination [J].Autoimmun Rev,2016,15(4):307-324.
[2] MADER S,GREDLER V,SCHANDA K,et al.Complement activating antibodies to myelin oligodendrocyte glycoprotein in neuromyelitis optica and related disorders[J].Neuroinflammation,2011,8:184.
[3] DALE RC,TANTSIS E,MERHEB V,et al.Antibodies to MOG have a demyelination phenotype and affect oligodendrocyte cytoskeleton[J].Neurol Neuroimmunol Neuroinflamm,2014,1(1):e12.
[4] JARIUS S,RUPRECHT K,KLEITER I,et al.MOG-IgG in NMO and related disorders:a multicenter study of 50 patients.Part 2:epidemiology,clinical presentation,radiological and laboratory features,treatment responses,and long-term outcome[J].Neuroinflammation,2016,13(1):280.
[5] ZHOU L,HUANG Y,LI H,et al.MOG-antibody associated demyelinating disease of the CNS:A clinical and pathological study in Chinese Han patients[J].J Neuroimmunol,2017,305:19-28.
[6] RAMANATHAN S,REDDEL SW,HENDERSON A,et al.Antibodies to myelin oligodendrocyte glycoprotein in bilateral and recurrent optic neuritis[J].Neurol neuroimmunol neuroinflamm,2014,1(4):e40.
[7] PERRIN PJ,LAVI E,RUMBLEY CA,et al.Experimental autoimmune meningitis:a novel neurological disease in CD28-deficient mice[J].Clin immunol,1999,91(1):41-49.
[8] REINDL M,DI PAULI F,ROSTáSY K,et al.The spectrum of MOG autoantibody associated demyelinating diseases [J].Nat Rev Neurol,2013,9(8):455-461.
