赣江南昌段水体尿素时空分布及其来源
2018-05-15李泽兵徐泸峰王宏青朱文麒张永运张忠义郑能建肖红伟
罗 笠, 李泽兵, 徐泸峰, 王宏青, 朱文麒, 张永运,张忠义, 郑能建, 肖红伟
(1. 东华理工大学江西省大气污染成因与控制重点实验室,江西 南昌 330013; 2. 东华理工大学水资源与环境工程学院,江西 南昌 330013 )
尿素是氮含量最高的氮肥,广泛应用于农业生产。统计数据显示,全球尿素氮肥的使用量占总氮肥使用的50%以上(Glibert et al, 2006)。我国2014年尿素生产总量为8 100万吨,其中农业尿素氮肥的使用量高达4 320万吨(王红润,2015)。农业氮肥的大量使用,不可避免的会导致农业生产期区域地表水水体中尿素浓度升高(Glibert et al, 2006)。尿素也是哺乳动物通过尿液排泄体内多余氮素的主要路径(王镜岩等, 2002)。例如,在人口密集的地表水中,尿素浓度远远高于自然水体(胡章喜等, 2008)。
尿素含有两个可直接参与合成氨基酸的氨基(-NH2)和一个可参与光合作用的羰基(-C=O);因此,天然水体中尿素易被各种浮游植物(胡章喜等, 2010; Bogard et al., 2012)和微生物(Alonso et al., 2012; Lu et al., 2013)吸收利用,尿素还易被脲酶水解生成铵盐(Bogard et al., 2012)。天然水体中尿素的周转时间较快,一般为几分钟至几天(Belisle et al., 2016)。前人研究显示,尿素对湖泊和海洋近岸水体的富营养化有重要的贡献(Belisle et al., 2016;Li et al., 2010),尤其在富磷的水体中,尿素浓度的升高可引起水体毒性蓝藻的爆发,导致水质恶化(Finlay et al., 2010)。赣江枯水期和丰水期总磷平均浓度分别为40 μg/L和20 μg/L(王毛兰等,2007a;王鹏等,2015),该浓度已达到可引发水体富营养化的水平(胡春华等,2010)。因此,尿素可能是研究赣江水体水质安全的一个重要指标。
赣江是江西省鄱阳湖最大的支流,起源于闽赣边界武夷山,经赣州、吉安和宜春地区后流入南昌市,然后分三个支流(赣江北支,赣江中支和赣江南支)年均输送约687亿立方米的水汇入鄱阳湖。赣江水体水质安全关系到赣江流域农业生产和生活用水安全而备受关注。以往对赣江水体的研究主要集中在无机氮磷的时空分布(陈多多等,2014;王毛兰等,2007b)、藻类和致病菌等的群落结构(刘足根等,2012;王鹏等,2016)、重金属(石先罗等,2017)和无机碳(赖冬蓉等,2012)等相关研究,但是对赣江水体中尿素浓度的观测研究未见报道。本研究分别于赣江枯水期和丰水期对赣江南昌段水体中浓度进行分析,探究赣江南昌段水体中尿素的时空分布特征和来源,为赣江南昌段水体水质安全保障提供科学参考。
1 样品采集与分析
1.1 赣江水样采集
2017年1月至2月和6月至7月对赣江南昌段上游市汊(丰城市同田乡新下洲村)、锦江(锦江大桥)、赣江南昌段中游外洲(国家赣江外洲水文观测站)、赣江南昌段下游赣江北支(丰乐大桥)、赣江中支(楼前大桥)和赣江南支(滁北大桥)6个采样点(图1)共计四次采样,其中外洲站每周采样一次,共计8次。采集的水样现场通过0.22 μm Millpore针筒过滤器过滤,锡箔纸包裹的泡酸清洗干净的离心管中,避光冷藏保存回实验室,-20 ℃保存直至分析。
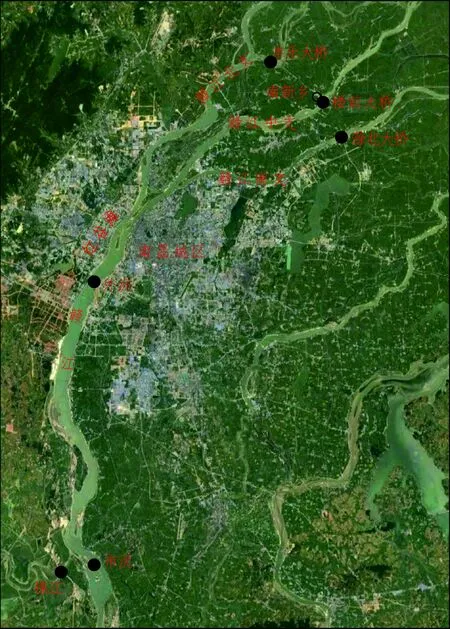
图1 采样点位置Fig.1 Sampling location
1.2 特征源水样采集
本研究采集了6种不同特征来源的水样,分别为:人体尿液(n = 7),收集于不同的成年人,实验室静置两周后稀释50倍测尿素浓度;养猪场废水(n = 5),采集于2个不同养猪场的排污水,回实验室静置四周后 0.22 μm Millpore针筒过滤器过滤并稀释10倍后测尿素浓度;城市污水(n = 4)采集于城区典型的“臭水沟”,现场0.22 μm Millpore针筒过滤器过滤,避光冷藏保存回实验室,-20 ℃保存直至分析;水稻田水样分2次采集,其中水稻田1水样采集于秧苗移栽一周内(n = 11),水稻田2水样采集于秧苗移栽1月后(n = 3);农村池塘(n = 5)和地下水(n = 20)分别于7月底和8月初采集于赣江南昌段上游丰城市隍城镇农村天然池塘和农户家井水。
1.3 尿素浓度分析方法
尿素浓度用二乙酰一肟硫氨脲分光光度法测定。二乙酰一肟分光光度法广泛用于分析海水(Chen et al., 2015),湖水(韩晓霞等,2014,2015),河水(石晓勇等,2015),游泳池(赵锐等2016)以及食物(陈宜宜等,1996)中尿素的浓度。但是由于不同水样中尿素浓度的差异较大且不同水样理化特征的差异性等因素,导致用二乙酰一肟硫氨脲分光光度法分析不同水样尿素浓度的过程中显色反应对化学试剂的用量和化学反应的条件不一致(罗笠等,2017)。例如,Chen等(2015)对海水中尿素浓度测定方法的条件实验发现,二乙酰一肟浓度范围在1 500~2 500 mg/L,硫氨脲浓度范围在30~70 mg/L,硫酸铁浓度范围在2~4 mg/L,硫酸浓度在体积比15%~25%之间,温度在95 ℃,反应时间为20~25 min,溶液的吸光值最大;相开幕等(2005)对游泳池水体中尿素浓度测试认为,二乙酰一肟浓度范围在1 500~3 500 mg/L,硫氨脲浓度范围在500~1 500 mg/L,煮沸反应10 min即可显色完成。本研究通过多次(n = 19)条件实验,认为当二乙酰一肟浓度为2 000 mg/L, 硫氨脲浓度为50 mg/L, 硫酸铁浓度为3 mg/L,硫酸浓度在体积比为20%,温度在85 ℃,反应时间为30 min,溶液的吸光值能达到最优,且能同时满足样品尿素浓度在0.2~10 μmol/L之间的水样。19次实验标准曲线结果如图2所示。

图2 尿素浓度与吸光值线性关系Fig.2 Linear relationship between the urea concentration and absorption
2 结果与讨论
2.1 赣江外洲站流量的季节变化
2017年赣江外洲站流量枯水期(1月至2月)和丰水期(6月至7月)(http://www.jxsl.gov.cn/)以及赣州市、吉安市、宜春市和南昌市多年(1971—2016)1月至2月和6月至7月月均降雨量(http://www.weather.com.cn/)(图3)。在枯水期,赣江外洲站流量差异不大,平均流量为(931±200)m3/s。在丰水期赣江外洲站流量变化较大,峰值出现在6月下旬和7月上旬,其中最高流量出现在6月30日,高达14 000 m3/s;最低流量出现在7月31日,仅有1 360 m3/s。丰水期赣江外洲站流量平均为(4 461±3 139)m3/s,比枯水期平均流量高近5倍。赣江外洲站流量的变化与赣江流域的降雨量呈正相关趋势,说明降雨是赣江水量变化的主要因素。

图3 枯水期和丰水期赣江外洲水文观测站流量(http://www.jxsl.gov.cn/)和1971—2016年赣州、吉安宜春和南昌月均雨量(http://www.weather.com.cn/)Fig.3 Water flow in the Waizhou hydrological observatory of Ganjiang, and the monthly precipitation in Ganzhou, Ji`an, Yichun and Nanchang from the 1971 to 2016
2.2 特征源水样尿素浓度

图4 不同来源水体中尿素的浓度Fig.4 Urea concentration in different sources of water
特征源水样中尿素浓度如图4所示。实验室静置两周后的人体尿液中尿素浓度(范围为365~876 μmol/L,平均为(474±182)μmol/L)明显低于前人报道的新鲜尿液中尿素浓度(范围为45 000~48 7000 μmol/L,蒋兴亮等,2003;胡荣盛等,2001;方卢秋等,2004)。实验室静置四周后养猪场废水中尿素含量(77.7±30.2)μmol/L也明显低于猪尿液中尿素浓度(董小君等,2011)。这些表明哺乳动物排泄了大量的尿素,同时也表明尿素在哺乳动物体外可快速的降解,但降解速率及其影响因子不详。依据人体尿液中尿素浓度、成年人每人每天的排尿量(约为1.5 L)以及南昌市2016年城镇人口289.5万人(南昌市统计局)计算,南昌市城镇生活废水中每天排入的尿素总量约为1 200 吨/天。如果这些尿素直接排入赣江,在磷浓度充足的赣江(王毛兰等,2007;王鹏等,2015),可能引起赣江南昌段水体水质的恶化。本研究城市污水沟水样中尿素平均浓度为(5.96±0.51)μmol/L,与胡章喜等(2008)报道的广州市区河流和人工湖水中尿素浓度相似。城市污水沟水样中尿素浓度高于农村天然池塘水体中尿素浓度(图4)说明城镇居民生活污水排放是城市污水沟中尿素的主要来源。水稻田1水样中尿素浓度比水稻田2水样高10倍(图4),说明了尿素在农田中易被快速降解。前人研究显示,农田尿素施肥48 h后,约80%的尿素会转化成铵态氮(李宗新等2008;张伟等,2008)。农村家用井水中尿素浓度最低,其中有16口井水尿素浓度低于检测限,4口井水中尿素浓度平均为(0.21±0.15)μmol/L,低于同一村庄天然池塘水体中尿素含量(1.11±0.53) μmol/L。天然池塘水体中尿素浓度与降雨中尿素浓度((0.98±0.87)μmol/L, Cornell et al.,1998, 2001,2003; Mace et al., 2003)相似,表明天然池塘水体中尿素可能来源于大气降雨。此外,池塘底泥释放的尿素也可能是池塘水体中尿素的源(Bogard et al., 2012)。
2.3 赣江南昌段尿素浓度的时空变化
本研究赣江南昌段水体中尿素浓度范围为(0.9±0.6)~(4.3±2.0)μmol/L,与国内外报道的河流水体中尿素浓度范围一致(表1)。锦江水体中尿素浓度在枯水期低于丰水期(表1和图5),表明锦江丰水期尿素来源不同于枯水期。锦江采样点的上游主要是农田和自然村落, 6月下旬和7上旬正值晚稻的播种时间,而2017年6月下旬和7月上旬是江西的集中降雨期(http://www.jxsl.gov.cn/),大量降雨会把农业施尿素肥带入锦江。在长江大同站(石晓勇等,2015)和Pocomoke River(Glibert et al., 2005)同样观测到丰水期水体中尿素浓度高于枯水期,这些作者认为农业施肥是河流水体中尿素的主要来源。而在珠江大沙站观测到丰水期水体中尿素浓度高于枯水期,胡章喜等(2008)认为城市生活污水的大量冲刷是导致珠江水体中尿素升高的原因。在枯水期,锦江流量小,其水体中尿素的可能来源于底泥的释放,也可能来源于上游乡镇的生活污水排放。
本研究赣江南昌段5个观测点枯水期尿素浓度都高于丰水期(图5),与前人在长江大同站以及美国Pocomoke River观测趋势不同,但是与美国的York River的趋势相似(表1)。前人研究认为,丰水期尿素浓度高于枯水期,主要与农业尿素施肥有关(石晓勇等,2015;Glibert et al., 2005)。赣江南昌段丰水期尿素浓度低于枯水期,与城镇生活污水排放、降雨量、赣江流量和农业季节性施肥等有关。赣江沿岸分布着许多的乡镇和城市,大量的生活污水或经污水处理厂处理后的水可能会直接排入赣江。城镇人口稳定,生活污水的排放量稳定,而枯水期赣江流量且仅为丰水期的1/5且流量变化不大(图3),这可能是导致赣江南昌段水体中尿素浓度在枯水期高于丰水期原因。此外,在枯水期,农业生产基本停止,地下水尿素浓度较低(图4),进一步表明赣江南昌段枯水期尿素主要来源于城市生活污水的排放。在丰水期,赣江南昌段水体中尿素浓度低于枯水期,表明丰水期赣江南昌段水体中尿素的来源于枯水期不同。丰水期赣江南昌段水体中尿素浓度范围(0.9±0.6)~(1.9±0.5) μmol/L(表1),高于降雨中尿素浓度(0.98±0.87) μmol/L(图4),表明降雨对赣江水体中尿素有一定的贡献。尽管丰水期是农业生产尿素施肥集中期,且城市污水可能随降雨汇入赣江;但丰水期流量明显高于枯水期(极端流量比枯水期高14倍),这可能稀释了农业源和城市源输入赣江的尿素。此外,丰水期温度较高,浮游植物和微生物活动较强,代谢尿素的速率增加(Bogard et al., 2012;Lu et al., 2013;Belisle et al., 2016),这也可能是导致赣江南昌段水体中丰水期尿素浓度低于枯水期。

表1 不同地区河流尿素浓度比较
无论是枯水期还是丰水期,从赣江南昌段上游的市汊采样点到中游的外洲站,赣江水体中尿素都浓度呈下降趋势;而从外洲站到赣江南昌段下游的赣江南支(滁北大桥)、赣江中支(楼前大桥)和赣江北支(丰乐大桥),赣江水体中尿素浓度都呈上升趋势,表明南昌市是赣江南昌段下游水体中尿素的来源。市汊采样点位于丰城市同田乡新下洲村,附近有大量的货运船和摆渡船停靠,因此市汊采样点高浓度的尿素可能与码头的人为活动有关。外洲是南昌市饮用水的取水点,是国家级水文站(曾冬林等,2015),根据《南昌市赣江饮用水水资源保护条例》,在取水点上游3000 m的水域和取水点一侧的滩地以及迎水面堤脚向背水面延伸100 m的陆域禁止排入污染物。这解释了外洲站低浓度尿素。

图5 赣江南昌段水体中尿素浓度的时空分布Fig.5 Spatial and temporal distribution of urea in Nanchang section of Ganjiang River
在赣江南昌段下游的赣江南支,赣江中支和赣江北支,水体中尿素浓度再次升高(图5)。赣江南支(滁北大桥),赣江中支(楼前大桥)和赣江北支(丰乐大桥)这三个采样点主要位于城乡结合带,城市生活污水的排放可能是这些点尿素浓度升高的主要因素。赣江中支(楼前大桥)枯水期尿素浓度高达(3.7±0.9)μmol/L,高于赣江南支(滁北大桥)和赣江北支(丰乐大桥)水体中尿素浓度(图5)。楼前大桥采样点紧邻南新乡,而丰乐大桥和滁北大桥采样点距离最近的乡镇也大于3 000 m,这解释了楼前大桥采样点水样中尿素浓度高于丰乐和滁北大桥采样点,进一步说明了生活污水的排放对赣江南昌段水中尿素的贡献较大。
3 结论
(1)锦江丰水期水体中尿素主要来源于农业肥料,枯水期来源不详。
(2)赣江南昌段下游水体中尿素主要来源于南昌市生活污水的排放。
参考文献
曾冬林,邓燕青.2015.长江流域江西省内国家重要饮用水水源地安全调查与评估[J].文摘版:自然科学,(5):39-39.
陈多多,吴敦银,王鹏,等.2014.赣江水体无机氮分布特征[J].安徽农业科学,11(11):3348-3351.
陈宜宜,张文悦,瞿素莲.1996.黄酒中尿素的测定[J].环境污染与防治,18(3):34-36.
董小君,丁斗,吴曙光,等.2011.顺铂致小型猪急性肾衰模型[J].实验动物科学,28(5):26-28.
方卢秋,杨季冬,李晓燕,等.2004.NBS-荧光素-CTAC流动注射化学发光体系测定尿素的含量[J].四川师范大学学报:自然科学版,27(3):288-291.
韩晓霞,朱广伟,李兆富,等.2015.天目湖沙河水库尿素含量及其时空分布特征分析[J].环境化学,34(2):377-383.
韩晓霞,朱广伟,许海,等.2014.太湖夏季水体中尿素的来源探析[J].环境科学,35(7):2547-2556.
胡春华,周文斌,王毛兰,等.2010.鄱阳湖氮磷营养盐变化特征及潜在性富营养化评价[J].湖泊科学,22(5):723-728.
胡荣盛,李全忠,胡家林,等.2001.脲酶结合邻甲酚酞络合剂显色检测血清及尿液尿素含量[J].现代检验医学杂志,16(1):17-18.
胡章喜,徐宁,段舜山,等.2010.尿素对中国近海3种典型赤潮藻生长的影响[J].环境科学学报,30(6):1265-1270.
胡章喜,徐宁,李爱芬,等.2008.广州地区淡水水体尿素的分布特征[J].生态科学,27(5):418-420.
蒋兴亮,唐中.2003.脲酶和亮氨酸脱氢酶偶联法动力学测定血清或尿液中尿素[J].临床检验杂志,21(2):90-92.
赖冬蓉,严兆彬,陈益平,等.2012.南昌市湖水可溶解无机碳与碳同位素特征及其影响因素分析[J].东华理工大学学报:自然科学版,35(2):143-148.
李宗新,董树亭,王空军.2008.不同施肥条件下玉米田土壤养分淋溶规律的原位研究[J].应用生态学报,19(1):67-72.
刘足根,张柱,张萌,等.2012.赣江流域浮游植物群落结构与功能类群划分[J].长江流域资源与环境,21(3):375-384.
罗笠,王宏青,肖红伟等.2017.湖泊水体尿素源汇研究进展[J].安徽农业科学,45(36):44-49.
南昌市统计局.2017.南昌市2016年国民经济和社会发展统计公报[R/OL].[2017-3-22].http://www.nctj.gov.cn/Content.aspx?ItemID=15968.
石先罗,章卫.2017.赣江南昌段沉积物重金属空间分布特征及风险评价[J].水利科技与经济,23(9):1-5.
石晓勇,张桂成,梁生康,等.2015.长江大通站溶解有机氮生物可利用性潜力及输入通量[J].中国环境科学,35(12):3698-3706.
王红润.2015.2014年中国尿素市场分析及前景展望[J].中国石油和化工经济分析,(10):54-56.
王镜岩,主圣庚,徐长法.2002.生物化学[M].第3版.北京:高等教育出版社:310-314.
王毛兰,周文斌,胡春华.2007a.枯水期赣江流域氮磷的分布特征[J].地球与环境,35(2):166-170.
王毛兰,周文斌,胡春华.2007b.赣江流域水体无机氮分布特征[J].南昌大学学报:理科版,31(3):271-275.
王鹏,陈波,李传琼,等.2016.赣江南昌段丰水期细菌群落特征[J].中国环境科学,36(8):2453-2462.
王鹏,陈多多,陈波.2015.赣江水体氮磷营养盐分布特征与污染来源[J].江西师范大学学报:自然版,(4):435-440.
相开幕,孙剑,才玉亮.2005.硫氨脲二乙酰一肟联合显色测定游泳池水中尿素[J].中国卫生检验杂志,15(8):945-945.
张伟,李鲁华,殷波.2008.膜下滴灌新疆棉田土壤盐分的运移规律[J].石河子大学学报:自然科学版,(6):28-31.
赵锐,贾予平,张屹,等.2016.北京市游泳池水中尿素检测结果分析[J].职业与健康,32(22):3115-3119.
Alonso-Saez L, Waller A S, Mende D R, et al. 2012. Role for urea in nitrification by polar marine Archaea [J]. Proceedings of the National Academy of Sciences of the United States of America, 109(44): 17989-17994.
Baer S E. 2013. Seasonal Nitrogen Uptake and Regeneration in the Water Column and Sea-Ice of the Western Coastal Arctic. PhD thesis[D]. Virginia Institute of Marine Science, College of William & Mary, Williamsburg, VA:187-187.
Belisle B S, Steffen M M, Pound H L, et al. 2016. Urea in Lake Erie: Organic nutrient sources as potentially important drivers of phytoplankton biomass[J]. Journal of Great Lakes Research, 42(3): 599-607.
Bogard M J, Donald D B, Finlay K, et al. 2012. Distribution and regulation of urea in lakes of central North America [J]. Freshwater Biology, 57(6): 1277-1292.
Chen L, Ma J, Huang Y, et al. 2015. Optimization of a colorimetric method to determine trace urea in seawater [J]. Limnology and Oceanography: Methods 13(6), 303-311.
Cornell S E, Jickells T D, Cape J N, et al. 2003. Organic nitrogen deposition on land and coastal environments: A review of methods and data[J]. Atmospheric Environment, 37(16):2173-2191.
Cornell S E, Jickells T D, Thornton C A. 1998. Urea in rainwater and atmospheric aerosol [J]. Atmospheric Environment, 32(11):1903-1910.
Cornell S E, Mace K A, Coeppicus S, et al. 2001. Organic nitrogen in Hawaiian rain and aerosol[J]. Journal of Geophysical Research Atmospheres, 106(D8):7973-7983.
Finlay K, Patoine A, Donald D B, et al. 2010. Experimental evidence that pollution with urea can degrade water quality in phosphorus-rich lakes of the Northern Great Plains [J]. Limnology and Oceanography, 55(3): 1213-1230.
Glibert P M, Trice T M, Michael B, et al. 2005. Urea in the Tributaries of the Chesapeake and Coastal Bays of Maryland [J]. Water Air & Soil Pollution, 160(1-4):229-243.
Glibert P M, Harrison J, Heil C, et al. 2006. Escalating Worldwide use of Urea - A Global Change Contributing to Coastal Eutrophication [J]. Biogeochemistry, 77(3): 441-463.
Li J, Glibert P M, Zhou M. 2010. Temporal and spatial variability in nitrogen uptake kinetics during harmful dinoflagellate blooms in the East China Sea[J]. Harmful Algae, 9(6): 531-539.
Lu L, Jia Z. 2013. Urease gene-containing Archaea dominate autotrophic ammonia oxidation in two acid soils [J]. Environmental microbiology, 15(6): 1795-1809.
Mace K A, Artaxo P, Duce R A. 2003. Water-soluble organic nirogen in Amazon Basin aerosols during the dry (biomass burning) and wet seasons [J]. Journal of Geophysical Research Atmospheres, 108(D6):1253-1265.
