血清QSOX-1、GSN、AFP联合检测对原发性肝癌的诊断价值
2018-05-15宋晓婷国娇谭顺顺黄天壬何雨张春燕
宋晓婷,国娇,谭顺顺,黄天壬,何雨,张春燕
(1 广西医科大学附属肿瘤医院,南宁530021;2 柳州市人民医院;3 广西医科大学第一附属医院)
目前临床对原发性肝癌的早期筛查主要通过检测血清肿瘤标志物。甲胎蛋白(AFP)是最经典的血清肿瘤标志物之一,但其诊断原发性肝癌的敏感性为60%左右,且特异性有限[1]。因此,寻找敏感、特异的原发性肝癌血清肿瘤标志物一直是近年研究热点。本课题组前期应用同位素标记相对和绝对定量、液相色谱串联质谱等蛋白质组学技术,对广西壮族自治区原发性肝癌高发地区的高危人群进行动态定量差异蛋白质组学分析,筛选出了两种差异性蛋白,即巯基氧化酶1(QSOX-1)、凝溶胶蛋白(GSN)[2]。后续研究在蛋白水平上对QSOX-1、GSN作为诊断原发性肝癌的分子生物标志物进行验证,初步认定QSOX-1、GSN对原发性肝癌的诊断具有潜在价值[3]。本研究探讨血清QSOX-1、GSN、AFP联合检测对原发性肝癌的诊断价值。
1 资料与方法
1.1 临床资料 选择2015年10月~2016年1月广西医科大学附属肿瘤医院收治的原发性肝癌患者60例(肝癌组),均符合《原发性肝癌诊疗规范》(2011年版)中的诊断标准,入院前未行任何抗肿瘤治疗,并排除活动性肝病、妊娠、生殖系胚胎源性肿瘤及转移性肝癌。其中,男41例、女19例,年龄31~74(51.23±10.00)岁。同期选择广西医科大学附属肿瘤医院收治的乙肝、肝硬化、肝脓肿等其他肝病患者60例(肝病组),均根据临床表现及实验室检查、影像学检查等明确诊断,并排除肝脏恶性肿瘤。其中,男43例、女17例,年龄33~77(48.60±9.42)岁,疾病类型:乙肝20例、肝硬化20例、肝脓肿10例、肝吸虫病10例。同期另选在广西医科大学附属肿瘤医院体检的健康志愿者60例(对照组),男36例、女24例,年龄30~75(48.40±12.14)岁。三组性别、年龄具有可比性。本研究经广西医科大学附属肿瘤医院医学伦理委员会批准,患者或其家属知情同意。
1.2 血清QSOX-1、GSN、AFP检测 所有研究对象入组次日采集清晨空腹外周静脉血5 mL,静置2 h,1 000×g离心15 min,留取血清,-80 ℃冰箱保存。采用Multiskan MK3型酶标仪、ELISA法检测血清QSOX-1、GSN,采用罗氏Cobas e601型全自动免疫分析仪、电化学发光法检测血清AFP。所有操作严格按照试剂盒说明进行。
1.3 血清QSOX-1、GSN、AFP单独或联合检测诊断原发性肝癌的效能分析 分别绘制血清QSOX-1、GSN、AFP单独检测诊断原发性肝癌的受试者工作特征(ROC)曲线,确定血清QSOX-1、GSN、AFP单独检测诊断原发性肝癌的临界值;血清QSOX-1、GSN、AFP联合检测诊断采用Binary Logistic回归分析,产生各个体预测概率的新变量,得出ROC曲线,采用ROC曲线下面积(AUC)评价血清QSOX-1、GSN、AFP单独及联合检测对原发性肝癌的诊断效能。
1.4 统计学方法 采用SPSS17.0统计软件。计量资料以M(P25,P75)表示,多组比较采用Kruskal-WallisH检验,组间两两比较采用Mann-Whitney秩和检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清QSOX-1、GSN、AFP水平比较 见表1。
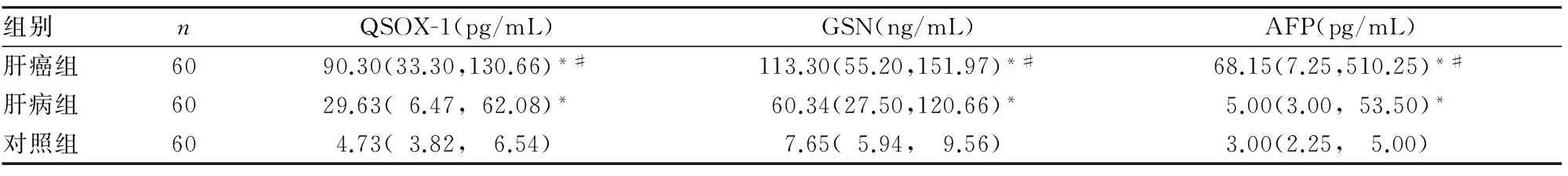
表1 各组血清QSOX-1、GSN、AFP水平比较[M(P25,P75)]
注:与对照组比较,*P<0.01;与肝病组比较,#P<0.01。
2.2 血清QSOX-1、GSN、AFP单独及联合检测对原发性肝癌的诊断效能分析 ROC曲线分析显示,血清QSOX-1、GSN、AFP单独检测诊断原发性肝癌的AUC分别为0.891、0.801、0.802,95%CI分别为0.846~0.935、0.736~0.867、0.729~0.874,P均<0.01。血清QSOX-1、GSN、AFP单独检测诊断原发性肝癌的最佳临界值分别为26.192 pg/mL、100.567 ng/mL、9.500 ng/mL,此时三者诊断原发性肝癌的Youden指数分别为58.3%、53.3%、55.0%,敏感性分别为88.3%、70.0%、73.3%,特异性分别为70.0%、83.3%、81.7%。AFP+QSOX-1、AFP+GSN、QSOX-1+GSN、AFP+QSOX-1+GSN诊断原发性肝癌的AUC分别为0.911、0.848、0.895、0.918,95%CI分别为0.871~0.950、0.790~0.907、0.850~0.939、0.879~0.956,P均<0.01。此时,其诊断原发性肝癌的Youden指数分别为64.2%、59.2%、63.3%、65.8%,敏感性分别为88.3%、80.0%、85.0%、90.0%,特异性分别为75.8%、79.2%、78.3%、75.8%。
3 讨论
影像学检查及血清肿瘤标志物检测是目前临床早期筛查原发性肝癌的主要手段[4]。超声检查虽能发现病灶,但其检出率过于依赖检测仪器的敏感性,并要求影像科医师具有丰富的经验[5]。血清肿瘤标志物检测具有取材简单、操作便捷、检测费用低等优点,但由于受多种因素影响,其敏感性和特异性均不令人满意。因此,探索更佳的血清肿瘤标志物早期筛查原发性肝癌一直是临床研究热点。
蛋白质组学技术是现代生命科学研究的方法之一,如同位素标记的相对和绝对定量技术、液相色谱串联质谱技术,可较全面、整体地分析相关蛋白的组成、表达、修饰状态,揭示蛋白功能与生命活动规律。因此,通过蛋白质组学技术探寻敏感的肿瘤标志物,可能是肿瘤发病机制研究的新路径[6,7]。
QSOX-1是由TRX和ERV1融合而成的多结构域蛋白,广泛存在于消化系统、呼吸系统、生殖系统等高二硫键蛋白分泌组织,可催化蛋白硫醇氧化成二硫化物,参与细胞内蛋白折叠过程。研究发现,敲除QSOX-1表达可抑制肾癌细胞增殖,提示QSOX-1可能具有癌基因作用[8]。有研究发现,QSOX-1高表达与胰腺癌、乳腺癌等恶性肿瘤的侵袭性有关,说明QSOX-1是与肿瘤侵袭性有关的蛋白分子[9~11]。Yano等[12]应用吉非替尼治疗胰腺癌时发现,血清QSOX-1表达升高,并认为QSOX-1可能是治疗胰腺癌潜在靶点之一。另有研究发现,QSOX-1高表达与肿瘤患者预后不良有关[13]。本课题组前期基于蛋白质组学技术研究发现,QSOX-1、GSN有可能是诊断原发性肝癌潜在的分子生物标志物[2]。
GSN是一种钙调节蛋白,属于凝溶胶蛋白超家族,可参与肌动蛋白丝的剪切、聚合、解聚,影响细胞骨架重排,同时与细胞凋亡、免疫、炎症等有关。研究发现,GSN具有参与肿瘤侵袭、转移等生物学功能,其作用机制可能与PI3K、c-erb-2/EGFR、Ras-PI3K-Rac等信号通路有关[14]。王绍清等[15]通过抑制鼠源肝癌细胞Hca-F中GSN表达发现,GSN表达下调可降低鼠源肝癌细胞Hca-F的侵袭能力,提示GSN可能与肝癌发展有关。Deng等[16]研究发现,在肝癌组织中GSN高表达,其高表达与肝癌细胞增殖和侵袭相关。上述研究提示,GSN亦可能为诊断原发性肝癌潜在的分子生物标志物。
本研究结果显示,肝癌组、肝病组、对照组血清QSOX-1、GSN、AFP水平依次递减,说明血清QSOX-1、GSN、AFP均与肝癌的发生、发展有关。本研究以ROC曲线的AUC及Youden指数作为诊断原发性肝癌效能的评价指标,结果显示,在单独及联合检测中,血清QSOX-1+GSN+AFP联合检测的AUC、Youden指数最佳,分别为0.918、65.8%;两两指标(AFP+QSOX-1、AFP+GSN、QSOX-1+GSN)联合检测的AUC分别为0.911、0.848、0.895,Youden指数分别为64.2%、59.2%、63.3%;单独(QSOX-1、GSN、AFP)检测的AUC分别为0.891、0.801、0.802,Youden指数分别为58.3%、53.3%、55.0%。说明QSOX-1+GSN+AFP联合检测诊断原发性肝癌的效能优于两两指标联合检测及单独检测。敏感性和特异性分析发现,QSOX-1+GSN+AFP联合检测诊断原发性肝癌的敏感性最佳,其特异性达到75.8%。说明QSOX-1+GSN+AFP联合检测可降低原发性肝癌的漏诊率及误诊率,提高诊断准确性。
综上所述,血清QSOX-1、GSN、AFP联合检测可提高对原发性肝癌的诊断敏感性,优化诊断效能,对原发性肝癌的早期筛查具有一定参考价值。
参考文献:
[1] Chen H, Chen S, Li S, et al. Combining des-gamma-carboxyprothrombin and alpha-fetoprotein for hepatocellular carcinoma diagnosing: an update meta-analysis and validation study[J]. Oncotarget, 2017,8(52):90390-90401.
[2] Guo J, Jing R, Zhong JH, et al. Identification of CD14 as a potential biomarker of hepatocellular carcinoma using iTRAQ quantitative proteomics[J]. Oncotarget, 2017,8(37):62011-62028.
[3] 谢维,黄天壬,李云西,等.肝癌进展过程中QSOX-1的动态变化及意义[J].中国热带医学,2015,15(4):389-392.
[4] Song P, Tang Q, Feng X, et al. Biomarkers: evaluation of clinical utility in surveillance and early diagnosis for hepatocellular carcinoma[J]. Scand J Clin Lab Invest Suppl, 2016(245):S70-S76.
[5] Singal AG, Conjeevaram HS, Volk ML, et al. Effectiveness of hepatocellular carcinoma surveillance in patients with cirrhosis[J]. Cancer Epidemiol Biomarkers Prev, 2012,21(5):793-799.
[6] Geyer PE, Holdt LM, Teupser D, et al. Revisiting biomarker discovery by plasma proteomics[J]. Mol Syst Biol, 2017,13(9):942.
[7] Zhang X, Ning Z, Mayne J, et al. MetaPro-IQ: a universal metaproteomic approach to studying human and mouse gut microbiota[J]. Microbiome, 2016,4(1):31.
[8] Hanavan PD, Borges CR, Katchman BA, et al. Ebselen inhibits QSOX1 enzymatic activity and suppresses invasion of pancreatic and renal cancer cell lines[J]. Oncotarget, 2015,6(21):18418-18428.
[9] Shi CY, Fan Y, Liu B, et al. HIF1 contributes to hypoxia-induced pancreatic cancer cells invasion via promoting QSOX1 expression[J]. Cell Physiol Biochem, 2013,32(3):561-568.
[10] Katchman BA, Antwi K, Hostetter G, et al. Quiescin sulfhydryl oxidase 1 promotes invasion of pancreatic tumor cells mediated by matrix metalloproteinases[J]. Mol Cancer Res, 2011,9(12):1621-1631.
[11] Katchman BA, Ocal IT, Cunliffe HE, et al. Expression of quiescin sulfhydryl oxidase 1 is associated with a highly invasive phenotype and correlates with a poor prognosis in Luminal B breast cancer[J]. Breast Cancer Res, 2013,15(2):R28.
[12] Yano S, Matsuyama H, Hirata H, et al. Identification of genes linked to gefitinib treatment in prostate cancer cell lines with or without resistance to androgen: a clue to application of gefitinib to hormone-resistant prostate cancer[J]. Oncol Rep, 2006,15(6):1453-1460.
[13] Knutsvik G, Collett K, Arnes J, et al. QSOX1 expression is associated with aggressive tumor features and reduced survival in breast carcinomas[J]. Mod Pathol, 2016,29(12):1485-1491.
[14] Guo Y, Zhang H, Xing X, et al. Gelsolin regulates proliferation, apoptosis and invasion in NK/T-cell lymphoma cells[J]. Biol Open, 2017. doi:10.1242/bio.027557.[Epub ahead of print]
[15] 王绍清,孙明忠,刘淑清,等.Gelsolin表达下调降低鼠源肝癌细胞的侵袭能力[J].中国肿瘤临床,2009,36(16):948-952.
[16] Deng B, Fang J, Zhang X, et al. Role of gelsolin in cell proliferation and invasion of human hepatocellular carcinoma cells[J]. Gene, 2015,571(2):292-297.
