阿帕替尼对人肝癌裸鼠皮下移植瘤生长及生物钟基因表达的影响
2018-05-15何晓晓熊枝繁邱梦君占静陈仁旺杨盛力
何晓晓,熊枝繁,邱梦君,占静,陈仁旺,杨盛力
(1 华中科技大学同济医学院附属梨园医院,武汉430077;2 华中科技大学同济医学院附属协和医院)
近年来肝癌的发病率不断升高,全球每年新发病例超过700 000例[1]。生物钟是细胞自发产生和维持的,它不依赖于外界因素维持着机体的时间节律性,其作用在于产生和控制昼夜生物节律的运转。研究证实,生物钟对肿瘤的发生、发展具有调控作用[2]。目前在哺乳动物体内多个生物钟基因已被确认,如CLOCK、BMAL1、CKIε、Per(Per1、Per2、Per3)、Cry(Cry1、Cry2)、DEC和NPAS2等[3,4]。阿帕替尼是一种新型的小分子抗血管生成剂,能够靶向抑制血管内皮生长因子受体2(VEGFR-2)酪氨酸激酶活性,继而抑制肿瘤血管生成,发挥抗肿瘤作用[5]。有研究证实,阿帕替尼靶向治疗晚期胃癌或肝癌的临床疗效较好[6,7],并可延长患者总生存期[8]。Yu等[9]研究认为,生物钟基因是一种潜在的抑癌基因,可抑制肿瘤细胞增殖,并能促进肿瘤细胞凋亡。Lin等[10,11]研究发现,在肝癌细胞或组织中存在某些生物钟基因表达紊乱,如Per、Cry等。但目前阿帕替尼靶向治疗肝癌能否影响生物钟基因的表达尚不清楚。2017年3~5月,本研究观察了阿帕替尼对人肝癌裸鼠皮下移植瘤生长及生物钟基因表达的影响。现分析结果并报告如下。
1 材料与方法
1.1 材料 BALB/c裸鼠16只,雌雄各半,4~6周龄,体质量16~23 g,SPF条件下分笼喂养。人肝癌细胞株HepG2(以下称HepG2细胞),购自中国典型物种保藏中心,液氮中保存。甲磺酸阿帕替尼片,江苏恒瑞医药股份有限公司,用10% DMSO溶解,制成终浓度为0.2 g/mL溶液。所有PCR引物由美国Life Technologies公司设计合成。CO2培养箱,美国Harris公司;荧光定量PCR仪,美国Ambion公司;电泳仪,美国Bio-Rad公司;低温高速离心机,德国Heraeus公司。RPMI 1640、FBS、胰酶,美国Hyclone公司;DMSO,美国MP Biomedicals公司;TRIzol、SYBR®Green PCR Master Mix,美国Life Technologies公司。
1.2 人肝癌裸鼠皮下移植瘤模型建立 HepG2细胞复苏后,接种于含10% FBS RPMI 1640培养基的培养瓶中,置于37 ℃、5% CO2、饱和湿度的培养箱中。每2~3天换液1次,待细胞铺满瓶底80%~90%时,以1∶3比例传代。收集传3代对数生长期细胞,胰蛋白酶消化,计数,用PBS缓冲液制成密度为1×107个/mL的细胞悬液。取细胞悬液0.2 mL,接种于裸鼠右腋皮下,放回笼中,继续在SPF条件下喂养。
1.3 动物分组处理 所有裸鼠接种HepG2细胞后,每日观察一般状况、接种部位液体吸收及成瘤情况。接种3天左右,所有裸鼠右腋皮下接种部位出现3~5 mm的肿瘤结节。随着肿瘤结节体积的增加,所有裸鼠出现精神萎靡、活动迟缓,食欲、体质量较接种前明显降低。至接种1周,所有裸鼠肿瘤结节体积达100 mm3左右,随机将裸鼠分为阿帕替尼组、对照组,每组8只。阿帕替尼组给予阿帕替尼50 mg/kg灌胃,对照组给予DMSO 100 μL/20 g灌胃,每天1次,连续灌胃2周。两组治疗期间均无死亡。
1.4 相关指标观察
1.4.1 肿瘤体积 两组灌胃治疗期间每隔2天用用游标卡尺测量肿瘤的最大径(a)和最小径(b)。分别于灌胃治疗前,灌胃治疗第3、6、9、12天以及灌胃结束24 h,计算肿瘤体积(V)。V(mm3)=ab2/2。
1.4.2 Per、CLOCK、Cry、BMAL1、CKIε mRNA表达 采用Real-time PCR法。末次灌胃结束24 h,颈椎脱臼法处死,剥离瘤体,置于液氮中,-80 ℃冰箱冻存。取两组冻存肿瘤组织各100 mg,TRIzol法提取组织总RNA,采用紫外分光光度计鉴定总RNA纯度,OD260/OD280为1.7~2.0,表明提取的总RNA纯度合格,可用于后续实验。按照SYBR®Green PCR Master Mix试剂盒说明将总RNA逆转录为cDNA,以cDNA为模板进行PCR扩增。引物序列:Per1上游引物5′-AGGCAACGGCAAGGACTC-3′,下游引物5′-GGCTGTAGGCAATGGAACTG-3′,温度60.2 ℃,产物大小101 bp;Per2上游引物5′-CTACAGCAGCACCATCGTC-3′,下游引物5′-CCACTCGCAGCATC-TTCC-3′,温度58.9 ℃,产物大小78 bp;Per3上游引物5′-TGGTGGTGGTGAATGTAAGAC-3′,下游引物5′-GGCTGTGCTCATCGTTCC-3′,温度57.2 ℃,产物大小104 bp;Cry1上游引物5′-CAACCTCCATTCATCTTTCC-3′,下游引物5′-CTCATAGCCGACACCTTC-3′,温度58.9 ℃,产物大小151 bp;Cry2上游引物5′-TGGGCTTCTGGGACTGAG-3′,下游引物5′-GGTAGGTGTGCTGTCTTAGG-3′,温度57.2 ℃,产物大小136 bp;CLOCK上游引物5′-GCAGCAGCAGCAGCAGAG-3′,下游引物5′-CAGCAGAGAGAATGA-GTTGAGTTG-3′,温度61.9 ℃,产物大小149 bp;BMAL1上游引物5′-TGCCACCAATCCATACACAGA-AG-3′,下游引物5′-TTCCCTCGGTCACATCCTACG-3′,温度60.9 ℃,产物大小123 bp;CKIε:上游引物5′-TCAGCGAGAAGAAGATGTC-3′,下游引物5′-GA-AGAGGTTGCGGAAGAG-3′,温度58.9 ℃,产物大小149 bp;内参β-actin上游引物5′-AGTTGCGTTACACCCTTTCTTGAC-3′,下游引物5′-GCTCGCTCCA-ACCGACTGC-3′,温度60.0 ℃,产物大小171 bp。每个样本设3个复孔。PCR反应体系共25 μL:SYBRGreen Mix 12.5 μL,cDNA模板2 μL,上下游引物各1 μL,ddH2O 8.5 μL;反应条件:94 ℃ 5 min,94 ℃ 2 min、59 ℃ 1 min、72 ℃ 1 min共33个循环,最后72 ℃ 10 min。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。
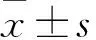
2 结果
2.1 两组灌胃不同时间移植瘤体积变化 见表1。

表1 两组灌胃不同时间移植瘤体积比较
注:与对照组同时间比较,*P<0.05。
2.2 两组移植瘤组织生物钟基因Per、CLOCK、Cry、BMAL1、CKIε mRNA表达比较 见表2。

表2 两组移植瘤组织Per、CLOCK、Cry、BMAL1、CKIε mRNA相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
血管生成是许多肿瘤生长和转移的重要标志,故抑制血管内皮生长因子信号通路是抗肿瘤治疗的有效靶点之一。阿帕替尼为VEGFR-2小分子抑制剂,主要用于标准化疗后仍有进展的晚期胃癌患者。研究证实,阿帕替尼具有广谱抗实体瘤效果,可用于胃癌、非小细胞肺癌、乳腺癌、肝癌等多种肿瘤的靶向治疗[12]。本研究结果显示,阿帕替尼组从灌胃第3天开始肿瘤体积明显低于对照组,说明阿帕替尼能抑制肿瘤生长,进一步验证了阿帕替尼的抗肿瘤效果,与文献[13]报道基本一致。
研究证实,生物钟基因突变与恶性肿瘤的发生、发展密切相关,尤其是腹部恶性肿瘤患者生物钟基因普遍存在异常表达[14]。肿瘤细胞中生物钟基因Per、Cry通常处于低表达状态[15,16];当这些生物钟基因过表达时,可诱导肿瘤细胞凋亡,抑制肿瘤生长[17,18]。生物钟基因CLOCK在肿瘤组织中多呈过表达状态,其过表达会促进肿瘤细胞侵袭和迁移[19]。目前CKIε表达与恶性肿瘤的关系尚不十分清楚。Kou等[13]研究发现,肿瘤细胞内的一些生物钟基因,如Per、Cry、CLOCK、BMAL1等,可影响VEGF的转录调控。生物钟基因表达紊乱及其引起的代谢紊乱是肝癌等多种恶性肿瘤发生的重要原因之一[2]。阿帕替尼作为VEGFR-2抑制剂,是否通过调控生物钟基因表达来抑制肿瘤血管生成,继而达到抗肿瘤目的尚不清楚。本研究结果显示,阿帕替尼组移植瘤组织Per3、CLOCK、CKIε、Cry2 mRNA相对表达量明显低于对照组。表明阿帕替尼的抗肿瘤效果可能与抑制上述生物钟基因表达有关。
综上所述,阿帕替尼能抑制人肝癌裸鼠皮下移植瘤生长,其机制可能与下调肿瘤细胞生物钟基因Per3、CLOCK、Cry2、CKIε mRNA表达有关。
参考文献:
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] 郭金虎,徐璎,张二荃,等.生物钟研究进展及重要前沿科学问题[J].中国科学基金,2014,28(3):179-186.
[3] Badiu C. Genetic clock of biologic rhythms[J]. J Cell Mol Med, 2003,71(4):408-416.
[4] Ko CH, Takahashi JS. Molecular components of the mammalian circadian clock[J]. Hum Mol Genet, 2006(15):R271-R277.
[5] 冯久桓,秦叔逵,王琳.甲磺酸阿帕替尼的研究现状与进展[J].临床肿瘤学杂志,2017,22(4):345-356.
[6] Li J, Qin S, Xu J, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016,34(13):1448-1454.
[7] Qin SK. Apatinib in Chinese patients with advanced hepatocellular carcinoma: a phase Ⅱ randomized, open-label trial[J]. J Clin Oncol, 2014,32(15):4019.
[8] Huang L, Wei Y, Shen S, et al. Therapeutic effect of apatinib on overall survival is mediated by prolonged progression-free survival in advanced gastric cancer patients[J]. Oncotarget, 2017,8(17):29346-29354.
[9] Yu EA, Weaver DR. Disrupting the circadian clock: gene-specific effects on aging, cancer, and other phenotypes[J]. Aging (Albany NY), 2011,3(5):479-493.
[10] Lin YM, Chang JH, Yeh KT, et al. Disturbance of circadian gene expression in hepatocellular carcinoma[J]. Mol Carcinog, 2008,47(12):925-933.
[11] Yang SL, Yu C, Jiang JX, et al. Hepatitis B virus X protein disrupts the balance of the expression of circadian rhythm genes in hepatocellular carcinoma[J]. Oncol Lett, 2014,8(6):2715-2720.
[12] Zhang H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Dev Ther, 2015(9):6075-6081.
[13] Kou P, Zhang Y, Shao W, et al. Significant efficacy and well safety of apatinib in an advanced liver cancer patient: a case report and literature review[J]. Oncotarget, 2017,8(12):20510-20515.
[14] Yang SL, Ren QG, Wen L, et al. Research progress on circadian clock genes in common abdominal malignant tumors[J]. Oncol Lett, 2017,14(5):5091-5098.
[15] Chen ST, Choo KB, Hou MF, et al. Deregulated expression of the PER1, PER2 and PER3 genes in breast cancers[J]. Carcinogenesis, 2005,26(7):1241-1246.
[16] Lee S, Donehower LA, Herron AJ, et al. Disrupting circadian homeostasis of sympathetic signaling promotes tumor development in mice[J]. PLoS One, 2010,5(6):e10995.
[17] Cao Q, Gery S, Dashti A, et al. A role for the clock gene per1 in prostate cancer[J]. Cancer Res, 2009,69(19):7619-7625.
[18] Miyazaki K, Wakabayashi M, Hara Y, et al. Tumor growth suppression in vivo by overexpression of the circadian component, PER2[J]. Genes Cells, 2010,15(4):351-358.
[19] Tian J, Tang ZY, Ye SL, et al. New human hepatocellular carcinoma (HCC) cell line with highly metastatic potential (MHCC97) and its expressions of the factors associated with metastasis[J]. Br J Cancer, 1999,81(5):814-821.
