早期胃癌组织CD44v6蛋白表达、LVD变化及其与患者临床病理参数的关系
2018-05-15盛圆张开光吴海波杜军陈乐乐
盛圆,张开光,吴海波,杜军,陈乐乐
(安徽医科大学附属省立医院,合肥230001)
目前传统肠型胃癌的疾病模式已被普遍接受[1]。近年提出的肿瘤干细胞理论为肿瘤起源的认识开拓了新视野。CD44是一种恶性肿瘤干细胞表面标志物,属于黏附分子家族,作为一种细胞膜表面糖蛋白介导细胞间的黏附作用,参与细胞增殖、分化、迁移等,具有促进肿瘤生长、侵袭和转移等作用。CD44v6是CD44的主要变体之一。有研究发现,CD44v6与胃癌、结直肠癌等恶性肿瘤的发生、发展有关[2~4],可在部分恶性肿瘤癌前病变期或肿瘤早期即表达升高[5,6]。但目前关于早期胃癌组织CD44v6蛋白表达变化的研究较少。淋巴管密度(LVD)是指单位面积的淋巴管数量。LVD升高与淋巴管生成有关,而淋巴管生成与肿瘤淋巴结转移密切相关。淋巴结转移是胃癌转移的重要途径,也是胃癌转移的早期事件之一。故LVD升高可能对早期胃癌淋巴结转移有一定预测价值。本研究观察了早期胃癌组织CD44v6蛋白表达及LVD变化,现对二者的关系及其与患者临床病理参数的关系进行分析,旨在探讨二者在胃癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择2011年1月~2012年12月安徽医科大学附属省立医院收治的早期胃癌患者111例(胃癌组),均经组织病理检查明确诊断。纳入标准:①首诊,均行外科根治术或内镜黏膜下剥离术,术前未行任何抗肿瘤治疗;②术后组织病理检查证实肿瘤局限于黏膜层或黏膜下层;③临床病理资料完整。排除标准:①合并其他部位原发癌;②复发性胃癌或残胃癌;③术前已行放化疗等抗肿瘤治疗。其中,男75例、女36例;年龄(60.8±10.1)岁;肿瘤最大径(2.21±1.37)cm;肿瘤部位:贲门或胃底部33例、胃体部31例、胃窦部47例;浸润深度:黏膜层48例,黏膜下层63例;组织分化程度:高中分化54例,低未分化57例;有淋巴结转移41例,无淋巴结转移70例;有淋巴管浸润22例,无淋巴管浸润89例。同期选择安徽医科大学附属省立医院收治的胃黏膜上皮内瘤变患者125例,均经胃镜活检或术后组织病理检查明确诊断,其中低级别上皮内瘤变(LGIN)65例(LGIN组)、高级别上皮内瘤变(HGIN)60例(HGIN组)。纳入标准:①既往未行胃部手术或内镜下治疗;②经胃镜活检或术后组织病理检查证实,存在上皮结构紊乱或细胞异型,包括异型增生和原位癌。LGIN组男45例、女20例,年龄(59.6±11.3)岁;HGIN组男41例、女19例,年龄(60.5±9.2)岁。同期选择在安徽医科大学附属省立医院健康查体、经胃镜活检证实存在慢性浅表性胃炎者50例(胃炎组),排除有消化系统不适症状者、既往有胃部手术史者及合并萎缩性胃炎、肠上皮化生或上皮内瘤变者。其中,男36例、女14例,年龄(59.3±10.5)岁。各组性别、年龄具有可比性。本研究经安徽医科大学附属省立医院医学伦理委员会批准,患者均知情同意。
1.2 胃组织CD44v6蛋白表达及LVD检测 采用免疫组化二步法。胃癌组、HGIN组标本来源于外科根治术或内镜黏膜下剥离术,胃炎组、LGIN组标本来源于胃镜活检。所有组织标本用4%中性甲醛固定,石蜡包埋,4 μm厚连续切片。65 ℃烤片过夜,二甲苯脱蜡,梯度乙醇脱水,柠檬酸缓冲液煮沸抗原修复,自然冷却至室温;PBS冲洗5 min×3次,3% H2O2室温孵育8 min消除内源性过氧化物酶;PBS冲洗5 min×3次,分别滴加CD44v6单克隆抗体(1∶250)、鼠抗人D2-40单克隆抗体(1∶25),4 ℃冰箱孵育过夜;PBS冲洗5 min×3次,滴加快捷型酶标羊抗鼠/兔IgG聚合物,室温孵育15~20 min;PBS冲洗5 min×3次,DAB显色;自来水冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。以PBS代替一抗作为阴性对照。采用双盲法由两位病理科医师独立阅片判断结果:①CD44v6蛋白表达:CD44v6蛋白阳性染色定位于细胞膜上,在细胞膜周围呈连续的棕黄(褐)色线状或带状分布。每张切片随机选择5个400倍视野,每个视野计数100个细胞,观察染色强度,计数阳性细胞数。根据染色强度和阳性细胞比例综合判定结果。染色强度:不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞比例:≤5%为0分,>5%~≤25%为1分,>25%~≤50%为2分,>50%~≤75%为3分,>75%为4分。二者乘积≥3分为CD44v6蛋白阳性表达。②LVD:染成深黄色的管腔判定为淋巴管,以单位面积上D2-40标记的淋巴管数量作为LVD。先在低倍镜(×40)视野下确定淋巴管数量最多的热点区域,然后在高倍镜(×200)视野下每张切片选取5个热点区域,计数每个热点区域的淋巴管数量,取其平均值。D2-40染色的淋巴管腔内出现癌细胞或癌细胞团判定为淋巴管浸润。
1.3 早期胃癌组织CD44v6蛋白阳性表达、LVD的关系及其与患者临床病理参数的关系 收集早期胃癌患者的临床病理资料,包括性别、年龄、肿瘤最大径、肿瘤部位、浸润深度、组织分化程度、淋巴结转移、淋巴管浸润等,分析CD44v6蛋白阳性表达、LVD与患者临床病理参数的关系。采用Spearman等级相关分析法分析二者的相关性。
1.4 LVD预测早期胃癌淋巴结转移的效能分析 采用受试者工作特征(ROC)曲线评估LVD预测早期胃癌淋巴结转移的效能。
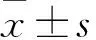
2 结果
2.1 各组CD44v6蛋白阳性表达及LVD比较 见表1。

表1 各组CD44v6蛋白阳性表达及LVD比较
注:与胃炎组比较,*P<0.05;与LIGN组比较,#P<0.05;与HIGN组比较,△P<0.05。
2.2 早期胃癌组织CD44v6蛋白阳性表达、LVD与患者临床病理参数的关系 早期胃癌组织CD44v6蛋白阳性表达、LVD均与淋巴结转移、淋巴管浸润有关(P均<0.05),与患者性别、年龄和肿瘤部位、最大径、组织分化程度及浸润深度无关(P均>0.05)。见表2。
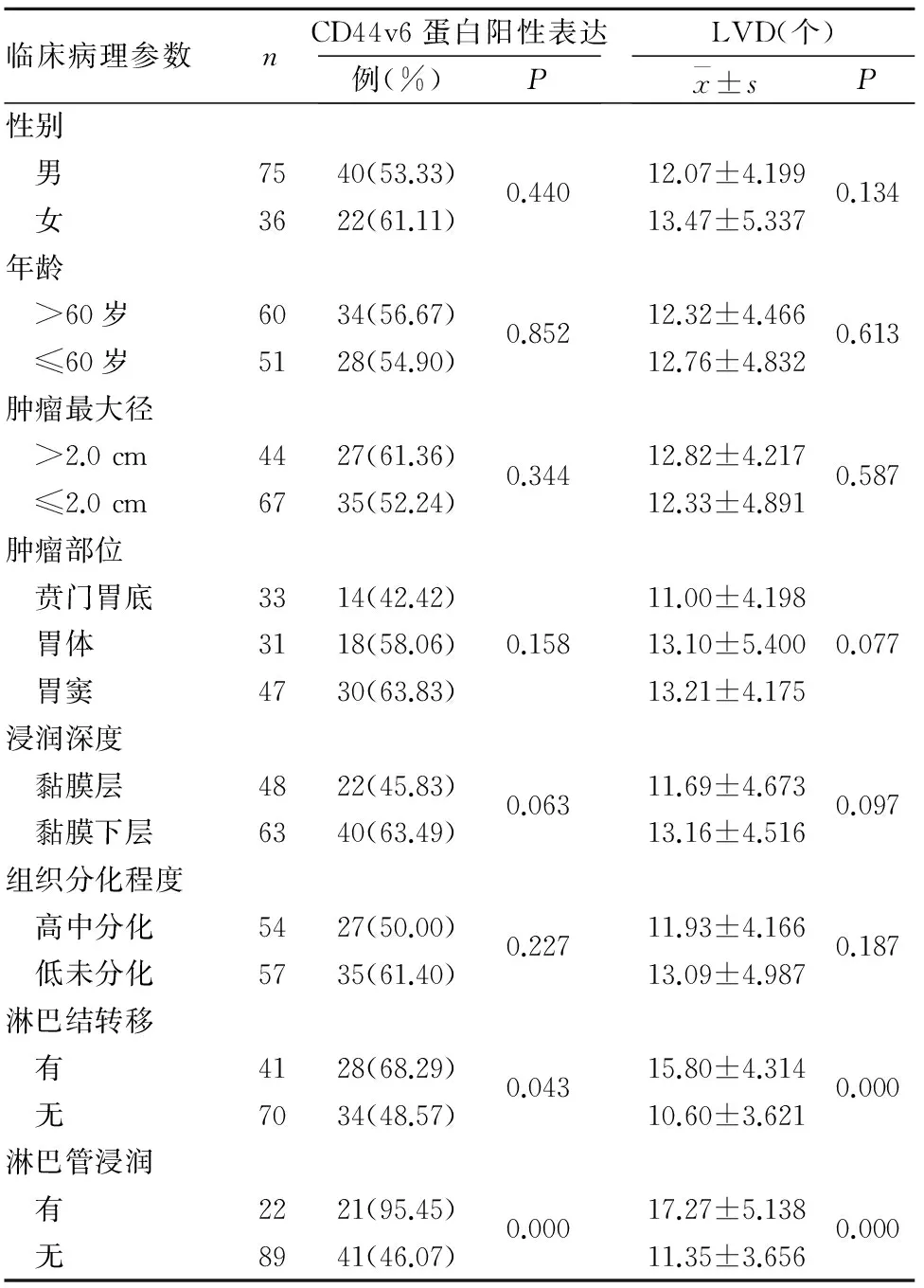
表2 CD44v6蛋白阳性表达、LVD与早期胃癌患者临床病理参数的关系
2.3 早期胃癌组织CD44v6蛋白阳性表达与LVD的关系 Spearman等级相关分析显示,早期胃癌组织CD44v6蛋白阳性表达与LVD呈正相关关系(r=0.302,P<0.01)。
2.4 LVD预测早期胃癌淋巴结转移的效能分析 ROC曲线分析显示,LVD预测早期胃癌淋巴结转移的曲线下面积为0.835(95%CI:0.758~0.912),其cut off值为14个,此时其预测淋巴结转移的敏感性为63.4%、特异性为90.0%。
3 讨论
Correa等[1]提出,肠型胃癌疾病模式是由正常胃黏膜→慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→异型增生(包括LGIN和HGIN)→早期胃癌→进展期胃癌。目前这种疾病模式已被普遍接受。近年提出的肿瘤干细胞理论认为,肿瘤是一种干细胞疾病,恶性肿瘤来源于极少数具有自我更新、无限增殖能力的肿瘤干细胞。胃癌干细胞有两种起源学说,即胃干细胞和骨髓源性干细胞。研究表明,胃干细胞或骨髓源性干细胞在基因突变、炎症、损伤等作用下,最终导致胃黏膜异型增生或肠型胃癌的发生[7,8]。此外,肿瘤干细胞还与肿瘤侵袭、转移有关,可能是肿瘤复发和放化疗抵抗的主要原因[9,10]。
CD44是一种重要的胃癌干细胞表面标志物[11],属于黏附分子家族,作为一种细胞膜表面糖蛋白介导细胞间的黏附作用,可增强肿瘤细胞与透明质酸的亲和力,改变细胞与基质的黏附作用,参与肿瘤细胞的黏附、侵袭、转移。CD44v6是CD44的重要变异体之一,与多种肿瘤的发生、发展有关。目前普遍认为,CD44v6高表达与进展期胃癌分期、转移和患者预后不良有关[3,4]。在部分肿瘤癌前病变期或肿瘤早期CD44v6即可出现表达升高,故有学者将CD44v6作为诊断部分组织癌前病变和早期肿瘤的分子标志物,如肺癌前病变[5]、早期胰腺癌[6]。但其在胃癌前病变或早期胃癌组织中表达的研究较少。da Cunha等[12]研究发现,CD44v6蛋白仅在正常胃黏膜的胃窦部腺管中微弱表达,在增生性息肉和完全肠上皮化生组织中表达轻度增加,不完全肠上皮化生和上皮内瘤变组织中表达明显增加。Xu等[13]研究发现,CD44v6蛋白在正常组织中不表达,上皮内瘤变与早期胃癌组织中即出现过表达,在进展期胃癌组织表达水平显著增加。本研究结果显示,胃炎组、LGIN组与HGIN组或胃癌组CD44v6蛋白阳性表达逐渐升高,与上述研究结果基本一致。说明CD44v6在胃黏膜早期恶性转化过程中发挥重要作用,这将有助于癌前病变及早期胃癌的诊断。胃癌组与HGIN组CD44v6蛋白阳性表达比较差异无统计学意义,考虑与HGIN相当于重度异型增生或原位癌,组织形态学上已接近癌组织,故二者在CD44v6蛋白阳性表达上比较接近。本研究还发现,CD44v6蛋白阳性表达与早期胃癌淋巴结转移、淋巴管浸润有关,表明CD44v6可能参与早期胃癌淋巴结转移。故早期检测CD44v6可能对预测早期胃癌淋巴结转移有一定参考价值。
LVD是指单位面积的淋巴管数量。早期研究认为,肿瘤淋巴结转移与肿瘤侵犯周围淋巴管有关,目前认为肿瘤可诱导新生淋巴管生成。LVD增加与淋巴管生成有关,肿瘤细胞通过淋巴管生成和淋巴管浸润向局部淋巴结转移,故LVD、淋巴管浸润与淋巴结转移密切相关。一些学者认为,LVD可作为预测肺癌、结肠癌等淋巴结转移状态的指标[14,15]。Gao等[16]研究认为,LVD可作为胃癌淋巴结转移、复发和患者预后的独立危险因素。王晓蕾等[17]研究认为,LVD与胃癌淋巴管浸润、肿瘤大小和浸润深度、淋巴结转移、临床分期、静脉浸润等有关,LVD和淋巴管浸润均具有预测胃癌淋巴结转移的价值,而LVD还是预测胃癌患者预后的独立指标。本研究结果显示,胃炎组、LGIN组、HGIN组、胃癌组LVD逐渐增加,进一步研究发现,LVD与淋巴结转移、淋巴管浸润有关。表明LVD增加可能是早期胃癌淋巴结转移的病理特征之一。
Lee等[18]研究认为,LVD是早期胃癌淋巴结转移的独立预测因子,可根据LVD预测淋巴结转移情况。本研究ROC曲线分析显示,LVD预测早期胃癌淋巴结转移的曲线下面积为0.835,其cut off值为14个,此时其预测淋巴结转移的敏感性为63.4%、特异性为90.0%。说明LVD预测早期胃癌淋巴结转移的价值较高。本研究还发现,早期胃癌组织CD44v6蛋白阳性表达和LVD呈正相关关系。提示联合检测CD44v6蛋白表达、LVD可预测早期胃癌淋巴结转移。
综上所述,早期胃癌组织CD44v6蛋白表达、LVD升高,二者均与淋巴结转移有关。联合检测CD44v6蛋白表达、LVD可预测早期胃癌淋巴结转移。
参考文献:
[1] Correa P, Piazuelo MB. The gastric precancerous cascade[J]. J Dig Dis, 2012,13(1):2-9.
[2] Todaro M, Gaggianesi M, Catalano V, et al. CD44v6 is a marker of constitutive and reprogrammed cancer stem cells driving colon cancer metastasis[J]. Cell Stem Cell, 2014,14(3):342-356.
[3] Xie JW, Chen PC, Zheng CH, et al. Evaluation of the prognostic value and functional roles of CD44v6 in gastric cancer[J]. J Cancer Res Clin Oncol, 2015,141(10):1809-1817.
[4] Fang M, Wu J, Lai X, et al. CD44 and CD44v6 are correlated with gastric cancer progression and poor patient prognosis: evidence from 42 studies[J]. Cell Physiol Biochem, 2016,40(3-4):567-578.
[5] Wimmel A, Kogan E, Ramaswamy A, et al. Variant expression of CD44 in preneoplastic lesions of the lung[J]. Cancer, 2001,92(5):1231-1236.
[6] Wang H, Rana S, Giese N, et al. Tspan8, CD44v6 and alpha6beta4 are biomarkers of migrating pancreatic cancer-initiating cells[J]. Int J Cancer, 2013,133(2):416-426.
[7] Li XB,Yang G,Zhu L,et al. Gastric Lgr5 (+) stem cells are the cellular origin of invasive intestinal-type gastric cancer in mice[J]. Cell Res, 2016,26(7):838-849.
[8] Donnelly JM, Engevik AC, Engevik M, et al. Gastritis promotes an activated bone marrow-derived mesenchymal stem cell with a phenotype reminiscent of a cancer-promoting cell[J]. Dig Dis Sci, 2014,59(3):569-582.
[9] Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001,414(6859):105-111.
[10] Visvader JE, Lindeman GJ. Cancer stem cells: current status and evolving complexities[J]. Cell Stem Cell, 2012,10(6):717-728.
[11] Takaishi S, Okumura T, Tu S, et al. Identification of gastric cancer stem cells using the cell surface marker CD44[J]. Stem Cells, 2009,27(5):1006-1020.
[12] da Cunha CB, Oliveira C, Wen X, et al. De novo expression of CD44 variants in sporadic and hereditary gastric cancer[J]. Lab Invest, 2010,90(11):1604-1614.
[13] Xu YY, Guo M, Yang LQ, et al. Regulation of CD44v6 expression in gastric carcinoma by the IL-6/STAT3 signaling pathway and its clinical significance[J].Oncotarget, 2017,8(28):45848-45861.
[14] Adachi Y, Nakamura H, Kitamura Y, et al. Lymphatic vessel density in pulmonary adenocarcinoma immunohistochemically evaluated with anti-podoplanin or anti-D2-40 antibody is correlated with lymphatic invasion or lymph node metastases[J]. Pathol Int, 2007,57(4):171-177.
[15] Kaneko I, Tanaka S, Oka S,et al.Lymphatic vessel density at the site of deepest penetration as a predictor of lymph node metastasis in submucosal colorectal cancer[J]. Dis Colon Rectum, 2007,50(1):13-21.
[16] Gao P, Zhou GY, Zhang QH, et al. Clinicopathological significance of peritumoral lymphatic vessel density in gastric carcinoma[J]. Cancer Lett, 2008,263(2):223-230.
[17] 王晓蕾,艾自胜,方建萍,等.D2-40标记的淋巴管密度和淋巴管浸润对胃癌淋巴结转移和预后的影响[J].中华消化杂志,2009,29(8):562-564.
[18] Lee K, Park DJ, Choe G, et al. Increased intratumoral lymphatic vessel density correlates with lymph node metastasis in early gastric carcinoma[J]. Ann Surg Oncol, 2010,17(1):73-80.
