前列腺癌细胞miR-191-5p表达变化及其对细胞增殖和凋亡的影响
2018-05-15张冲杨鹏刘振湘吕蔡
张冲,杨鹏,刘振湘,吕蔡
(中南大学湘雅医学院附属海口医院,海口570208)
微小RNA(miRNA)是一类长度为20~24个核苷酸的非编码小分子RNA,主要在转录后水平通过促进靶mRNA降解或抑制其翻译而发挥负性调控作用。大量研究表明,miRNA作为关键调控分子,可通过调控肿瘤细胞的多种生物学过程参与前列腺癌的发生、发展[1]。研究发现,miR-191-5p作为原癌基因,在肝癌、肾细胞癌、胃癌、乳腺癌、肺癌、结肠癌等多种肿瘤组织中表达上调,可通过调控肿瘤细胞的增殖、凋亡等发挥促癌作用[2~7]。有研究发现,miR-191-5p在前列腺癌组织中表达上调[8,9],但其在前列腺癌发生、发展中的作用鲜见报道。2016年3~12月,本研究观察了miR-191-5p在不同前列腺癌细胞中的表达变化及miR-191-5p敲低对前列腺癌细胞PC-3增殖和凋亡的影响,现分析结果并探讨其在前列腺癌发生、发展中的作用。
1 材料与方法
1.1 材料 人前列腺癌细胞PC-3、LNCap、DU145和正常前列腺上皮细胞RWPE-1均购自中国科学院上海细胞库。miR-191-5p inhibitor及 NC inhibitor均购自上海吉玛制药技术有限公司;RNA提取试剂TRIzol和转染试剂Lipofectamine RNAi max均购自美国Thermo Fisher Scientific公司;反转录试剂盒Mir-XTMmiRNA First-Strand Synthesis Kit和实时荧光定量PCR SYBR Premix Ex TaqⅡ试剂盒均购自日本TaKaRa公司;CCK-8试剂和Annexin V-FITC/PI细胞凋亡检测试剂盒均购自南京凯基生物科技发展有限公司;DMEM培养液、胎牛血清及青霉素-链霉素双抗溶液均购自美国Hyclone公司;胰酶购自美国Sigma公司。
1.2 前列腺癌细胞与正常前列腺上皮细胞miR-191-5p表达检测 采用qRT-PCR法。将人前列腺癌细胞PC-3、LNCap、DU145和正常前列腺上皮细胞RWPE-1接种于含10%胎牛血清、100 U/mL青霉素-链霉素双抗的DMEM培养液,置于37 ℃、5% CO2的恒温培养箱中培养。采用TRIzol试剂提取人前列腺癌细胞PC-3、LNCap、DU145和正常前列腺上皮细胞RWPE-1的总RNA,使用反转录试剂盒Mir-XTMmiRNA First-Strand Synthesis Kit和实时荧光定量PCR SYBR Premix Ex TaqⅡ试剂盒进行qRT-PCR反应。PCR反应体系共20 μL:2×SYBR®Premix Ex TaqTMⅡ 10 μL,miRNA特异引物和通用下游引物各1 μL,cDNA模板1 μL,ddH2O补足至20 μL。PCR反应采用两步法:95 ℃预变性10 s,95 ℃变性5 s、60 ℃退火延伸30 s共40个循环。miR-191-5p特异引物:5′-CAACGGAATCCCAAAAGCAGCTG-3′,以U6为内参,使用ABI7500 Fast 进行qRT-PCR反应和数据收集。采用2-ΔΔCt法计算各细胞中miR-191-5p相对表达量。实验重复3次,取平均值。
1.3 miR-191-5p敲低及其对PC-3细胞增殖、细胞周期比例、细胞凋亡影响的观察
1.3.1 miR-191-5p敲低 将PC-3细胞接种于6孔板中,每孔1×106个,置于37 ℃、5% CO2的培养箱中过夜。待细胞融合30%~50%时,随机分为敲低组和对照组,参照Lipofectamine RNAi max试剂说明书分别转染miR-191-5p inhibitor、NC inhibitor。转染48 h,采用qRT-PCR法检测两组miR-191-5p相对表达量,具体步骤参照1.2。实验重复3次,取平均值。
1.3.2 miR-191-5p敲低后细胞增殖能力观察 采用CCK-8法。两组转染24 h,收集细胞,加入完全培养液重悬,以3 000个/孔接种于96孔板。两组各设置5行,每行5个复孔,置于37 ℃、5% CO2的培养箱中培养。分别于培养6、24、48、72、96 h时,加入10 μL CCK-8试剂,37 ℃孵育1 h。酶标仪450 nm波长处检测各孔的光密度(OD)值。以OD450值表示细胞增殖能力。实验重复3次,取平均值。
1.3.3 miR-191-5p敲低后细胞周期比例观察 采用流式细胞术。两组转染24 h,收集细胞,以1×106个/孔接种于6孔板中,用预冷的70%乙醇于4 ℃条件下固定过夜,PBS洗涤,用含50 μg/mL碘化丙啶(PI)、100 μg/ mL RNase A和0.2%(v/v)Triton X-100的染色液避光处理30 min,上流式细胞仪检测细胞周期,采用FlowJo软件分析各周期细胞比例。实验重复3次,取平均值。
1.3.4 miR-191-5p敲低后细胞凋亡能力观察 采用流式细胞术。两组转染24 h,收集细胞,以1×106个/孔接种于6孔板中,用预冷的PBS洗涤2次,加入100 μL 1×Binding Buffer重悬细胞,然后加入5 μL Annexin V-FITC和5 μL PI Staining Solution,轻轻混匀。室温避光孵育15 min,加入400 μL 1×Binding Buffer,混匀后置于冰上,1 h内上流式细胞仪检测凋亡细胞比例。实验重复3次,取平均值。
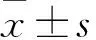
2 结果
2.1 前列腺癌细胞与正常前列腺上皮细胞miR-191-5p表达比较 前列腺癌细胞PC-3、LNCap、DU145和正常前列腺上皮细胞RWPE-1中miR-191-5p相对表达量分别为5.790±0.299、4.550±0.664、2.790±0.145、1.000±0.038,前列腺癌细胞PC-3、LNCap、DU145中miR-191-5p相对表达量均高于正常前列腺上皮细胞RWPE-1(P均<0.01)。
2.2 敲低组与对照组miR-191-5p表达比较 敲低组与对照组miR-191-5p相对表达量分别为0.27±0.09、1.00±0.02,敲低组明显低于对照组(P<0.01)。
2.3 敲低组与对照组细胞增殖能力比较 敲低组与对照组转染24 h再培养6 h时细胞增殖能力比较差异无统计学意义(P>0.05),敲低组转染24 h再培养24、48、72、96 h时细胞增殖能力均低于对照组(P<0.05或<0.01)。见表1。

表1 敲低组与对照组转染24 h再培养6、24、48、72、96 h细胞增殖能力比较
注:与对照组同时间比较,*P<0.05,#P<0.01。
2.4 敲低组与对照组细胞周期比例比较 敲低组G0/G1期细胞比例高于对照组,S期细胞比例低于对照组(P<0.05或<0.01);两组G2/M期细胞比例比较差异无统计学意义(P>0.05)。见表2。

表2 敲低组与对照组细胞周期比例比较
注:与对照组比较,*P<0.05,#P<0.01。
2.5 敲低组与对照组细胞凋亡比例比较 敲低组与对照组细胞凋亡比例分别为(16.67±0.97)%、(9.27±0.85)%,两组比较P<0.01。
3 讨论
研究发现,有多种miRNA在肿瘤组织和肿瘤细胞中异常表达,发挥癌基因或抑癌基因作用,作为重要的调控因子参与肿瘤的发生、发展[10~13]。如miR-191-5p在肝癌、肾细胞癌、乳腺癌、肺癌等多种肿瘤细胞中表达升高,并可通过调控肿瘤细胞增殖、凋亡等发挥促癌作用[2~6];miR-191-5p可作为肝细胞癌治疗的潜在靶点,抑制其表达可降低肝癌细胞的增殖活性并诱导其凋亡,继而抑制肿瘤生长[2]。肝癌组织中miR-191-5p基因组位点由于处于低甲基化状态,导致miR-191-5p表达升高,进而促进肝癌细胞的上皮间质转化[3]。肾细胞癌患者血清miR-191-5p表达较健康者明显升高,提示血清miR-191-5p可作为肾细胞癌早期诊断的潜在标志物[4];miR-191-5p联合miR-125b、miR-21用于区分乳腺癌组织和癌旁正常组织具有较高的敏感性和特异性[5]。miR-191-5p过表达可通过降低caspase 3/7活性和SOX4、p53表达,进而抑制乳腺癌细胞凋亡[14];miR-191-5p在肝内胆管细胞癌组织中表达上调,且其表达上调是患者预后不良的一个独立危险因素,过表达miR-191-5p可促进肝内胆管细胞癌细胞增殖、侵袭与迁移[15];miR-191-5p可通过作用其靶基因TET1,提高p53基因转录起始位点的甲基化水平,进而降低p53表达。
Volinia等[9]采用基因芯片技术对前列腺癌组织及其癌旁正常组织miRNA表达谱进行分析,发现miR-191-5p在前列腺癌组织中表达升高。本研究结果显示,人前列腺癌细胞PC-3、LNCap、DU145中miR-191-5p相对表达量均高于正常前列腺上皮细胞RWPE-1,表明miR-191-5p可能是前列腺癌发生的一个原癌基因。本研究利用miR-191-5p inhibitor敲低了PC-3细胞中miR-191-5p表达,并对其细胞增殖、细胞周期及细胞凋亡进行检测。结果显示,敲低miR-191-5p表达能够抑制PC-3细胞增殖活性,并将其阻滞于G0/G1期,还能诱导PC-3细胞凋亡。说明前列腺癌细胞miR-191-5p高表达与肿瘤细胞的恶性生物学行为密切相关,其可能通过调控细胞增殖和凋亡参与前列腺癌的发生、发展,是一个具有原癌基因作用的miRNA。
综上所述,miR-191-5p在前列腺癌细胞中表达升高;敲低miR-191-5p表达可抑制前列腺癌细胞增殖并促进其凋亡。
参考文献:
[1] Kumar B, Lupold SE. MicroRNA expression and function in prostate cancer: a review of current knowledge and opportunities for discovery[J]. Asian J Androl, 2016,18(4):559-567.
[2] Elyakim E, Sitbon E, Faerman A, et al. Hsa-miR-191 is a candidate oncogene target for hepatocellular carcinoma therapy[J]. Cancer Res, 2010,70(20):8077-8087.
[3] He Y, Cui Y, Wang W, et al. Hypomethylation of the hsa-miR-191 locus causes high expression of hsa-mir-191 and promotes the epithelial-to-mesenchymal transition in hepatocellular carcinoma [J]. Neoplasia, 2011,13(9):841-853.
[4] Hauser S, Wulfken L, Holdenrieder S, et al. Analysis of serum microRNAs (miR-26a-2*, miR-191, miR-337-3p and miR-378) as potential biomarkers in renal cell carcinoma[J]. Cancer Epidemiol, 2012,36(4):91-94.
[5] Mar-Aguilar F, Luna-Aguirre CM, Moreno-Rocha JC, et al. Differential expression of miR-21, miR-125b and miR-191 in breast cancer tissue[J]. Asia Pac J Clin Oncol, 2013,9(1):53-59.
[6] Patnaik SK, Kannisto E, Yendamuri S. Overexpression of microRNA miR-30a or miR-191 in A549 lung cancer or BEAS-2B normal lung cell lines does not alter phenotype [J]. PLoS One, 2010,5(2):e9219.
[7] Nagpal N, Kulshreshtha R. miR-191: an emerging player in disease biology[J]. Front Genet, 2014(5):99.
[8] Luu H, Lin H, Sørensen K, et al. miRNAs associated with prostate cancer risk and progression[J]. BMC Urol, 2017,17(1):18.
[9] Volinia S, Calin G, Liu C, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci U S A, 2006,103(7):2257-2261.
[10] Grozescu T, Popa F. Prostate cancer between prognosis and adequate/proper therapy [J]. J Med Life, 2017,10(1):5-12.
[11] Rupaimoole R, Slack F. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nat Rev Drug Discov, 2017,16(3):203-222.
[12] Matin F, Jeet V, Clements JA, et al. MicroRNA theranostics in prostate cancer precision medicine[J]. Clin Chem, 2016,62(10):1318-1333.
[13] Kumar B, Lupold SE. MicroRNA expression and function in prostate cancer: a review of current knowledge and opportunities for discovery[J]. Asian J Androl, 2016,18(4):559-567.
[14] Sharma S, Nagpal N, Ghosh PC, et al. P53-miR-191-SOX4 regulatory loop affects apoptosis in breast cancer[J]. RNA, 2017,23(8):1237-1246.
[15] Li H, Zhou ZQ, Yang ZR, et al. MicroRNA-191 acts as a tumor promoter by modulating the TET1-p53 pathway in intrahepatic cholangiocarcinoma [J]. Hepatology, 2017,66(1):136-151.
