红霉素对烟草烟雾刺激下人巨噬细胞TNF-α释放的抑制作用及其机制
2018-05-15邱居烽李梅华钟小宁文明智马南唐晓娟黄梅梁权
邱居烽,李梅华,钟小宁,文明智,马南,唐晓娟,黄梅,梁权
(广西医科大学第一附属医院,南宁530021)
慢性阻塞性肺疾病(COPD)是一种具有气流受限特征的肺部疾病,其发病机制与免疫反应、氧化应激、蛋白酶与抗蛋白酶失衡等有关[1]。吸烟可通过多种途径参与COPD的发生。研究证实,烟草烟雾吸入可诱发气道炎症反应,在此过程中巨噬细胞可分泌多种细胞因子和炎症介质,如TNF-α、IL-8、IL-6等,导致炎症细胞募集、浸润和激活,继而引起气道结构破坏[2]。近年研究发现,长期小剂量应用大环内酯类抗生素(如红霉素)可通过抑制炎症介质的产生而抑制气道炎症反应[3,4]。2016年6月~2017年5月,本研究观察了红霉素对烟草烟雾提取物(CSE)刺激下人巨噬细胞TNF-α释放的影响,现分析结果并探讨红霉素抑制气道炎症反应的作用机制。
1 材料与方法
1.1 材料 人类单核细胞株U937(以下称U937细胞),购自中国科学院细胞库。真龙牌过滤型香烟(焦油量15 mg,烟碱量1.2 mg),广西卷烟总厂。红霉素、曲古霉素A(TSA)、佛波酯,美国Sigma公司。ELx800全自动酶标仪,美国BioTek公司;DYY-7C电泳仪,北京六一生物科技有限公司;5813R高速离心机,艾本德中国有限公司;E-Gel Imager凝胶成像系统,赛默飞世尔科技(中国)有限公司。MTT细胞增殖及细胞毒性检测试剂盒,上海碧云天生物技术有限公司;TNF-α ELISA检测试剂盒,美国R&D Systems公司;全蛋白提取试剂盒,美国Pierce公司;兔抗组蛋白去乙酰化酶1(HDAC1)多克隆抗体、兔抗NF-κB多克隆抗体,美国Santa Cruz公司;山羊抗兔IgG,美国Pierce公司。
1.2 CSE溶液制备 CSE溶液制备参照Mercado等[5]的方法:实验前1 h,将2支点燃的去过滤嘴香烟连于一抽吸驱动装置,反复缓慢抽吸,使其烟雾通过10 mL RPMI 1640培养液中制成CSE悬液,调整悬液pH值至7.4,在超净台中经0.22 μm无菌微孔滤膜过滤,即为CSE原液。用RPMI 1640培养液将CSE原液浓度稀释至10%备用。
1.3 红霉素、CSE溶液抑制巨噬细胞增殖活性的最佳作用浓度和作用时间筛选 将U937细胞接种于含10% FBS的RPMI 1640完全培养基中,置于37 ℃、5% CO2细胞培养箱中培养,2~3天传代。取传2代对数生长期细胞,接种于96孔板,每孔(0.5~1)×104个,然后加入200 ng/mL佛波酯溶液10 μL,诱导分化24 h即可分化为巨噬细胞[6]。将分化的巨噬细胞分为两部分,一部分分别加入使细胞干预终浓度为0.1、1、10 μg/mL红霉素溶液[7],另一部分分别加入使细胞干预终浓度为0.1%、1%、2.5% CSE溶液,两部分均设置阴性对照孔,每个浓度设3个复孔;分别于孵育24、48、72 h,每孔加入5 mg/mL MTT溶液,继续培养4 h,弃去上清液,加入DMSO 150 μL,振荡混匀。酶标仪450 nm波长处检测各孔的光密度(OD)值。以OD450值代表细胞增殖活性。结果见表1、2。结果显示,2.5% CSE溶液作用24、48、72 h均能明显抑制巨噬细胞增殖活性(P均<0.05),而0.1、1、10 μg/mL红霉素溶液和0.1%、1% CSE溶液对巨噬细胞增殖活性影响不大(P均>0.05)。为使CSE和红霉素作用于U937细胞时尽可能发挥各自作用,又不影响细胞增殖活性,故选用干预终浓度为1 μg/mL红霉素溶液和1% CSE溶液、作用时间24 h进行后续实验。

表1 不同浓度红霉素溶液作用24、48、72 h巨噬细胞增殖活性比较
注:不同浓度红霉素溶液细胞增殖活性两两比较,P均>0.05。
1.4 细胞分组处理 取传2代对数生长期U937细胞,接种于含10% FBS RPMI 1640完全培养基的培养瓶中,每瓶(0.5~0.6)×107个,按1.3中的方法诱导分化为巨噬细胞,并随机分为空白对照组、CSE组、红霉素+CSE组、TSA组。空白对照组不予处理;CSE组加入1% CSE溶液孵育24 h;红霉素+CSE组先加入1 μg/mL红霉素溶液预孵育24 h,再加入1% CSE溶液孵育24 h;TSA组加入100 ng/mL TSA孵育24 h。

表2 不同浓度CSE溶液作用24、48、72 h巨噬细胞增殖活性比较
注:与阴性对照同期比较,*P<0.05;与0.1% CSE溶液同期比较,#P<0.05;与1% CSE溶液同期比较,△P<0.05;与同浓度作用48 h比较,▲P<0.05;与同浓度作用72 h比较,▽P<0.05。
1.5 相关指标观察
1.5.1 培养液上清TNF-α含量 各组细胞孵育结束,收集培养液,4 000×g离心20 min,留取培养液上清。按ELISA试剂盒说明配置标准品,样品孔每孔加入100 μL待测样品,标准品孔每孔加入100 μL倍比稀释好的标准品,37 ℃温育2 h;每孔加入生物素标记抗体工作液100 μL,37 ℃温育 1 h;弃去孔内液体,洗板3次,每孔加入100 μL辣根过氧化物酶标记链霉亲和素工作液,37 ℃温育1 h;弃去孔内液体,洗板5次,每孔加入90 μL底物溶液,37 ℃避光显色30 min,再加入50 μL终止液终止反应。酶标仪450 nm波长处检测各组OD值。根据标准品OD值绘制标准曲线,计算各组培养液上清TNF-α含量。
1.5.2 细胞HDAC1、NF-κB蛋白表达 采用Western blotting法。各组细胞孵育结束,用预冷的PBS清洗3次,RIPA裂解液提取细胞总蛋白。取细胞总蛋白按4∶1比例加入蛋白上样缓冲液,100 ℃水浴5 min,使蛋白充分变性,- 80 ℃保存。取变性蛋白50 μg行SDS-PAGE,90 V恒压2 h,200 mA恒流70 min;电泳结束,将蛋白电泳产物转印至PVDF膜上,TBST洗膜5 min×5次,用含5%脱脂牛奶的封闭液封闭1 h;TBST洗膜5 min×5次,分别加入含HDAC1(1∶1 000)或NF-κB(1∶1 000)或β-actin(1∶1 000)一抗,4 ℃摇床孵育过夜;次日TBST洗膜5 min×5次,加入山羊抗兔IgG二抗(1∶1 000),常温孵育1 h;TBST清洗,暗室中显影、定影。采用凝胶图像分析系统分析各蛋白电泳条带的灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
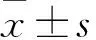
2 结果
2.1 各组培养液上清TNF-α含量比较 空白对照组培养液上清TNF-α含量为(274.96±182.39)pg/mL,CSE组为(744.46±638.38)pg/mL,红霉素+CSE组为(646.57±603.53)pg/mL。组间两两比较P均<0.05。
2.2 各组HDAC1、NF-κB蛋白表达比较 见表3。

表3 各组HDAC1、NF-κB蛋白相对表达量比较
注:与空白对照组比较,*P<0.05;与CSE组比较,#P<0.05;与红霉素+CSE组比较,△P<0.05。
3 讨论
研究发现,COPD患者痰中巨噬细胞数量增多,并且能够通过分泌细胞因子、趋化因子、生长因子等参与炎症应答及免疫调节,与COPD的发病息息相关[2,8]。烟草烟雾能够直接激活巨噬细胞释放细胞因子和炎症介质,如IL-8、TNF-α、CCL2等,进一步导致炎症细胞募集和激活,引起炎症状态持续和组织损伤[9]。既往研究表明,烟草烟雾通过激活巨噬细胞的核因子转录系统(如NF-κB),促进炎症介质释放[10],从而诱导炎症。TNF-α作为重要的促炎因子参与炎症反应中炎症细胞和炎症因子的聚集、释放等,与炎症的维持和发展密切相关。研究表明,烟草烟雾能刺激人巨噬细胞TNF-α释放增加[11]。而TNF-α的释放是由转录因子调控的,已有研究证实,TNF-α释放与NF-κB密切相关,通过钙蛋白酶抑制剂抑制IκBα活性,可减少NF-κB表达,降低NF-κB依赖的炎症因子TNF-α释放[12~14]。
组蛋白去乙酰化酶(HDACs)包括4个组18个亚型,其中Ⅰ型(HDAC1、2、3、8)已被证实在炎症反应中具有重要作用,其与组蛋白乙酰转移酶(HATs)作用相反[15]。HATs相关乙酰化作用使得染色质解螺旋至转录因子和相应RNA聚合酶结合到DNA上促进转录激活,HDACs则通过调节染色质作用增加组蛋白去乙酰化进而抑制转录,抑制炎症应答[15,16]。HDAC1是HDACs的重要亚型,可通过乙酰化作用抑制NF-κB表达和激活,在调节炎症反应过程中至关重要[17]。
临床研究证实,红霉素可作为抗炎和免疫调节剂用于治疗慢性肺部疾病,如COPD、弥漫性泛细支气管炎、支气管哮喘等。红霉素可通过增加HDACs表达及活性,抑制炎症基因转录,减少促炎细胞因子生成和白细胞黏附,加速中性粒细胞死亡和清除,在减轻COPD气道炎症反应中具有重要作用[7,18]。
本研究观察了红霉素对巨噬细胞TNF-α释放及其对HDAC1、NF-κB蛋白表达的影响。结果显示,与空白对照组比较,CSE组和红霉素+CSE组培养液上清TNF-α含量明显增加;而红霉素+CSE组培养液上清TNF-α含量较CSE组明显降低。提示烟草烟雾诱导的炎症反应可能是通过促使巨噬细胞释放炎症介质TNF-α增加导致的,而红霉素能降低巨噬细胞TNF-α释放进而发挥抗炎作用。本研究结果显示,与空白对照组比较,CSE组、红霉素+CSE组NF-κB蛋白表达升高,HDAC1蛋白表达降低,提示烟草烟雾刺激可能通过抑制HDAC1蛋白表达、激活NF-κB信号通路,继而引起炎症应答。TSA是HDAC的特异性抑制剂,本研究以TSA作为阳性对照,结果发现CSE组与TSA组HDAC1蛋白表达均降低,NF-κB蛋白表达均升高,进一步验证了上述结论。本研究还发现,与CSE组比较,红霉素+CSE组NF-κB蛋白表达降低,HDAC1蛋白表达上升,提示红霉素能够通过恢复HDAC1蛋白表达及降低NF-κB蛋白表达进而发挥抗炎作用。研究证实,烟草烟雾诱导的炎症反应过程是通过抑制巨噬细胞HDAC1蛋白表达,激活NF-κB信号通路,进而引起TNF-α释放增加而实现的;红霉素干预可使巨噬细胞HDAC1蛋白表达上调,抑制NF-κB蛋白表达,NF-κB依赖的TNF-α释放减少,继而减轻炎症反应。我们推测这可能是红霉素减轻烟草烟雾刺激诱导炎症反应的分子机制之一。
综上所述,红霉素能抑制烟草烟雾刺激下巨噬细胞TNF-α释放增多,其作用机制可能是通过恢复受烟草烟雾抑制的HDAC1蛋白表达,抑制NF-κB蛋白表达,使NF-κB依赖的TNF-α释放减少,继而减轻炎症反应。本研究为红霉素用于治疗慢性气道炎症性疾病提供了实验依据。
参考文献:
[1] Barnes PJ, Burney PG, Silverman EK, et al. Chronic obstructive pulmonary disease[J]. Nat Rev Dis Primers, 2015(1):15076.
[2] Higham A, Lea S, Ray D, et al. Corticosteroid effects on COPD alveolar macrophages: dependency on cell culture methodology[J]. J Immunol Methods, 2014(405):144-153.
[3] Yao GY, Ma YL, Zhang MQ, et al. Macrolide therapy decreases chronic obstructive pulmonary disease exacerbation: a meta-analysis[J]. Respiration, 2013,86(3):254-260.
[4] Li M, Zhong X, He Z, et al. Effect of erythromycin on cigarette-induced histone deacetylase protein expression and nuclear factor-κB activity in human macrophages in vitro[J]. Int Immunopharmacol, 2012,12(4):643-650.
[5] Mercado N, To Y, Ito K, et al. Nortriptyline reverses corticosteroid insensitivity by inhibition of phosphoinositide-3-Kinase-σ[J]. J Pharmacol Exp Ther, 2011,337(2):465-470..
[6] Taniguchi K, Hikiji H, Okinaga T, et al. Essential role of lysophosphatidylcholine acyltransferase 3 in the induction of macrophage polarization in PMA-Treated U937 Cells[J]. J Cell Biochem, 2015,116(2):2840-2848.
[7] Sun XJ, Li ZH, Zhang Y, et al. Combination of erythromycin and dexamethasone improves corticosteroid sensitivity induced by CSE through inhibiting PI3K-σ/Akt pathway and increasing GR expression[J]. Am J Physiol Lung Cell Mol Physiol, 2015,309(2):139-146.
[8] Moermans C, Bonnet C, Willems E, et al. Sputum cytokine levels in patients undergoing hematopoietic SCT and comparison with healthy subjects and COPD: a pilot study[J]. Bone Marrow Transplant, 2014,49(11):1382-1388.
[9] Caramori G, Adcock IM, Di Stefano A, et al. Cytokine inhibition in the treatment of COPD[J]. Int J Chron Obstruct Pulmon Dis, 2014(9):397-412.
[10] 李梅华,钟小宁,柳广南,等.红霉素抑制肿瘤坏死因子α对人支气管上皮细胞核因子-κB的激活[J].中华内科杂志,2005,44(7):530-531.
[11] Bain WG, Tripathi A, Mandke P, et al. Low-dose oxygen enhances macrophage-derived bacterial clearance following cigarette smoke exposure[J]. J Immunol Res, 2016,2016:1280347.
[12] Li X, Luo R, Chen R, et al. Cleavage of IκBα by calpain induces myocardial NF-κB activation, TNF-α expression, and cardiac dysfunction in septic mice[J]. Am J Physiol Heart Circ Physiol, 2014,306(6):833-843.
[13] Yang BC, Yang ZH, Pan XJ, et al. Crotonaldehyde-exposed macrophages induce IL-8 release from airway epithelial cells through NF-κB and AP-1 pathways[J]. Toxicol Lett, 2013,219(1):26-34.
[14] Gangwani MR, Kumar A. Multiple protein kinases via activation of transcription factors NF-κB, AP-1 and C/EBP-σ regulate the IL-6/IL-8 production by HIV-1 vpr in astrocytes[J]. PLoS One, 2015,10(8):135633.
[15] Barnes PJ. Role of HDAC2 in the pathophysiology of COPD[J]. Annu Rev Physiol, 2009(71):451-464.
[16] Ito K, Ito M, Elliott WM, et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease[J]. N Engl J Med, 2005,352(19):1967-1976.
[17] Schuliga M. NF-κB signaling in chronic inflammatory airway disease[J]. Biomolecules, 2015,5(3):1266-1283.
[18] He ZY, Ou LM, Zhang JQ, et al. Effect of 6 months of erythromycin treatment on inflammatory cells in induced sputum and exacerbations in chronic obstructive pulmonary disease[J]. Respiration, 2010,80(6):445-452.
