128例偶发脑膜瘤患者肿瘤年增长率及其相关因素研究
2018-05-15姥佩佩徐继承
许 阳,姚 祥,滕 雪,张 琳,姥佩佩,徐继承
脑膜瘤是颅内常见的良性肿瘤,占原发性颅内肿瘤的13%~26%[1],其中仅3%~6%患者伴有临床症状[2]。尸检结果显示,无症状脑膜瘤发病率为1.0%~2.3%[3-5]。目前,手术切除肿瘤是脑膜瘤的首选治疗方式,但存在手术风险和并发症发生风险,尤其是老年脑膜瘤患者,故采取保守治疗或手术切除肿瘤孰优孰劣尚未达成一致。本研究旨在分析128例偶发脑膜瘤患者肿瘤年增长率及其相关因素,以为脑膜瘤患者选取合适治疗方案提供参考依据。
1 对象与方法
1.1 研究对象 选取2005—2014年西南医科大学附属医院收治的偶发脑膜瘤患者128例,均采取保守治疗,且经颅脑磁共振成像和CT检查确诊。纳入标准:年龄18~80岁;无下肢深静脉血栓形成(DVT)病史及DVT高危因素。排除临床资料不完整者。
1.2 方法 回顾性分析所有患者临床资料及随访资料,临床资料包括年龄、性别、临床症状、肿瘤位置、初测体积、钙化情况及磁共振成像T2信号情况;所有患者通过电话回访或来院复查等方式进行随访,随访9~102个月,平均随访44个月,其中随访时间>12个月者占93.75%(120/128),随访截至2016年12月。以肿瘤体积增大2.20 cm3定义为肿瘤进展,计算肿瘤无进展生存率,以月为单位。
1.3 肿瘤体积测量 采用颅脑CT和磁共振成像检查脑膜瘤变化情况,采用NIH Image 1.62软件测量肿瘤组织厚度及肿瘤三维参数、图片张数,每个肿瘤体积测量3次取平均值,并计算肿瘤年增长率。
1.4 统计学方法 采用SPSS 17.0统计软件进行数据处理,符合正态分布的计量资料以()表示,采用两独立样本t检验;绘制不同临床特征患者肿瘤无进展生存率比较的Kaplan-Meier生存曲线,并进行log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 本组患者中有临床症状者56例(占43.75%),其中神经病变19例、头痛13例、偶发事件10例、视力障碍9例、癫痫3例、精神状态改变2例;无临床症状者72例(占56.25%)。肿瘤位置:凸面40例(占31.25%),大脑镰28例(占21.87%),小脑脚9例(占7.03%),海绵窦8例(占6.25%),蝶骨18例(占14.06 %),岩斜区7例(占5.47%),鞍部3例(占2.34%),小脑幕5例(占3.95%),其他10例(占7.81%)。
2.2 肿瘤年增长率 本组患者中肿瘤年增长率为0~10%者52例(占40.62%),11%~20%者29例(占 22.66%),21% ~30% 者 18例(占 14.06%),31%~40%者8例(占6.25%),>40%者21例(占16.41%)。
2.3 肿瘤年增长率的相关因素分析 不同年龄患者肿瘤年增长率比较,差异无统计学意义(P>0.05);不同性别、有无临床症状、不同初测体积、有无钙化及不同T2信号患者肿瘤年增长率比较,差异有统计学意义(P<0.05,见表 1)。
表1 不同临床特征患者肿瘤年增长率比较(,%)Table 1 Comparison of annual growth rate in patients with different clinical features
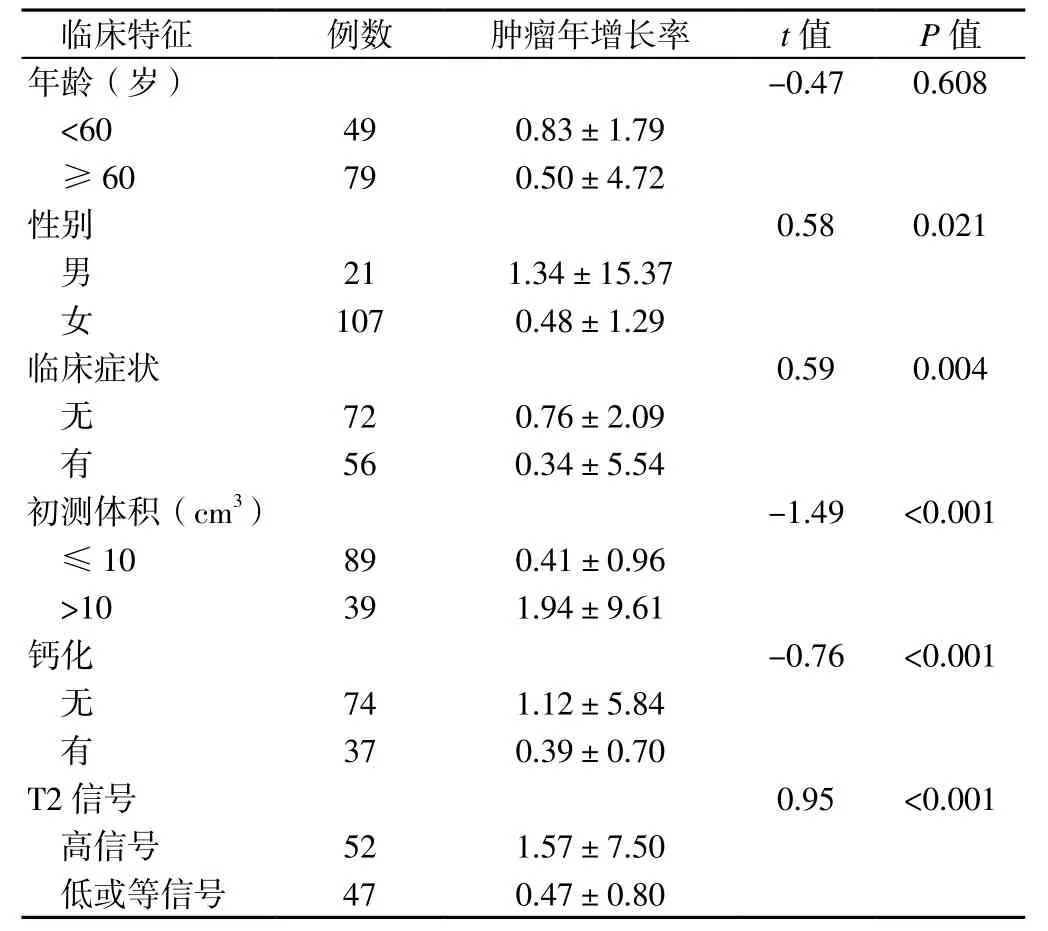
表1 不同临床特征患者肿瘤年增长率比较(,%)Table 1 Comparison of annual growth rate in patients with different clinical features
注:本组17例患者钙化情况不清楚,29例患者T2信号情况不清楚
?
2.4 生存分析 绘制Kaplan-Meier生存曲线显示,不同年龄、不同性别、有无临床症状患者肿瘤无进展生存率比较,差异无统计学意义(χ2值分别为3.492、0.050、0.125,P>0.05);初测体积≤ 10 cm3、钙化、T2 低或等信号患者无进展生存率分别高于初测体积>10 cm3、无钙化、T2高信号患者,差异有统计学意义(χ2值分别为 7.207、14.465、4.335,P<0.05,见图 1)。
3 讨论
近年来,随着磁共振成像和CT检查在临床广泛应用,越来越多的脑膜瘤被偶然发现,其中大部分脑膜瘤属于良性肿瘤,生长缓慢[6]。本组患者中肿瘤位于凸面者占31.25%、大脑镰者占21.87%;本组患者中肿瘤年增长率为0~10%者占40.62%、11%~20%者占22.66%、21% ~ 30% 者 占14.06%、31% ~ 40% 者 占6.25%、>40%者占16.41%,提示脑膜瘤主要累及凸面和大脑镰,且生长较缓慢。

图1 不同临床特征患者肿瘤无进展生存率比较的Kaplan-Meier生存曲线Figure 1 Kaplan-Meier survival curves for comparison of progression-free survival rate in patients with different clinical features
脑膜瘤多发于女性,NIIRO等[7]研究结果显示,女性脑膜瘤发病率是男性的4倍,分析其原因可能与女性雌激素、孕激素水平较高有关。NAKASU等[8]研究结果显示,部分更年期女性脑膜瘤呈指数增长,分析其原因可能与端粒长度有关,但尚无临床研究证实。既往研究结果显示,男性脑膜瘤患者肿瘤年增长率高于女性,且侵袭性肿瘤所占比例较高,特别是有临床症状的男性患者[1],但本研究结果显示,不同性别患者肿瘤无进展生存率间无差异,具体原因尚需进一步分析。本研究结果还显示,不同年龄患者肿瘤年增长率间无差异,进一步绘制Kaplan-Meier生存曲线发现,不同年龄患者肿瘤无进展生存率间亦无差异,提示年龄对脑膜瘤增长率无明显影响,与既往研究结果相一致[9]。但KASUYA等[10]认为年龄是预测肿瘤生长的重要因素,青年脑膜瘤患者肿瘤绝对增长率较高、倍增时间较短、术后肿瘤增长潜力较大。OYA等[11]研究结果显示,临床症状不是脑膜瘤增长的独立危险因素,本研究结果与之相一致。
从肿瘤生物学发展角度考虑,肿瘤越大越有可能成为静止的增殖细胞,不会有过多细胞进入增殖周期,如此时进行手术切除则可能导致更多静止的增殖细胞进入增殖周期。NAKAGUCHI等[12]研究结果显示,脑膜瘤复发患者术后肿瘤增长潜力较大。VAN HAVENBERGH等[13]研究认为,中小型体积脑膜瘤增长率较高。本研究结果显示,初测体积>10 cm3患者肿瘤年增长率高于初测体积≤10 cm3患者,肿瘤无进展生存率低于初测体积≤10 cm3患者,分析其原因可能与本组患者侵袭性肿瘤及中型脑膜瘤患者较多有关。
既往研究结果显示,发生钙化和磁共振成像T2低或等信号的脑膜瘤增长潜力较小[14-16];T1信号高低与WHO Ⅰ级肿瘤无关,但T2信号高低与WHOⅠ级肿瘤有关,且侵袭性脑膜瘤更易出现T2高信号[17]。本研究结果显示,钙化、T2低或等信号患者无进展生存率分别高于无钙化、T2高信号患者,提示无钙化和伴有T2高信号的脑膜瘤患者肿瘤增长潜力较大。组织学研究结果显示,脑膜瘤主要来源于蛛网膜帽状细胞和蛛网膜小梁,凸面蛛网膜和颅底蛛网膜可能起源于不同胚胎层,故颅内不同部位脑膜瘤增长率不同。多数研究结果显示,颅底脑膜瘤更易呈指数形式增长[18-20],但本研究未进一步分析肿瘤位置与脑膜瘤增长率间的关系。
综上所述,偶发脑膜瘤生长速度较缓慢,但初测体积较大、无钙化、磁共振成像T2高信号的偶发脑膜瘤患者肿瘤年增长率较高,需引起临床重视。HASHIBA等[21]建议在初步诊断脑膜瘤后2~3个月复查,如肿瘤体积无明显增长则可间隔6个月~1年复查1次;但若患者临床症状较严重或怀疑肿瘤侵袭性较高时需尽早手术切除。本研究为回顾性研究,存在一定选择偏倚;肿瘤体积计算主要依靠影像学检查,可能存在误差;样本量较小,可能影响结果准确性。
作者贡献:许阳进行文章的构思与设计,研究的实施与可行性分析,结果分析与解释,负责撰写论文;姚祥进行数据收集、整理、分析;滕雪、张琳、姥佩佩进行论文的修订,负责文章的质量控制及审校;徐继承对文章整体负责,监督管理。
利益冲突:笔者2011年9月—2015年6月就读于西南医科大学,本研究病例来源于西南医科大学附属医院,并通过西南医科大学附属医院医学伦理委员会审核批准,无利益冲突。
参考文献
[1]LOUIS D N,SCHEITHAUER B W,BUDKA H,et al.WHO Classification of Tumours:Pathology and Genetics of Tumours of the Nervous System[M].Lyon:IARC Press,2000:176-184.
[2]YANO S,KURATSU J,The Kumamoto Brain Tumor Research Group.Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience[J].J Neurosurg,2006,105(4):538-543.
[3]BELLULAR S N,CHANDRA V.Meningioma size.Its relationship to other diseases[J].Arch Neurol,1981,38(7):458-459.
[4]NAKASU S,HIRANO A,SHIMURA T,et al.Incidental meningiomas in autopsy study[J].Surg Neurol,1987,27(4):319-322.
[5]RAUSING A,YBO W,STENFLO J.Intracranial meningioma——a population study of ten years[J].Acta Neurol Scand,1970,46(1):102-110.
[6]NAKAMURA M,ROSER F,MICHEL J,et al.The natural history of incidental meningiomas[J].Neurosurgery,2003,53(1):62-71.
[7]NIIRO M,YATSUSHIRO K,NAKAMURA K,et al.Natural history of elderly patients with asymptomatic meningiomas[J].J Neurol Neurosurg Psychiatry,2000,68(1):25-28.
[8]NAKASU S,FUKAMI T,NAKAJIMA M,et al.Growth pattern changes of meningiomas:long-term analysis[J].Neurosurgery,2005,56(5):946-955.
[9]AGUIAR P H,TSANACLIS A M,TELLA O I Jr,et al.Proliferation rate of intracranial meningiomas as defined by the monoclonal antibody MIB-1:correlation with peritumoural oedema and other clinicoradiological and histological characteristics[J].Neurosurg Rev,2003,26(3):221-228.
[10]KASUYA H,KUBO O,TANAKA M,et al.Clinical and radiological features related to the growth potential of meningioma[J].Neurosurg Rev,2006,29(4):293-297.
[11]OYA S,KIM S H,SADE B,et al.The natural history of intracranial meningiomas[J].J Neurosurg,2011,114(5):1250-1256.DOI:10.3171/2010.12.JNS101623.
[12]NAKAGUCHI H,FUJIMAKI T,MATSUNO A,et al.Postoperative residual tumor growth of meningioma can be predicted by MIB-1 immunohistochemistry[J].Cancer,1999,85(10):2249-2254.
[13]VAN HAVENBERGH T,CARVALHO G,TATAGIBA M,et al.Natural history of petroclival meningiomas[J].J Neurosurgery,2003,52(1):55-64.
[14]HASHIMOTO N,RABO C S,OKITA Y,et al.Slower growth of skull base meningiomas compared with non-skull base meningiomas based on volumetric and biological studies[J].J Neurosurg,2012,116(3):574-580.DOI:10.3171/2011.11.JNS11999.
[15]ZEIDMAN L A,ANKENBRANDT W J,DU H,et al.Growth rate of non-operated meningiomas[J].J Neurol,2008,255(6):891-895.DOI:10.1007/s00415-008-0801-2.
[16]彭德昌,龚洪翰,张宁.完全钙化性脑膜瘤的CT和MRI诊断[J].中国临床医学影像杂志,2012,23(8):538-540.DOI: 10.3969/j.issn.1008-1062.2012.08.003.
[17]刘忆,漆松涛,张喜安.不同病理类型脑膜瘤的MRI特点及其临床意义[J].中华神经外科杂志,2011,27(8):824-827.DOI:10.3760/cma.j.issn.1001-2346.2011.08.025.
[18]ROSER F,SAMII M,OSTERTAG H,et al.The Ki-67 proliferation antigen in meningiomas.Experience in 600 cases[J].Acta Neurochir(Wien),2004,146(1):37-44.
[19]KANE A J,SUGHRUE M E,RUTKOWSKI M J,et al.Anatomic location is a risk factor for atypical and malignant meningiomas[J].Cancer,2011,117:1272-1278.DOI:10.1002/cncr.25591.
[20]MCGOVERN S L,ALDAPE K D,MUNSELL M F,et al.A comparison of World Health Organization tumor grades at recurrence in patients with non-skull base and skull base meningiomas[J].J Neurosurg,2010,112(2):925-933.DOI:10.3171/2009.9.JNS09617.
[21]HASHIBA T,HASHIMOTO N,IZUMOTO S,et al.Serial volumetric assessment of the natural history and growth pattern of incidentally discovered meningiomas[J].J Neurosurgery,2009,110(4):675-684.DOI:10.3171/2008.8.JNS08481.
