染色体核型分析和荧光原位杂交技术对慢性粒细胞性白血病的诊治意义
2018-05-15吴莉芳饶若王述文夏梦娟姚红霞
吴莉芳,饶若,王述文,夏梦娟,姚红霞
(海南省人民医院 血液病研究室,海南 海口 570311)
慢性粒细胞性白血病(chronic myeloid leukemia,CML)具有特异性的Ph染色体和/或具有BCR/ABL融合基因[1]。Ph染色体是第9号与第22号染色体相互易位形成,BCR/ABL融合基因是由第9号染色体上的原癌基因与第22号染色体上的BCR基因相互易位形成[2]。根据BCR断裂点的不同,可形成3种类型的融合基因,分别是m-型、M-型及μ型, 相应翻译成P190、P210及P230融合蛋白[3]。该文探讨染色体核型分析和荧光原位杂交(fluorescence in situ hybridization,FISH)2种方法在CML诊治中的价值。
1 资料与方法
1.1 研究对象
选取2011年7月-2014年12月海南省人民医院门诊及住院CML患者218例。其中,男性126例,女性92例;年龄7~82岁,中位年龄41岁。本研究统计的数据均按标本接收顺序收录,未进行人工筛选取舍。
1.2 方法
1.2.1 骨髓形态学分析将骨髓涂片瑞氏染色,光学显微镜下观察200个细胞分类计数。外周血涂片碱性磷酸酶染色,光学显微镜下观察100个细胞,积分统计,综合进行FAB分型。将CML患者按照血液病诊断及疗效标准[1]划分为慢性期(chronic myeloid leukemia-chronic phase,CML-CP),加速期(chronic myeloid leukemia-acceleration phase,CML-AP),急变期(chronic myeloid leukemia-blastic phase,CML-BP)。CML患者治疗后的骨髓片参照疗效标准分为血液学完全缓解(chronic myeloid leukemia-complete response,CML-CR)、部分缓解、未缓解。
1.2.2 染色体核型分析取患者骨髓细胞,采用直接法和24 h短期培养法制备染色体,R显带技术进行染色体核型分析。核型异常按人类细胞遗传学国际命名体制[ISCN(2005)]加以描述。诊断标准为≥3个细胞有一致的染色体丢失,≥2个细胞有同样的染色体增加或结构异常[4]。剩余细胞悬液保存于-20℃备用。
1.2.3 FISH采用荧光素标记的位点特异性ES探针GLPBCR/GLPABL(中国北京金菩嘉医疗器械有限公司)。按试剂盒说明书进行操作。
1.2.4 图像扫描用Olympus BX51(日本Olympus公司)荧光显微镜在UV/Rhodamine/FITC三色滤光片的激发下观察荧光杂交信号,每例分析200个细胞,用染色体分析系统VideoTesT-FISH 2.0(俄罗斯VideoTesT公司)进行图像采集和保存。
1.2.5 图像分析及结果判读红色信号为ABL探针,位于9号染色体。绿色信号为BCR探针,位于22号染色体。当红色信号与绿色信号重叠时显示黄色,即为融合信号。正常细胞的信号为2个红色信号和2个绿色信号,无融合信号。异常细胞信号为:①2个红色信号、1个绿色信号、1个黄色信号,提示主要断裂点M-型,产生P210融合蛋白;②1个红色信号、1个绿色信号、1个黄色信号,提示der(9)存在序列缺失(ABL或ASS基因缺失);③1个红色信号、1个绿色信号、2个黄色信号,提示次要断裂点m-型,产生P190融合蛋白。>8%细胞出现融合信号(黄色)即判断为阳性结果。
1.3 统计学方法
数据处理采用SPSS16.0统计软件,计数资料以率(%)表示,比较做χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨髓形态学FAB分型
本研究收集218例CML患者标本,其中CMLCP初 诊 94例(43%);CML-AP 7例(3%);CMLBP 16例(7%)。CML-CR复查 33例(15%)。68例(31%)复查患者的骨髓片不符合正常骨髓象,也不符合CML-AP和CML-BP骨髓象的特点,将其归为CML-CP。
2.2 染色体核型分析检出率
2.2.1 Ph染色体171例CML标本做染色体核型分析,116例检出ph染色体,检出率为68%。其中,CML-CP初诊、CML-AP、CML-BP、CML-CP复查、CML-CR患者的Ph染色体检出率分别为80%、100%、85%、60%和28%。
2.2.2 其他异常核型171例CML患者标本中,22例存在其他异常核型。附表列出了18例具有代表性的异常核型,包括除典型9,22易位以外的所有其他染色体结构及数量改变,如变异易位、复杂易位、隐匿易位等。
2.2.3 未检出171例CML患者标本中,22例标本因分裂相少,质量差,未能找到可分析的分裂相。
2.3 FISH检出率
218例CML患者标本做FISH,无不可检测标本,174例检出BCR/ABL基因,检出率为80%。其中CML-CP初诊、CML-AP、CML-BP、CML-CP复查、CML-CR患者检出率分别为93%、100%、100%、75%和39%。1例CML-BP患者检出der(9)部分序列缺失,且产生的融合蛋白类型为P190。
2.4 染色体核型分析与FISH的检出率比较
FISH对BCR/ABL融合基因的检出率与染色体核型分析对Ph染色体的检出率比较,差异有统计学意义(χ2=7.249,P=0.007),FISH高于染色体核型分析。见附图。
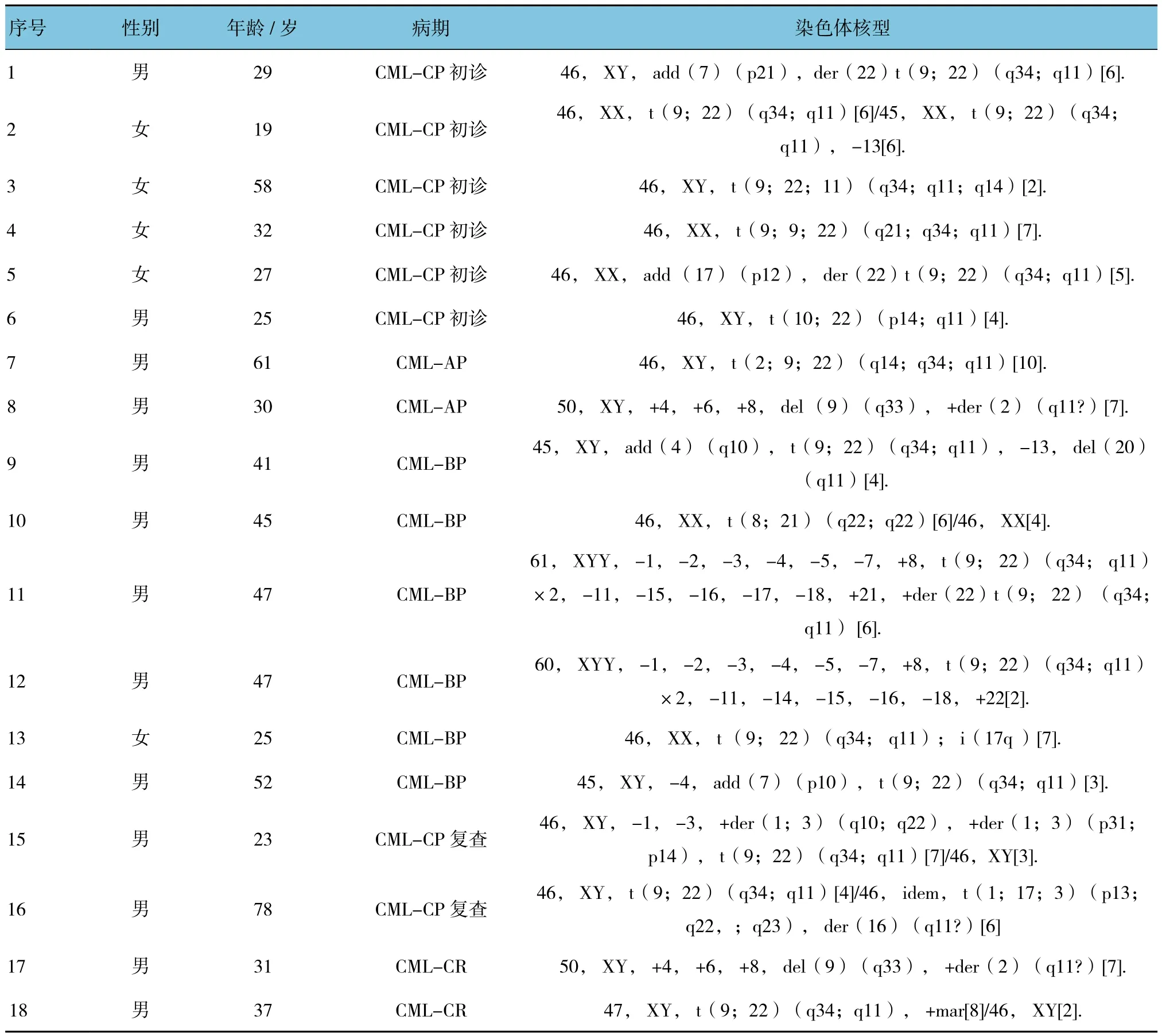
附表 18例伴有其他核型异常的CML患者
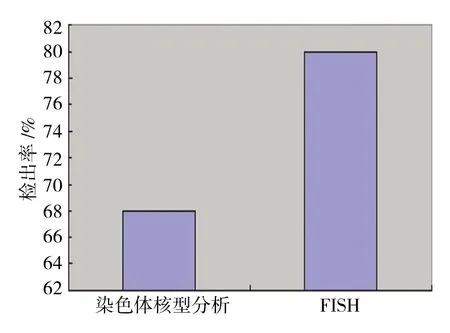
附图 染色体核型分析与FISH的检出率比较
3 讨论
3.1 染色体核型分析
本研究中,其他异常核型的检出率占13%,高于谢新等[5]的报道。本实验在CML的各个分期中均检出其他异常核型,与吴蔚等[6]的报道一致。本研究发现,在CML-AP和CML-BP患者中,其他异常核型检出率高于CML-CP初诊患者,与谢新等[5]的报道是一致。其他异常核型包括已报道的2Ph,+8,+21及i(17q)[5,7],也有3条染色体间的复杂易位,如t(9;22;11)(q34;q11;q14)、t(9;9;22)(q21;q34;q11),以及 t(2;9;22)(q14;q34;q11)。
3.2 FISH
本研究发现CML-CP初诊患者与CML-AP患者的BCR/ABL融合基因检出率与文献的报道一致,CML-BP患者的BCR/ABL融合基因检出率高于文献报道,CML-CR患者的BCR/ABL融合基因检出率低于文献报道[8]。
CML的BCR/ABL融合基因由主要断裂点断裂产生,其蛋白表达产物是P210。RAVANDI等[9]统计>1 000例CML患者,发现CML断裂点位于主要断裂点以外的发生率<1%,位于次要断裂点的发生率更小。本研究结果表明,3.00% CML患者BCR/ABL融合基因产生的蛋白类型为P210共表达P190,0.95%CML患者BCR/ABL融合基因产生的蛋白类型为P190。
SINCLAIR等[10]首先发现并报道der(9)部分序列缺失与患者的生存率和疾病进展关系密切,是一项强有力的负性预后因素。本研究发现,18% CML患者存在der(9)部分序列缺失,与吴炜等[11]的报道一致。其中,20% CML-CP、67% CML-AP、33% CML-BP、12% CML-CP复查、10% CML-CR患者存在der(9)部分序列缺失。结果表明,CML-AP和CML-BP的患者更易发生der(9)部分序列缺失,与董洁等[12]的报道一致。
3.3 2种检测方法比较
171例CML患者标本同时应用染色体核型分析与FISH检测,其中8例标本(4.6%)的染色体核型分析为正常核型,但BCR/ABL融合基因阳性,提示有隐蔽的BCR/ABL基因重排,与孙川等[7]的发现一致。FISH有助于可疑CML的诊断[13],在CML的疗效监测中具有更好的优势[14]。
FISH可以通过对探针序列的巧妙设计,不同的信号方式提示更丰富的信息。既可以检测BCR基因断裂的位置,又可检测der(9)的部分序列缺失。但是,往往复杂的信号方式解读须参考染色体核型分析的结论。
171例染色体核型分析的CML患者标本中,22例标本因分裂相少,质量差,未能找到可分析分裂相。而FISH不受细胞分裂期的影响,可以分析处于各个分裂期的细胞。
染色体核型分析可以发现其他异常核型,能够全面了解染色体核型情况,但FISH只能检测BCR/ABL融合基因及其相关序列。
综上所述,染色体核型分析与FISH 2种遗传学检测方法分别提示不同的遗传信息,两者联合应用可为临床对CML的诊断、用药及预后提供可靠的依据。
参 考 文 献:
[1]张之南, 沈悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社, 2007:134-138.
[2]MICHAEL W N, JOHN D, GODMAN M, et al.The molecular biology of chronic myeloid leukemia[J].Blood, 2000, 96(10):3342-3343.
[3]MELO J V.The diversity of BCR-ABL fusion proteins and their relationship to leukemia phenotype[J].Blood, 1996, 88(7):2375-2384.
[4]薛永权.白血病细胞遗传学及图谱[M].天津:天津科学技术出版社, 2003:46-61.
[5]谢新, 过宇, 薛永权.600例慢性粒细胞性白血病的细胞遗传学分析[J].中华医学遗传学杂志, 1998, 15(2):85-88.
[6]吴蔚, 顾健, 马莉, 等.细胞遗传学检测在慢性粒细胞性白血病中的应用价值[J].中华全科医学, 2015, 13(8):1320-1322.
[7]孙川, 李倩, 林颖, 等.慢性粒细胞性白血病额外染色体异常在加速期和急变期的意义[J].医学研究杂志, 2014, 43(1):108-110.
[8]张济, 李君君, 颜家运, 等.荧光原位杂交仔慢性粒细胞性白血病细胞BCR/ABL融合基因检测中的应用及其意义[J].实用医学杂志, 2012, 28(5):825-827.
[9]RAVANDI F, CORT ES J, ALBITAR M, et al.Chronic myelogenous leukaemia with p185BCR-A BL expression:characteristics and clini cal significance[J].Br J Haematol, 1999,107:581-586.
[10]SINCLAIR P B, NACHEVA E P, LEVERSHA M, et al.Large deletions at the t (9; 22) breakpoint are common and may identify a poor-prognosis subgroup of patients with chronic myeloid leukemia[J].Blood, 2000, 95:738-744.
[11]吴炜, 薛永权, 吴亚芳, 等.Ph染色体阳性慢性粒细胞白血病衍生9号染色体缺失的FISH研究[J].中华血液学杂志, 2006,27:183-186.
[12]董洁, 李薇, 白晶, 等.9号衍生染色体在慢性粒细胞白血病预后评估中的意义[J].吉林大学学报, 2016, 42(2):301-304.
[13]BACCARANI M, DEININGER M W, ROSTI G, et a1.European leukemia net recommendations for the management of chronic myeloid leukemia, 2013[J].Blood, 2013, 122(6), 872-884.
[14]National Comprehensive Cancer Network.NCCN clinical practice guidelines in oncology, chronic myelogenous leukemia version 2:2014 [S/OL].[2015-03-24].http://www.nccn.org/NCCN GuidelinesTM & Clinical Resources.
