EGFR TKIs联合化疗的给药顺序对NSCLC细胞促凋亡的影响
2018-05-15高峰张泽峰王涛王瑞
高峰,张泽峰,王涛,王瑞
(河北医科大学第四医院 胸外一科,河北 石家庄 050011)
表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞具有对EGFR络氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)高度敏感的反应特性[1]。由于患者对EGFR TKIs具有极高的耐受性,以及其对无进展生存期的显著改善,一线应用EGFR TKIs成为晚期NSCLC患者的标准化治疗方案[2-3],但是患者在接受9~13个月的EGFR TKIs治疗后,开始出现获得性TKIs耐药[4-5]。持续用药后难以回避的耐药成为制约TKIs应用的最大瓶颈[6]。根据实体瘤疗效评价标准,肿瘤耐药后,继续应用EGFR TKI单药或者联合其他治疗方式依旧值得考虑[7],为此,本文探究EGFR TKIs联合化疗的不同给药方案对NSCLC细胞系促凋亡的影响。
1 材料与方法
1.1 细胞系和试剂
EGFR突变的NSCLC细胞系:PC9(19号外显子突变)、H1975(L858R+T790M突变)、HCC827(19号外显子突变)和HCC827GR(19号外显子突变+cMET扩增)由广东肺癌研究所馈赠。PC9ER(19号外显子突变+T790M突变)由郑州大学医学科学院临床药理研究所馈赠。
厄洛替尼、WZ4002、顺铂和紫杉醇购自武汉永璨生物科技有限公司,溶于DMSO或水(顺铂),小剂量分装存储于-20℃冰箱。
1.2 MTS细胞毒性试验
各细胞系用含10%胎牛血清(四季青,浙江天杭生物科技有限公司)的DMEM高糖培养基(美国HyClone公司)在37℃、5%二氧化碳CO2细胞培养箱(美国Thermo公司Forma Steri-Cult型)中培养。待细胞处于对数生长期时,取96孔细胞培养板,加入100μl/孔含1×104个细胞的完全培养基铺板,培养 72 h后,PC9、PC9ER、HCC827、HCC827GR 及H1975细胞分别加入顺铂(终浓度为0.01、0.10、1.00和10.00μmol/L)或紫杉醇(终浓度为0.001、0.010和0.100μmol/L),各处理组设置3~6个复孔。药物处理72 h后,加入20μl/孔MTS复合物(美国Promega公司)继续培养4 h后显色。检测前摇晃培养板10 s,混匀颜色。用酶标仪(美国Bio-TeK公司Elx800型)于490 nm波长处检测吸光度值。实验重复3次,结果用Graph Pad Prism软件进行分析,使用非线性回归模型对曲线进行拟合。各药物处理组相对空白对照组减少的细胞数用百分比表示。
1.3 集落形成试验
待细胞处于对数生长期时,取24孔细胞培养板,加入500μl/孔含1×103个细胞的完全培养基铺板,不同药物处理组设置≥2个复孔,实验重复3遍。7 d后抽弃药物,更换为完全培养基,使细胞培养增殖。当细胞克隆生长出现差异时,弃培养基,用PBS缓冲液冲洗2次,甲醇固定,0.005%结晶紫(德国默克公司)对细胞核染色后用倒置显微镜(日本奥林巴斯公司,IX83)拍照。显微镜下计数<50个细胞克隆数,计算集落形成率。集落形成率(%)=(集落数/接种细胞数)×100%。
1.4 Western bolt检测
将细胞以2×105个/孔铺于6孔板,1 ml/孔铺于完全培养基。待其贴壁生长1~2 d后进行相应药物干预。用PBS缓冲液冲洗3次,使用细胞裂解液进行裂解。使用Bio-Rad蛋白分析仪(美国Bio Rad公司,Hercules)在595 nm波长处测定各组蛋白浓度。将各组蛋白用去离子水平衡后,加入3×蛋白分离缓冲液煮沸5min,-80℃存储。
取5μl蛋白Marker,以及包含不加药对照组在内的6组各25μl样品上样,进行SDS-聚丙烯酰氨凝胶电泳,然后电转于PVDF膜。将膜封闭处理以防抗体非特异性结合,4℃一抗孵育过夜。次日,充分洗膜后,加入含辣根过氧化物酶HRP标记的二抗,避光孵育1 h后洗膜,最后暗室曝光,晾干胶片后,扫描。实验独立重复3次,采用Image J软件对灰度值进行分析。
抗体的使用:cPARP、ERK1/2和兔抗IgG HRP-抗体(英国Abcam公司)溶于5% BSA的TBST溶液中,稀释倍数分别为1∶10 000、1∶3 000和1∶5 000。
1.5 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 EGFR突变细胞系对不同浓度EGFR TKIs和化疗药物的耐受性
为建立药物细胞毒性梯度,本实验首先采用顺铂或紫杉醇处理EGFR突变细胞系72 h,采用MTS法检测细胞活性变化。结果:①当采用顺铂干预时,对照组细胞活力为(1.36±5.92)%,而干预组为(-7.32±6.81)%,经t检验,差异有统计学意义(t=2.353,P=0.040)。浓度达 1μmol/L即可对 PC9和PC9ER细胞产生毒性作用。对于其他细胞系,顺铂浓度>3.3μmol/L才能检测到细胞毒性(见图1A)。②当采用紫杉醇对细胞进行干预时,3.3μmol/L浓度下能检测到细胞毒性,且PC9对紫杉醇最为敏感(见图1B)。③在集落形成试验中,笔者同样对各细胞系进行更长时间的顺铂、紫杉醇和EGFR TKIs干预。顺铂在7 d的集落形成试验中对受测细胞系产生的细胞毒性与MTS法结果相似(见图1C)。由于H1975对紫杉醇高度敏感,而无法判断给药顺序差异对其产生的细胞毒性影响。耐药细胞系(PC9ER、HCC827GR和H1975)对厄洛替尼高度耐受,但PC9ER对WZ4002却极为敏感。
总之,对EGFR TKIs敏感和耐药的PC9、HCC827细胞系在对化疗药物的敏感性上几乎没有差别,说明TKI与化疗药物的敏感及耐药机制并不相同(见图1A、B)。为了后续试验,本实验选择顺铂干预PC9和其他细胞系的浓度分别为1.0和3.3μmol/L;选取不仅能够对全系细胞产生细胞毒性且不会导致细胞全部死亡的紫杉醇浓度为3.3μmol/L。对于EGFR TKIs,笔者总结前人和自己的研究结果,选取能够使敏感和耐受细胞系产生最大细胞毒性差异的厄洛替尼和WZ4002,浓度均为1μmol/L。
2.2 EGFR TKIs和化疗不同给药顺序对细胞毒性的影响
为探究EGFR TKIs和化疗不同给药顺序对各EGFR突变细胞系的影响,本实验将药物单用、联用,以及顺序给药干预各细胞系7 d,并采用集落形成试验进行分析。对照组细胞活力为(0.56±1.86)%,而干预组为(-7.06±5.91)%,经t检验,差异有统计学意义(t=3.013,P=0.013),HCC827GR、H1975细胞对顺铂和紫杉醇具有更高的敏感性,特别是在PC9或PC9ER细胞中,厄洛替尼或WZ4002与顺铂或紫杉醇联用比单用能产生更强的细胞毒性。当EGFR TKIs和化疗药物顺序给药时,在TKI干预前先给予化疗比两者顺序颠倒能产生更强的细胞毒性。实际上,在大多数情况下,先TKI后化疗的给药顺序完全屏蔽了后者对细胞产生的毒性作用。相似的结果也出现在那些对EGFR TKIs耐药和特殊的突变抑制剂WZ4002干预的细胞系中。在预实验中,笔者同样检测了联合用药时不同的组合时间(4 d或2+2 d)对PC9ER细胞系的影响,结果与6 d或3+3 d的干预时间并无区别。此外,因HCC827细胞系对厄洛替尼太过敏感,联合用药时因效果难以评估而将其从后续实验中剔除。见图2。
2.3 化疗药物和厄洛替尼联用对厄洛替尼耐药模型凋亡的影响
在厄洛替尼耐药细胞系中研究厄洛替尼和化疗药物同时或顺序给药(6 d或3+3 d)时,细胞裂解蛋白中的细胞凋亡标志物cPARP的表达,以表示细胞凋亡反应率的差异。厄洛替尼本身对PC9ER和HCC827GR的诱导凋亡作用极弱,但在H1975细胞系凋亡相对明显。顺铂对PC9ER和H1975细胞都有一定的促凋亡作用,而紫杉醇只对后者有促凋亡作用。然而发现仅在HCC827GR细胞中,紫杉醇和厄洛替尼联用较两者前后顺序使用细胞凋亡率升高。在某些情况下,两药同时干预甚至出现细胞凋亡率下降。最显著的凋亡反应总是出现在先化疗药物处理,后厄洛替尼干预的细胞系中。只有采用先紫杉醇后厄洛替尼的给药顺序干预PC9ER细胞系和先顺铂后厄洛替尼的给药顺序干预HCC827GR细胞系在本质上算唯一的诱导凋亡实验,而其他的给药顺序只有些许或者毫无促凋亡现象(见图3)。在预实验中,笔者对PC9ER细胞系采用不同的药物干预时间(4 d或2+2 d),发现与6 d和3+3 d的干预时间并无不同。ERK1/2作为内参照来验证蛋白质是否均匀加载。
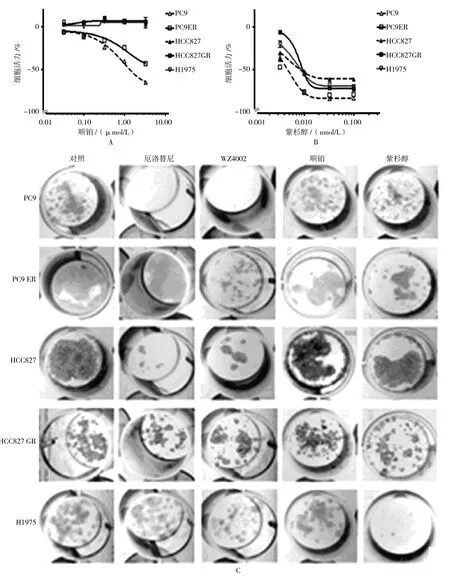
图1 EGFR突变的NSCLC细胞系的MTS细胞毒性试验结果

图2 EGFR TKIs和化疗药物对各细胞系增殖的影响

图3 各处理组细胞裂解蛋白的表达
3 讨论
在EGFR突变的NSCLC患者中,对EGFR TKIs的获得性耐药是影响其疗效发挥的主要限制因素[8-9]。虽然针对获得性耐药已提出一些治疗策略[10-12],但目前并无切实可行的公认方案。肿瘤进展后的化疗、放疗和TKI继续服用,以及更新药物的干预是目前的主要治疗策略[13],但有助于医师在这些治疗策略间进行选择的预测因素极为有限。
本实验结果表明,TKI联合顺铂或紫杉醇具有协同作用。由于药物狭窄的毒性窗和预实验发现4或6 d的药物处理时间并无区别,本实验选择了唯一的1种药物浓度和为期6 d的药物处理时间。有趣的是,对于TKI具有极高耐药性的细胞系模型中,本实验检测到TKI能够提高化疗药物的细胞毒性。此外,T790M二次突变和cMET扩增作为TKI最常见的耐药机制,其对药物的反应性无显著差异。同样本实验取得相似的结果,第1代TKI厄洛替尼与化疗联用的协同作用无论是对野生型还是突变型EGFR均具有亲和力。笔者观察到协同作用背后,第3代突变型EGFR特异性抑制药物WZ4002对突变型EGFR的抑制作用极为显著。在TKI联合化疗药物的协同作用方面,本实验取得相似的结果。本研究结果表明,如果EGFR TKIs和化疗相结合,药物的给药顺序至关重要。如果先TKI干预,后化疗处理,未出现协同作用,但是采取TKI和化疗药物同时或先化疗药物后TKI的给药顺序时,协同作用显著。本研究的TKI耐药模型与前人研究的TKI敏感NSCLC模型具有相似的结果,先化疗后TKI治疗优于其他给药方式[14]。临床上,通常给予NSCLC患者周期性化疗,同时联用TKI很可能只在化疗第1阶段有协同作用[15]。根据本研究结果,针对获得性EGFR TKIs耐药,先化疗后TKI可能是最为有效的给药顺序。可以推测,先化疗后TKI的治疗方式可以预先抑制获得性耐药的发展。已经证实,患者可同时并发多种耐药机制,而化疗和TKI 2种治疗方式的联用可能阻止更多耐药情况的发生。
总之,EGFR TKIs结合化疗干预EGFR突变的NSCLC细胞系可以产生协同作用,且给药顺序极为关键。这种顺序给药策略值得临床深入探究。
参 考 文 献:
[1]SEQUIST L V, YANG J C, YAMAMOTO N, et al.Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J].J Clin Oncol, 2013,31(27):3327-3334.
[2]WU Y L, ZHOU C, HU C P, et al.Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUXLung 6):an open-label, randomised phase 3 trial[J].Lancet Oncol,2014, 15(2):213-222.
[3]刘莉, 陆远, 王媛, 等.EGFR、HER2、CXCR4在非小细胞肺癌中的表达及临床意义[J].现代生物医学进展, 2014, 14(6):1069-1073.
[4]CHONG C R, JANNE P A.The quest to overcome resistance to EGFR targeted therapies in cancer[J].Nat Med, 2013, 19(11):1389-1400.
[5]YU H A, SIMA C S, HUANG J, et al.Local therapy with continued EGFR tyrosine kinase inhibitor therapy as a treatment strategy in EGFR-mutant advanced lung cancers that have developed acquired resistance to EGFR tyrosine kinase inhibitors[J].J Thorac Oncol,2013, 8(3):346-351.
[6]韩洪利.非小细胞肺癌对TKI耐药及其逆转机制的研究进展[J].山东医药, 2015, 55(6):101-105.
[7]GOLDBERG S B, OXNARD G R, DIGUMARTHY S, et al.Chemotherapy with Erlotinib orchemotherapy alone in advanced non-small cell lung cancer with acquired resistance to EGFR tyrosine kinase inhibitors[J].Oncologist, 2013, 18(11):1214-1220.
[8]WALTER A O, SJIN R T, HARINGSMA H J, et al.Discovery of a mutant-selective covalent inhibitor of EGFR that overcomes T790M-mediated resistance in NSCLC[J].Cancer Discov, 2013,3(12):1404-1415.
[9]方健.EGFR突变NSCLC二线TKIs治疗优化选择[J].医学与哲学, 2014, 35(22):20-23.
[10]XIAO B K, YANG J Y, DONG J X, et al.Meta-analysis of seven randomized control trials to assess the efficacy and toxicity of combining EGFR-TKI with chemotherapy for patients with advanced NSCLC who failed first-line treatment[J].Asian Pac J Cancer Prev, 2015, 16(7):2915-2921.
[11]PARK S, KEAM B, KIM S H, et al.Pemetrexed singlet versus nonpemetrexed-based platinum doublet as second-line chemotherapy after first-line epidermal growth factor receptor(EGFR) tyrosine kinase inhibitor failure in non-small cell lung cancer patients with EGFR mutations[J].Cancer Res Treat, 2015,47(4):630-637.
[12]TAN P S, LOPES G, ACHARYYA S, et al.Bayesian network meta-comparison of maintenance treatments for stage Ⅲ b/Ⅳnon-small-cell lung cancer (NSCLC) patients with good performance status not progressing after first-line induction chemotherapy:results by performance status, EGFR mutation,histology and response to previous induction[J].Eur J Cancer,2015, 51(16):2330-2344.
[13]HASEGAWA Y, ANDO M, MAEMONDO M, et al.The role of smoking status on the progression-free survival of non-small cell lung cancer patients harboring activating epidermal growth factor receptor (EGFR) mutations receiving first-line EGFR tyrosine kinase inhibitor versus platinum doublet chemotherapy:a metaanalysis of prospective randomized trials[J].Oncologist, 2015,20(3):307-315.
[14]MIYAUCHI E, INOUE A, KOBAYASHI K, et al.Efficacy of chemotherapy after first-line gefitinib therapy in EGFR mutationpositive advanced non-small cell lung cancer-data from a randomized phase Ⅲ study comparing gefitinib with carboplatin plus paclitaxel (NEJ002)[J].Jpn J Clin Oncol, 2015, 45(7):670-676.
[15]HARTMANN J T, KOLLMANNSBERGER C, CASCORBI I, et al.A phase I pharmacokinetic study of matuzumab in combination with paclitaxel in patients with EGFR-expressing advanced nonsmall cell lung cancer[J].Invest New Drugs, 2013, 31(3):661-668.
