文心兰PAD4基因克隆及表达分析
2018-05-14郭艳芳王丛巧李蓉陈裕坤赖钟雄王天池
郭艳芳 王丛巧 李蓉 陈裕坤 赖钟雄 王天池


摘 要 为了研究文心兰(Oncidium hybridum)抗病相关基因PAD4在文心兰抗病种质资源培育中的功能,采用RT-PCR结合RACE法,从巧克力文心兰(Oncidium Sharry Baby ‘Sweet Fragrance)中克隆得到一条全长2 214 bp的基因的cDNA序列,开放阅读框长1 894 bp,预测可编码647个氨基酸,5′UTR长度为65 bp,3′UTR长度为255 bp。生物信息学分析表明:PAD4编码的蛋白属于水解酶超家族,有6个跨膜螺旋,无信号肽,亚细胞定位预测其主要定位于细胞质膜上。系统进化树表明,文心兰PAD4与同为兰科植物的小兰屿蝴蝶兰(Phalaenopsis equestris)、铁皮石斛(Dendrobium catenatum)、深圳拟兰(Apostasia shenzhenica)亲缘关系最近。同源分析结果显示,与铁皮石斛的PAD4蛋白同源性最高(78.08%)。实时荧光定量PCR分析显示,PAD4在文心兰不同组织部位中都有表达,在假鳞茎中的表达量最高,其次是下端叶,在根中的表达量最低。接种软腐病病原菌显示,PAD4在感病文心兰中表达量上调,侵染后4 h时快速响应并达到最高值。SA(salicylic acid)和CaCl2都能够诱导PAD4的表达,都在24 h时达到最高峰。研究表明,PAD4基因可能在文心兰抗病过程中有重要作用。
关键词 文心兰;抗病;PAD4;基因克隆;表达分析中图分类号 S31 文献标识码 A
DOI 10.3969/j.issn.1000-2561.2018.12.016
文心兰,兰科(Orchidaceae)文心兰属(Oncidium)植物的总称,为全球重要的切花植物,其花序分支性好,花形优美,花朵奇异可爱。巧克力文心兰(OncidiumSharry Baby ‘Sweet Fragrance)作为文心兰的一个栽培品种,花朵数可达百朵,花期长达两个半月,开花时又因其具有巧克力奶油香气的显著特征而成为人们关注的焦点[1],具有很高的市场价值。文心兰切花高峰期集中于高温高湿季节,在文心兰栽培过程中极易感染软腐病、褐斑病、根腐病等细菌性病害,炭疽病、圆斑病等真菌性病害以及病毒病[2]。各种病害给文心兰产业带来严重的损失,严重阻碍了文心兰产业的发展。由于文心兰及其近亲种属缺乏有效对抗文心兰病害的抗病基因,通过常规育种来提高文心兰的抗性比较困难[3],因此筛选抗性相关基因,培育抗性文心兰品种对文心兰产业的发展具有重要意义。
植物受到病原菌侵染后可以通过植物系统获得性抗性(SAR)抵御病原菌的侵扰,植物抗病基因(R)与病原菌无毒基因(avr)能够相互识别,并通过R基因下游的一些基因整合不同的抗病信号,通过水杨酸途径将抗病信号传递下去[4-5]。PAD4作为一个抗病信号途径基因,是在通过寻找突变体植株对脱毒的十字花科黑斑病菌增强了感病性基因时发现的[6],其编码一个核质蛋白,序列与脂肪酶类似[7],与三酰甘油脂肪酶基因同源,属于水杨酸信号途径的上游基因,在系统获得性抗性中,水杨酸是其发挥功能的关键信号分子。水杨酸作为SAR信号转导途径的一种内源信号分子,在植物的SAR信号转导中起着关键作用[8],其诱导的植物防御对抵抗病原体的侵扰至关重要。PAD4作為依赖SA(salicylic acid)防御反应的调控子[9],在抗病基因介导的植物抗性中起到重要的作用,能够在植物生长发育过程中抵御病菌的侵害及逆境胁迫。当病原菌入侵植物组织后,会产生一个移动信号,通过植物维管系统激活末端组织来防御病害[10]。在SA介导的抗病信号途径中,病原菌对植物的侵染会使植物局部组织发生超敏反应,诱导植物抗毒素等物质的合成,并伴随水杨酸水平提高,激发下游PR蛋白的表达,使植物获得系统性抗性[11-12]。PAD4控制植物防御信号的合成,对蔓延性植物病毒能产生抗性,研究表明外援喷施SA后能够促进PAD4大量表达[13-14],从而提高植物自身的抗病性。PAD4作为植物自身的抗病信号途径基因在植物的抗病进程中有着重要的地位,因此利用文心兰本身的遗传抗性在研究文心兰病害中是值得尝试的一种方式。目前对PAD4的研究多集中在水稻[6]、茄子[15]、烟草[16]等植物上,在文心兰中未见报道。本研究以巧克力文心兰为材料,采用RACE-PCR技术克隆了巧克力文心兰PAD4基因的全长序列,使用实时荧光定量PCR对文心兰不同组织部位、病原菌侵染文心兰不同时间和外源激素处理下PAD4基因的表达量进行定量分析,了解PAD4基因表达情况,为文心兰的抗病性研究奠定基础。
1 材料与方法
1.1材料
本实验以巧克力文心兰组培苗为材料,由福建农林大学园艺植物生物工程研究所提供。取样后用液氮预冷处理并保存于–80 ℃冰箱备用。
1.2方法
1.2.1 文心兰总RNA提取及其cDNA第一链合成 采用Trizol UP RNA提取试剂盒(全式金生物技术有限公司)提取样品总RNA,用Thermo超微量核酸检测仪检测RNA样品浓度,并用1%琼脂糖凝胶电泳检测其清晰度与完整性,保存于–80 ℃冰箱备用。采用GeneRacerTM试剂盒(TaKaRa)将已经提取的文心兰总RNA反转录为第一链cDNA用于5′端的克隆,采用SMARTer RACE Kit试剂盒(TaKaRa)将已经提取的文心兰总RNA反转录为第一链cDNA用于3′端和保守区的克隆。用SYBR ExScriptTM(TaKaRa)逆转录试剂盒将已经提取的总RNA反转录成cDNA用于荧光定量PCR分析。具体使用步骤见说明书。
1.2.2PAD4基因全长序列的扩增 从文心兰转录组中获得PAD4的部分核苷酸序列,采用DNAMAN 6.0在其开放阅读框(ORF)序列两端设计一对特异性引物PAD4-ORF-F和PAD4-ORF- R(表1),以巧克力文心兰第一链cDNA为模板,进行PCR扩增,克隆该基因ORF序列。然后根据已知的ORF序列分别设计出2条3′RACE的特异性引物和2条5′RACE的特异性引物(表1),结合SMARTer RACE Kit 3′和3′巢式引物以及GeneRacerTM5′和5′巢式引物,以巧克力文心兰cDNA为模板,分别扩增出3′和5′端序列,用DNAMAN 6.0进行全长拼接。以上所用引物均由华大基因科技公司合成。
PCR反應采用25 μL体系:Dream TaqTMGreen PCR Master Mix (2×) 12.5 μL,ddH2O 9.5 μL,模版cDNA 1 μL,上下游引物各1 μL。保守区克隆PCR扩增程序为94 ℃预变性3 min,94 ℃变性30 s、57 ℃退火45 s、72 ℃延伸2 min 30 s,34个循环,最后72 ℃延伸5 min并4 ℃保存。3′和5′端克隆PCR扩增程序为94 ℃预变性3 min,94 ℃变性30 s、55~59 ℃退火30 s、72 ℃延伸45 s,34个循环,最后72 ℃延伸5 min并4 ℃保存。
1.2.3 TA克隆与测序 所有的PCR产物均用1%凝胶电泳,然后将目标片段的PCR产物采用Gel/PCR Extraction Kit进行胶回收,连接PMD18-T载体后转化大肠杆菌DH5α中进行TA 克隆并挑选阳性克隆摇菌,然后进行菌液PCR扩增,将带有目的条带的菌液送至华大生物技术有限公司测序。
1.2.4 文心兰PAD4生物信息学分析 利用NCBI的ORF Finder对PAD4的cDNA序列的开放阅读框进行查找;通过NCBI Conserved Domain Search预测蛋白的保守结构域;采用ExPASy- ProtParam tool进行氨基酸序列的理化性质预测;利用Signal P4.1Server预测蛋白质的信号肽;用TMpred Server进行蛋白跨膜预测;用PSORT WWW Server进行亚细胞定位预测;用KinasePhos预测蛋白的磷酸位点;通过COLIS Server进行卷曲螺旋结构分析;分别用SOMPA和SWISS-MODEL对PAD4基因编码的蛋白进行二级结构分析与三维结构预测。采用MEGA 6.0 Neighbor-Joining构建系统进化树,利用NCBI网站的BLAST程序搜索PAD4蛋白的相似性序列并进行同源比对。
1.2.5 文心兰PAD4基因的表达分析 以Actin作为内参基因,根据荧光定量引物设计原则和获得的序列设计1对特异引物PAD4-QF和PAD4-QR(表1),进行PAD4的表达模式分析。提取文心兰不同组织部位(根、假鳞茎、上端叶、下端叶、花)的总RNA备用。用实验室保存的软腐病病菌侵染文心兰假鳞茎,于侵染前的0 h与侵染后的4、8、12 h取样。分别用1 μmol/L SA、0.5 μmol/L CaCl2喷施文心兰组培苗叶片,喷施直至叶片流水为止,然后在处理前的0 h与处理后的1、3、6、12、24、48 h分别取叶片,所有样品取样后立即用液氮速冻保存于–80 ℃备用。采用Trizol UP RNA试剂盒提取所有样品的总RNA,用1%的琼脂糖凝胶电泳检测其完整性,然后用Thermo超微量核酸检测仪检测RNA样品浓度与OD值。逆转录为cDNA模版用于定量PCR实验。将cDNA样本混合物进行5倍梯度稀释,分别对PAD4基因和内参基因进行扩增,获得标准曲线、溶解曲线和扩增曲线以确定引物特异性和扩增效率。将所有样品的cDNA 稀释10倍作为模板进行扩增。采用SYBR premix Ex TaqTMⅡkit(TaKaRa)进行qRT-PCR反应。反应采用20 μL体系:2× SYBR 10 μL,ddH2O 7.4 μL,cDNA模版1 μL,上下游引物各0.8 μL,每种处理做3个生物学重复。使用罗氏LightCycler 480仪器,程序为:95 ℃预变性30 s,95 ℃变性10 s、60 ℃退火30 s、72 ℃延伸15 s,40次循环。依据2–??Ct法计算PAD4基因的相对表达量。
2 结果与分析
2.1巧克力文心兰cDNA全长序列的获得
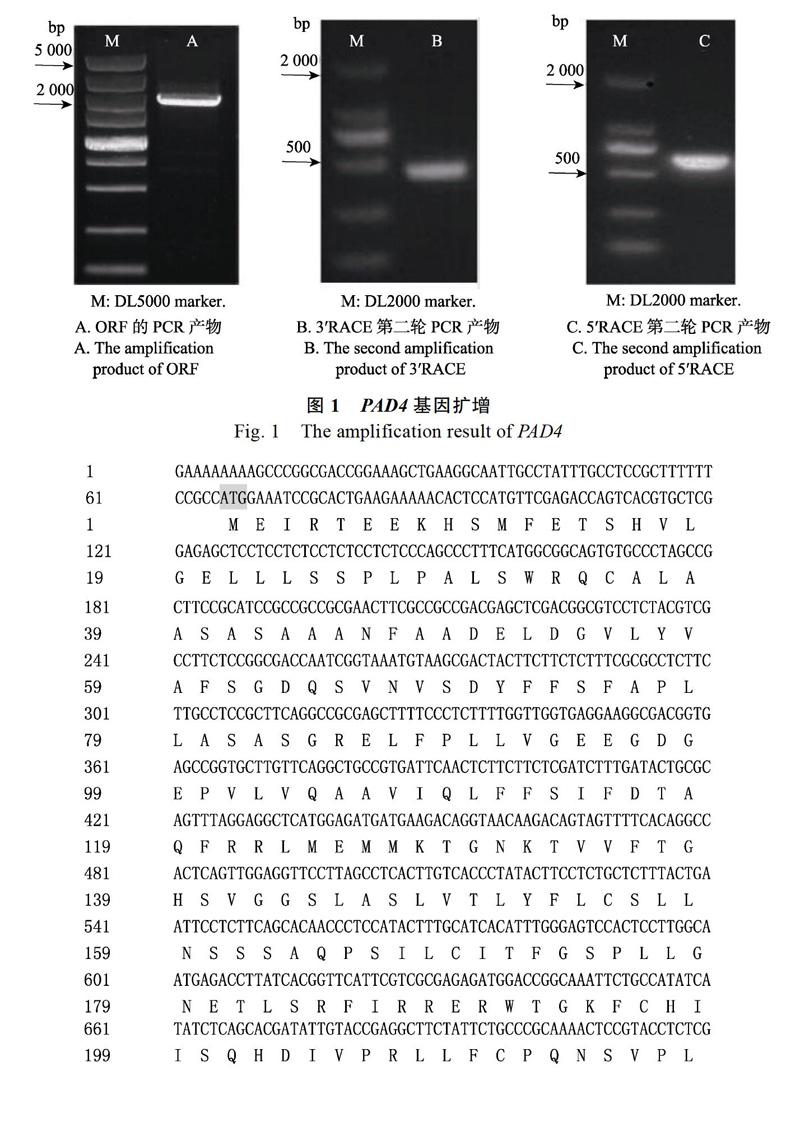
以巧克力文心兰的cDNA为模板,进行PCR扩增以及验证PAD4基因的ORF序列,电泳显示目的片段大小约1 800 bp(图1-A),经测序验证ORF长度为1 894 bp。以PAD4-GSP1和PAD4- GSP2为特异引物,进行3′RACE巢式PCR扩增,电泳检测得到一条500 bp左右的目的片段(图1-B),测序显示其长度448 bp;以PAD4-GSPa和PAD4-GSPb为特异引物,进行5′RACE巢式
PCR扩增,电泳检测得到一条600 bp左右的条带(图1-C),测序显示其长度为606 bp。将获得的5′端、3′端和ORF序列利用DANMAN 6.0软件进行拼接,共得到2 214 bp的全长序列,包括1 894 bp的ORF,编码蛋白由647个氨基酸组成,5′-UTR为65 bp,3′-UTR为255 bp,polyA尾巴为33 bp(图2)。经BLAST分析表明,该片段与多种植物尤其是兰科植物的PAD4基因具有很高的同源性,初步认定它是文心兰PAD4基因的片段。
2.2 PAD4的理化性质和结构分析
用ExPASy-ProtParam tool进行氨基酸序列的理化性质预测。结果显示,该蛋白分子式为C3192 H5004 N864 O905 S44,相对分子质量为71 374.73,理论等电点为8.27,不稳定系数51.91,Grand average of hydropathicity (GRAVY)值为–0.074,脂肪族指数为87.99。NCBI-CDD預测到该蛋白的保守结构域在1~631肽链区间,属于水解酶超家族;利用Signal P4.1Server预测信号肽显示PAD4不含信号肽,不属于分泌蛋白。用PSORT Prediction分析预测显示该蛋白定位于细胞质膜上(可信度:0.820);用TMpred Server进行蛋白跨膜预测,显示PAD4蛋白属于跨膜蛋白,有6个跨膜螺旋。用KinasePhos预测蛋白的磷酸位点表明PAD4蛋白有10个磷酸化位点,含有9个丝氨酸、1个苏氨酸,没有络氨酸。用COLIS Server进行卷曲螺旋结构分析,显示PAD4没有形成卷曲螺旋结。通过SOMPA在线软件进行二级结构预测,显示其编码蛋白的氨基酸序列中有354处α-螺旋(alpha helix)、50处外延伸链(extended strand)、17处β-转角(beta turn)和210处无规则卷曲(random coil),分别占二级结构的56.10%、7.92%、2.69%和33.28%。因此α-螺旋和无规则卷曲是PAD4的主要结构原件。利用 SWISS- MODEL软件预测文心兰PAD4蛋白的三维结构,从图3可以看出PAD4蛋白的主要结构元件还是螺旋和卷曲,与二级结构的预测结果相符。
2.3 PAD4的同源性序列比对及进化树构建
为了研究PAD4的进化关系,构建系统进化树。结果表明,PAD4与同为兰科植物的铁皮石斛、小兰屿蝴蝶兰亲缘关系最近,归在同一分支(图4)。利用NCBI中的BLAST程序将文心兰PAD4编码的氨基酸序列与其他6个物种的PAD4编码的氨基酸序列进行同源性比对,结果显示文心兰PAD4与铁皮石斛PAD4相似度高达78.08%,与小兰屿蝴蝶兰PAD4相似度为75.31%,与深圳拟兰、凤仙花、油棕、野果芭蕉相似度也都在50%以上,比对发现文心兰PAD4蛋白与其他6种植物蛋白在C端的序列保守性更高,在兰科植物的进化过程中具有高度的保守性(图5)。
2.4 文心兰PAD4基因的表达特性
荧光定量结果显示,PAD4基因在文心兰不同组织部位的表达差异显著。在根、假鳞茎、上端叶、下端叶和花中均有表达,在根中的表达量最低,在假鳞茎中表达量最高,是根中表达量的3倍,在下端叶中表达量略微低于假鳞茎,也接近在根中表达量的3倍,其次是上端叶和花(图6)。软腐病病菌侵染文心兰假鳞茎后,PAD4的表达量先上调后下降,在4 h时达到最高值,8 h时降到最低(图7),说明PAD4在软腐病的侵染过程中对病原菌比较敏感,在接种部位能够快速响应软腐病菌的侵染并作出表达。1 μmol/L SA喷施文心兰叶片能够诱导PAD4的表达,PAD4的表达量先上升再下降,再上升再下降,出现2个峰值,6 h时PAD4的表达量达到第一个高峰,12 h时PAD4的表达量下降到最低然后开始上升,24 h时PAD4的表达量达到最高值,约为0 h的3.5倍,然后开始下降,整体呈“M”趋势。0.5 μmol/L CaCl2喷施文心兰叶片能够显著诱导PAD4的表达,PAD4的表达量先下降再上升再下降,CaCl2喷施文心兰叶片1 h后表达量略微下降然后开始上升,24 h达到最高值然后开始下降,最高值约为0 h的7倍(图8)。SA信号通路作为植物调控诱导抗性的重要通路,参与植物的抗病过程,Ca2+信号参与SA防御途径,同时又作为细胞的第二信使参与植物的抗病防卫反应中[17-18],SA和CaCl2处理植株后PAD4的表达量显著上调,说明PAD4在文心兰抗病过程中起到正调控的作用。
3 討论
3.1 PAD4是一个定位于细胞质膜的水解酶超家族蛋白
本研究基于文心兰转录组中找到抗性相关基因PAD4并对其进行全长克隆,得到全长为2 214 bp文心兰PAD4基因,其中该基因CDS长1 894 bp,预测可编码647个氨基酸,PAD4不含信号肽,不属于分泌蛋白,亚细胞定位预测其定位于细胞质膜上。通过对PAD4蛋白分析显示PAD4蛋白脂肪族指数高达87.99,属于水解酶超家族。PAD4与同属于水解酶家族的EDS1为互作蛋白,它们的N端都有与酰基水解酶同源的结构域[19],两者协同作用能够促进SA的积累增加水杨酸诱导的植物防御并放大PAD4的功效,使PAD4的功能保持稳定[20-21]。进一步研究发现,PAD4和EDS1结合后还能够在钙信号的影响下激活水杨酸合成途径中的关键酶ICS1(isochorismate synthase 1)从而诱导SA的合成参与植物抗病的过程[22]。PAD4在文心兰不同组织部位表达量差异较大,在假鳞茎中表达量最高,在下端叶和上端叶的表达量都超过根的2倍,但在上端叶没有下端叶的高,这可能与下端叶的位置接近于假鳞茎有关,在花中的表达量接近于在根中表达量的1.5倍,说明该基因属于组织特异性表达模式。
3.2 PAD4通过水杨酸信号途径在文心兰抗病过程中发挥着重要作用
SA途径作为植物主要的防卫反应信号传导途径,有很多防卫反应信号蛋白调节SA的生成积累,最终影响植物的抗病反应。PAD4作为调控SA途径的信号蛋白,是由抗性基因介导的触发性免疫反应中的重要调节剂[23],通过SA介导的抗病途径来提高植物的抗性。研究表明在应答某些信号时,PAD4对于激活SA表达是必需的,不同的抗性基因通过不同的途径介导植物的抗性反应。软腐病病菌接种文心兰假鳞茎后,PAD4的表达量在4 h时快速上调,说明PAD4在接种部位快速响应并达到最高值,文心兰在受到软腐病侵染后接种部位的PAD4基因立即响应病菌的侵染,说明PAD4可能会在文心兰抗病过程中发挥作用。水杨酸作为植物抗病途径中的重要信号要素,在病原物相互作用过程中,植物体内发生信号传导,PAD4在SA和CaCl2的处理下表达量整体上调,SA可以通过正反馈环路来增加PAD4的表达,同时PAD4又可以促进水杨酸的积累,激发植物的防御体系使植物产生抗病性反应[24]。Ca2+作为细胞信号传导信使能够参与水杨酸的合成来提高植物的抗病性[25],研究表明,外援Ca2+的处理能够提高SA诱导番茄抗灰霉病的能力[26],同时也可以增加PAL、POL等抗病性酶活性和促进酚类物质与木质素等抗病物质的积累来增强植物抗病性[27],PAD4在CaCl2的处理下做出响应,说明PAD4参与文心兰的抗病反应中。
3.3 PAD4参与植物的其他抗性活动
植物抗病信号途径复杂多样,整体呈网络状的各个途径交叉互作,PAD4与其他病原基因相互作用在植物抗病反应中。PDA4在植物抗性的研究中,不仅能够增加植物对病原菌的抗病性,而且在植物抗病虫和植物抗衰老方面也有一定的作用,在拟南芥中PAD4能够伴随着植物韧皮部的防御机制来调控叶片的早衰,同时也能够调节韧皮部蚜虫的防御机制来限制蚜虫对植物的伤害[28-29],调节植物营养和生殖生长,在干旱胁迫下的生存中发挥重要作用[30]。通过对文心兰PAD4 基因进行克隆与表达分析,了解PAD4在文心兰健康植株与感病植株中的表达情况,下一步可以进行文心兰PAD4基因敲除或通过转基因技术得到转基因植株,进一步研究文心兰PAD4的抗病性,为文心兰抗病新种质的培育提供进一步的研究基础。
参考文献
- 叶 炜, 李永清, 江金兰. 利用信息学技术追溯巧克力文心兰亲本及育种应用情况[J]. 三明农业科技, 2013(1): 14-17.
- 易绮斐, 刘东明, 陈红锋, 等. 兰花主要病害及其防治[J]. 植物保护, 2004, 30(1): 71-73.
- 吴晓佩, 谢礼洋, 白 玉, 等. 文心兰铁氧还蛋白基因克隆定位及表达分析[J]. 西北植物学报, 2017(1): 48-58.
- 赵淑清, 郭剑波. 植物系统性获得抗性及其信号转导途径[J]. 中国农业科学, 2003, 36(7): 781-787.
- Dangl J L, Jones J D G, Dangle J L, et al. Plant pathogens and integrated defence in plants [J]. Nature, 2001, 411(6 839): 826-833.
- Glazebrook J, Rogers E E, Ausubel F M. Isolation of Arabidopsis mutants with enhanced disease susceptibility by direct screening[J]. Genetics, 1996, 143(2): 973-982.
- 李庆亮, 李 捷, 胡增丽, 等. PAD4基因在植物抗性方面的作用[J]. 农业与技术, 2017(7): 1-2.
- Wang X, Sager R, Cui W, et al. Salicylic acid regulates Plasmodesmata closure during innate immune responses in Arabidopsis[J]. Plant Cell, 2013, 25(6): 2 315-2 329.
- Nan Z, Tootle T L, Tsui F, et al. PAD4 functions upstream from salicylic acid to control defense responses in Arabidopsis[J]. Plant Cell, 1998, 10(6): 1 021-1 030.
- Pieterse M J, Leon-Reyes A, Ent S V D, et al. Networking by small-molecule hormones in plant immunity[J]. Nature Chemical Biology, 2009, 5(5): 308-316.
- Feys B J, Parker J E. Interplay of signaling pathways in plant disease resistance[J]. Trends in Genetics, 2000, 16(10): 449-455.
- 贾燕涛. 植物抗病信号转导途径[J]. 植物学通报, 2003, 20(5): 602-608.
- Bartsch I, Wiencke C, Bischof K, et al. The genus Laminaria sensu lato: recent insights and developments[J]. European Journal of Phycology, 2008, 43(1): 1-86.
- Jirage D, Tootle T L, Reuber T L, et al. Arabidopsis thaliana PAD4 encodes a lipase-like gene that is important for salicylic acid signaling[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(23): 13 583-13 588.
- 肖熙鸥, 蒋 晶, 陈 娜, 等. 茄子调控抗青枯病反应信号基因的筛选和鉴定[J]. 园艺学报, 2016(7): 1 295-1 304.
- 路子峰, 张 超, 李彦忠. 林烟草8个防卫反应信号蛋白编码基因的克隆及RNAi植物表达载体的构建[J]. 草业科学, 2014, 31(7): 1 275-1 282.
- Jiang J F, Li J G, Dong Y H. Effect of calcium nutrition on resistance of tomato against bacterial wilt induced by Ralstonia solanacearum[J]. European Journal of Plant Pathology, 2013, 136(3): 547-555.
- Steinhorst L, Kudla J. Calcium and reactive oxygen species rule the waves of signaling[J]. Plant Physiology, 2013, 163(2): 471-485.
- Wiermer M, Feys B J, Parker J E. Plant immunity: the EDS1 regulatory node[J]. Current Opinion in Plant Biology, 2005, 8(4): 383-389.
- Feys B J, Moisan L J, Newman M A, et al. Direct interaction between the Arabidopsis disease resistance signaling proteins, EDS1 and PAD4[J]. EMBO Journal, 2001, 20(19): 5 400-5 411.
- Cui H, Gobbato E, Kracher B, et al. A core function of EDS1 with PAD4 is to protect the salicylic acid defense sector in Arabidopsis immunity[J]. New Phytologist, 2017, 213(4): 1 802-1 817.
- 张梦姝, 牛宏伟, 侯春燕, 等. 植物免疫中的EDS1[J]. 中国细胞生物学学报, 2016(11): 1 398-1 404.
- Rietz S, Stamm A, Malonek S, et al. Different roles of Enhanced Disease Susceptibility1 (EDS1) bound to and dissociated from Phytoalexin Deficient4 (PAD4) in Arabidopsis immunity[J]. New Phytologist, 2011, 191(1): 107-119.
- 丁丽娜, 杨国兴. 植物防御激素介导的信号途径间的交叉对话[J]. 西北植物学报, 2016(5): 1 066-1 072.
- Du L, Ali G S, Simons K A, et al. Ca2+/calmodulin regulates salicylic-acid-mediated plant immunity[J]. Nature, 2009, 457(7 233): 1 154-1 158.
- 李琳琳, 李天来, 姜国斌, 等. 外源Ca2+对水杨酸诱导番茄抗灰霉病的增效机制[J]. 应用生态学报, 2015(11): 3 497-3 502.
- 余朝阁, 李天来, 张亢亢, 等. 钙对茉莉酸甲酯诱导番茄抗灰霉病及防御酶活性的调控作用[J]. 中国蔬菜, 2012 (18): 166-170.
- Pegadaraju V, Knepper C, Reese J, et al. Premature leaf senescence modulated by the Arabidopsis PHYTOALEXIN DEFICIENT4 Gene is associated with defense against the phloem-feeding green peach aphid[J]. Plant Physiology, 2005, 139(4): 1 927-1 934.
- Pegadaraju V, Louis J, Singh V, et al. Phloem-based resistance to green peach aphid is controlled by Arabidopsis PHYTOALEXIN DEFICIENT4 without its signaling partner ENHANCED DISEASE SUSCEPTIBILITY1[J]. Plant Journal, 2007, 52(2): 332-341.
- Szechyńska-Hebda M, Czarnocka W, Hebda M, et al. PAD4, LSD1 and EDS1 regulate drought tolerance, plant biomass production, and cell wall properties[J]. Plant Cell Reports, 2016, 35(3): 527-539.
