橡胶树中碱性转化酶基因HbNIN8的克隆与表达分析
2018-05-14阳江华龙翔宇邹智秦云霞
阳江华 龙翔宇 邹智 秦云霞

摘 要 蔗糖是高等植物光合产物的重要存储方式,而转化酶和蔗糖合酶是水解蔗糖的主要酶。研究基于橡胶树的基因组和转录组数据,采用RT-PCR技术克隆到一个中碱性转化酶基因HbNIN8的全长cDNA。该基因预测编码630个氨基酸。同源和亚细胞定位分析表明,HbNIN8属于α类中碱性转化酶,叶绿体定位。应用毕赤酵母真核表达获得其重组蛋白,分析了其酶活性特点,HbNIN8在毕赤酵母中重组蛋白的最适pH为7.5,最适温度为45 ℃。实时荧光定量PCR分析表明,HbNIN8主要在葉片中表达,其表达量随着叶片的成熟而逐渐增加,在稳定期叶片中达到最大,在成熟叶片中,HbNIN8的表达呈现明显的昼夜差异,晚上的表达水平相对高于白天。因此,HbNIN8很可能是负责将叶绿体中的蔗糖水解为单糖,从而调控橡胶树叶绿体内蔗糖和淀粉的分配。
关键词 巴西橡胶树;中碱性转化酶;HbNIN8;叶绿体中图分类号 S794.1 文献标识码 A
DOI10.3969/j.issn.1000-2561.2018.12.014
蔗糖是植物光合作用的主要产物,其在植物生长发育、信号传导和胁迫应答过程中发挥重要作用。蔗糖的水解依赖于转化酶和蔗糖合成酶,其中,转化酶根据最适pH可分为酸性转化酶(acid invertase)和中碱性转化酶(alkaline/neutral invertase,A/N-Inv)[1]。中碱性转化酶的最适pH接近7.0,其广泛存在于光合细菌和植物中[2]。中碱性转化酶主要位于植物的细胞质中,但在线粒体、叶绿体和质膜等亚细胞器也有分布,分别起着不同的作用[3]。中碱性转化酶属于多基因家族,其在拟南芥和水稻中分别含有9个和8个成员[4],可分为两个亚类,即定位于胞质的β类和位于线粒体/叶绿体的α类。研究表明,水稻的OsNIN1和OsNIN3分别位于线粒体和叶绿体上[5],拟南芥的At-A/N-InvA、At-A/N-InvC、At-A/N-InvH定位于线粒体[6-8],而At-A/N-InvE则定位于叶绿体[9]。深入研究发现,α类中碱性转化酶对于植物器官的形成与发育都是不可或缺的。在拟南芥中,At-A/N-InvA和At-A/N-InvC的单基因缺失突变体生长受到抑制,植株矮小,开花期推迟[6]; AtCINV1和AtCINV2的双突变体cinv1,2表现为严重的生长缺陷,植株矮小,根短粗,其根的长度只有野生型的17%[1]。在水稻中,AtCINV1的同源基因OsCYT-INV1的突变体也呈现出类似的表型,其胚根相对于野生型明显变短,同时还表现出晚花和种子发芽率低等表型[10-11]。另有报道表明,百脉根的LjINV1缺失后,其根和茎表现出明显的生长抑制,并且不能形成花粉,表现出不育性状[12]。追究α类中碱性转化酶的作用机理,发现叶绿体At-A/N-InvE的缺失,拟南芥叶片的蔗糖浓度没有明显变化,但是叶片淀粉的积累显著减少[9]。因此,α类中碱性转化酶很可能是能将叶绿体中的蔗糖水解为单糖,从而调控叶绿体内蔗糖和淀粉的动态转化。
课题组的前期研究表明,橡胶树含有10个中碱性转化酶基因[13],其中,胞质定位的HbNIN2是胶乳中蔗糖降解的关键酶,其活性强弱与橡胶树胶乳的产量呈明显的正相关[14]。然而,目前对橡胶树细胞器中的中碱性转化酶知之甚少。本研究报道一个在橡胶树叶片中高表达的中碱性转化酶基因HbNIN8,推测其很可能负责将叶绿体中的蔗糖水解为单糖,从而调控橡胶树叶绿体内蔗糖和淀粉的动态变化,在叶片光合作用产物分配过程中起着重要的调节作用。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验所用的橡胶树位于中国热带农业科学院试验场1队和3队,品系为热研7-33-97。根取自热研7-33-97组培袋装苗的根,其他6个组织采自10年生、开割3 a的橡胶树,光周期的叶片取自定植4年的橡胶树稳定期叶片的叶肉部分,以5片叶片为1个实验重复,每个时间点取3个实验重复。
1.1.2 实验试剂和菌种 pMD18-T和PrimerStar Max DNA polymerase,荧光定量试剂TB Green?Premix Ex Taq?为大连宝生物公司产品。限制性核酸内切酶、cDNA第一链合成试剂盒为美国Thermo Scientific公司产品。通用植物总RNA提取试剂盒为北京百泰克生物技术有限公司产品。真核表达载体pGAPZαB和毕赤酵母GS115,为本实验室保存。引物和DNA测序在华大基因公司合成和测序。
1.2 方法
1.2.1 总RNA的提取及cDNA第一链的合成 参照说明书提取巴西橡胶树不同组织和光周期叶片的总RNA,合成不同组织mRNA的cDNA第一链。
1.2.2HbNIN8基因的克隆 应用拟南芥叶绿体型中碱性转化酶At-A/N-InvE的mRNA序列,比对巴西橡胶树的转录组,获得了其在橡胶树中的同源基因的mRNA序列,命名为HbNIN8。使用引物对HbNIN8-F和HbNIN8-R(序列信息详见表1),以橡胶树叶片的cDNA为模板,PCR扩增HbNIN8的全长cDNA序列,PCR产物经电泳回收后,连接到pMD-18T载体中,转化JM109感受态细胞,菌落PCR鉴定后,挑选3个阳性的克隆,送深圳华大基因进行测序验证。
1.2.3 多序列比对与进化分析 选取拟南芥5个细胞质定位的(AtCYT-INV1、AtCYT-INV2、At-A/N-InvB、At-A/N-InvD、At-A/N-InvF)和4个亚细胞器定位的中碱性转化酶基因(At-A/N-InvE、At-A/N-InvA、At-A/N-InvC、At-A/N-InvH),水稻的中碱性转化酶8个中碱性转化酶(OsNIN1-4,亚细胞定位;OsNIN5-8,细胞质定位)以及橡胶树HbNIN8的氨基酸序列,使用Mega7.0进行进化树分析[15],应用Neibgbber- Joining法进行分子系统学分析,并进行1 000次bootstrap统计学检验。应用在线预测软件ChloroP and TargetP[16-17]和ProtComp 9.0通过分析氨基酸序列,预测其定位。
1.2.4HbNIN8基因的表达分析HbNIN8基因的荧光定量PCR引物qNIN8-F和qNIN8-R,经标准曲线和溶解曲线分析,确定引物特异性和扩增效率,PCR产物经克隆测序后,最后确认为有效的荧光定量引物。使用该引物对,应用荧光定量PCR仪,对HbNIN8基因在不同组织、叶片不同时期和光周期的进行表达分析,内参基因为UBC2a参照Li等[18]的论文,具体PCR程序和数据分析参照Long等[19]的方法。
1.2.5HbNIN8真核表达载体的构建与表达 以zNIN8-F和zNIN8-R为引物,使用大连宝生物公司PrimerStar Max DNA Polymerase扩增HbNIN8的全长编码区序列。PCR产物经PCR回收试剂盒回收后,和真核表达载体pGAPZαB都使用KpnI和NotI双酶切,酶切产物经胶回收后、连接转化。菌落PCR鉴定阳性克隆,测序确认正确的克隆,成功构建了HbNIN8的pGAPZαB的真核表达载体,命名为pGAP-HbNIN8。pGAP-HbNIN8经Bsp HI酶切线性化,使用电转仪转化毕赤酵母GS115。挑选5个PCR鉴定为阳性的菌落克隆至含100 ?g/mL博来霉素的YPD液体培养基中,30 ℃,250 r/min培养3~5 d。
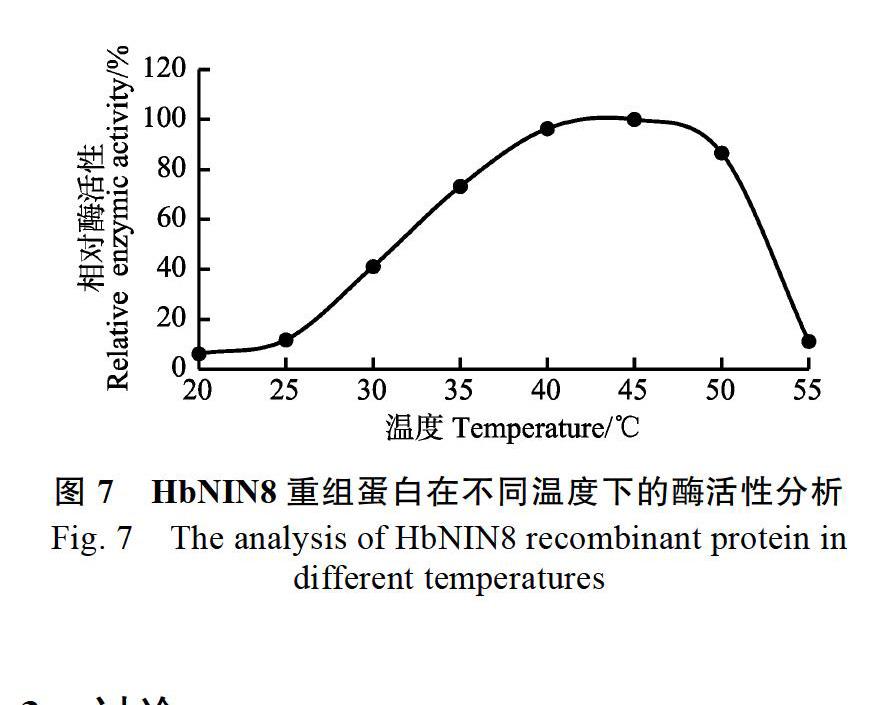
1.2.6 HbNIN8重组蛋白的酶活性分析 pGAPZαB通过分泌表达目的蛋白,重组表达蛋白HbNIN8位于液体培养基中,4 000 r/min,离心10 min。取上清加至10 ku超滤管中,4 000 r/min,4 ℃,离心30 min。然后在超滤管中加入15 mL 50 mmol/L HEPES(pH 7.5),4 000 r/min,4 ℃,离心30 min,重复1次,以去除YPD培养基中残留的葡萄糖。使用10%浓度的聚丙烯酰胺凝胶,SDS-PAGE电泳检测真核表达产物。取约5 ?L未经纯化HbNIN8重组蛋白,用于最适pH和最适酶活性温度的测定。最适pH反应体系:50 mmol/L HEPES(pH 5.5~9.5),5 mmol/L MgCl2,100 mmol/L蔗糖,总体积100 ?L,45 ℃反应30 min,反应结束后马上置于冰上,加入900 ?L的DNS溶液(1%的3,5-二硝基水杨酸,30%的酒石酸钾钠,0.4 mol/L的NaOH)终止反应,沸水浴中反应5 min显色,OD520测定吸光值。最适酶活性温度的测定,50 mmol/L HEPES(pH 7.5),5 mmol/L MgCl2,100 mmol/L蔗糖,总体积100 ?L,置于不同温度的水浴,其他同最适pH的测定。
2 结果与分析
2.1 HbNIN8的序列分析
HbNIN8的cDNA全长为2 169 bp,其中包括1 893 bp的开放读码框,预测编码630个氨基酸。进化分析表明,HbNIN8与At-A/N-InvE的相似性最高(72.5%),归属于同一个亚类(图1)。通过分析HbNIN8的氨基酸序列,预测其定位于叶绿体上。
2.2 HbNIN8在不同组织和不同发育时期叶片中的表达分析
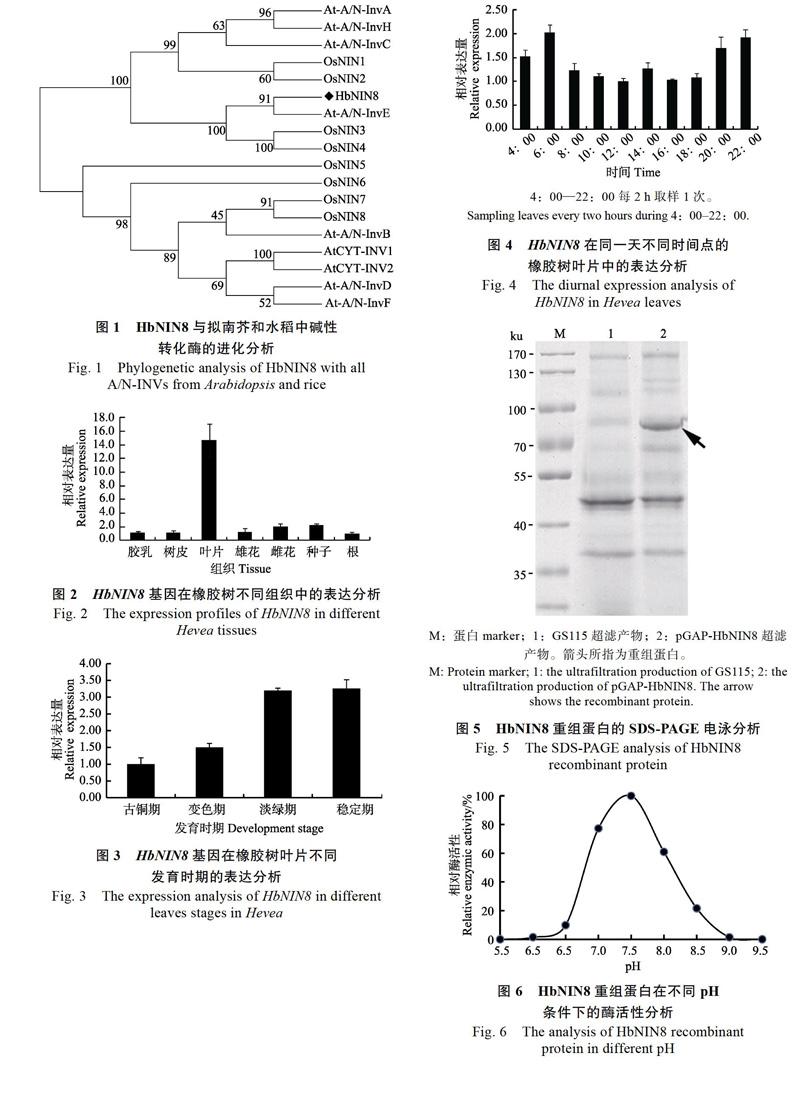
qRT-PCR表达分析显示,HbNIN8主要在橡胶树的叶片中表达,而在其他组织中的表达量都比较低(图2)。在叶片中,HbNIN8的表达水平随着叶片的成熟而逐渐增加,其中在稳定期叶片中的表达量最高(图3)。在光周期分析表明,HbNIN8在白天的表达量较低,而在缺乏光照的凌晨、傍晚和晚上的表达量较高(图4)。
3 讨论
本研究报道了一个橡胶树叶绿体型中碱性转化酶基因HbNIN8的序列特征、表达特性及其编码蛋白的酶学特征。亚细胞定位分析表明,HbNIN8定位于叶绿体。根据进化分析,HbNIN8与拟南芥的At-A/N-InvE、水稻OsNIN3和OsNIN4聚为一类。该酶酶活性分析表明,HbNIN8的重组蛋白具有中碱性转化酶的酶活性,其最适pH为7.5,最适酶活性温度为45 ℃,从最适pH来看,HbNIN8为典型的中碱性转化酶。已有实验证明,At-A/N-InvE和OsNIN3均定位于葉绿体中[5,9],并且有报道表明拟南芥和菠菜叶绿体的转化酶具有中碱性转化酶酶活性[9]。因此,高等植物的叶绿体中应该普遍存在中碱性转化酶,HbNIN8和其他叶绿体型中碱性转化酶一样,可能在叶绿体内的糖代谢过程中发挥重要作用。荧光定量结果显示,HbNIN8主要在橡胶树叶片中表达,且随着叶片的发育成熟其表达量逐渐增加,并在成熟叶片中达到最大值,而拟南芥的At-A/N-InvE基因除了在叶片中外,在花中也高水平表达[9],HbNIN8可能主要在叶片中发挥其功能,而在其他器官中的作用相对较小。在拟南芥中,At-A/N-InvE基因的缺失突变体,相对于野生型,其叶片中的中碱性转化酶活性下降了约30%,叶片的蔗糖含量没有明显变化,而叶片的淀粉下降了33%[9]。拟南芥的叶绿体型中碱性转化酶At-A/N-InvE的294位半胱氨酸突变为酪氨酸,突变体的幼苗表现为对蔗糖超敏感,在100 mmol/L蔗糖条件下,突变体呈现出明显的黄化表型,叶绿体含量和叶绿体相关基因的表达明显减少[20-21]。而且Maruta等[22]的研究进一步表明,At-A/N- InvE的294位半胱氨酸突变体sicy-192,为功能获得突变,高浓度蔗糖处理时,相对于野生型,sicy-192的叶绿体基因和光合作用相关核基因的表达呈明显下调。橡胶树成熟叶片中,在缺乏光照的晚上8:00到早上6:00,HbNIN8的表达量明显高于白天的表达量,HbNIN8的表达和橡胶树的光合作用呈负相关,这是首次发现叶绿体型中碱性转化酶基因的表达与光周期呈相关性。因此,HbNIN8可能和拟南芥At-A/N-InvE类似,在晚上和白天,以不同的效率水解蔗糖为葡萄糖和果糖,再通过己糖激酶信号途径,调控橡胶树叶绿体内蔗糖和淀粉的分配,进而影响叶绿体的功能。
綜上所述,本研究从橡胶树中获得了一个有功能的叶绿体型中碱性转化酶基因HbNIN8,确定了HbNIN8重组蛋白的最适酶活性温度和最适pH,并分析了HbNIN8在不同组织和在一天中不同时间叶片中的表达模式。该研究结果为揭示中碱性转化酶基因在植物叶片中的生物学功能奠定了良好基础。
参考文献
- Barratt D H P, Derbyshire P, Findlay K, et al. Normal growth of Arabidopsis requires cytosolic invertase but not sucrose synthase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(31): 13 124-13 129.
- Vargas W, Cumino A, Salerno G L. Cyanobacterial alkaline/neutral invertases: origin of sucrose hydrolysis in the plant cytosol?[J]. Planta, 2003, 216(6): 951-960.
- Vargas W, Salerno G L. The Cinderella story of sucrose hydrolysis: Alkaline/neutral invertases, from cyanobacteria to unforeseen roles in plant cytosol and organelles[J]. Plant Science, 2010, 178(1): 1-8.
- Ji X, van den Ende W, van Laere A, et al. Structure, evolution, and expression of the two invertase gene families of rice[J]. Journal of Molecular Evolution, 2005, 60(5): 615- 634.
- Murayama S, Handa H. Genes for alkaline/neutral invertase in rice: alkaline/neutral invertases are located in plant mitochondria and also in plastids[J]. Planta, 2007, 225(5): 1 193- 1 203.
- Xiang L, Le Roy K, Bolouri-Moghaddam M R, et al. Exploring the neutral invertase-oxidative stress defence connection in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2011, 62(11): 3 849-3 862.
- Martin M L, Lechner L, Zabaleta E J, et al. A mitochondrial alkaline/neutral invertase isoform (A/N-InvC) functions in developmental energy-demanding processes in Arabidopsis[J]. Planta, 2013, 237(3): 813-822.
- Battaglia M E, Martin M V, Lechner L, et al. The riddle of mitochondrial alkaline/neutral invertases: A novel Arabidopsis isoform mainly present in reproductive tissues and involved in root ROS production[J]. PLoS One, 2017, 12(9): e0185286.
- Vargas W A, Pontis H G, Salerno G L. New insights on sucrose metabolism: evidence for an active A/N-Inv in chloroplasts uncovers a novel component of the intracellular carbon trafficking[J]. Planta, 2008, 227(4): 795-807.
- Jia L Q, Zhang B T, Mao C Z, et al. OsCYT-INV1 for alkaline/neutral invertase is involved in root cell development and reproductivity in rice (Oryza sativa L.)[J]. Planta, 2008, 228(1): 51-59.
- Yao S G, Kodama R, Wang H, et al. Analysis of the rice SHORT-ROOT5 gene revealed functional diversification of plant neutral/alkaline invertase family[J]. Plant Science, 2009, 176(5): 627-634.
- Welham T, Pike J, Horst I, et al. A cytosolic invertase is required for normal growth and cell development in the model legume, Lotus japonicus[J]. Journal of Experimental Botany, 2009, 60(12): 3 353-3 365.
- 肖小虎. 巴西橡胶树蔗糖代谢相关基因家族的克隆、结构进化和表达分析[D]. 海口: 海南大学, 2013.
- Liu S J, Lan J X, Zhou B H, et al. HbNIN2, a cytosolic alkaline/neutral-invertase, is responsible for sucrose catabolism in rubber-producing laticifers of Hevea brasiliensis (para rubber tree)[J]. New Phytologist, 2015, 206(2): 709-725.
- Kumar S, Stecher G, Tamura K. MEGA7. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1 870-1 874.
- Emanuelsson O, Nielsen H, Heijne G V. ChloroP, a neural network-based method for predicting chloroplast transit peptides and their cleavage sites[J]. Protein Science, 1999, 8(5): 978-984.
- Emanuelsson O, Brunak S, von Heijne G, et al. Locating proteins in the cell using TargetP, SignalP and related tools[J]. Nature Protocols, 2007, 2(4): 953-971.
- Li H P, Qin Y X, Xiao X H, et al. Screening of valid reference genes for real-time RT-PCR data normalization in Hevea brasiliensis and expression validation of a sucrose transporter gene HbSUT3[J]. Plant Science, 2011, 181(2): 132-139.
- Long X Y, He B, Gao X S, et al. Validation of reference genes for quantitative real-time PCR during latex regeneration in rubber tree[J]. Gene, 2015, 563(2): 190-195.
- Tamoi M, Tabuchi T, Demuratani M, et al. Point mutation of a plastidic invertase inhibits development of the photosynthetic apparatus and enhances nitrate assimilation in sugar-treated Arabidopsis seedlings[J]. Journal of Biological Chemistry, 2010, 285(20): 15 399-15 407.
- Maruta T, Otori K, Tabuchi T, et al. New insights into the regulation of greening and carbon-nitrogen balance by sugar metabolism through a plastidic invertase[J]. Plant Signaling & Behavior, 2010, 5(9): 1 131-1 133.
- Maruta T, Miyazaki N, Nosaka R, et al. A gain-of-function mutation of plastidic invertase alters nuclear gene expression with sucrose treatment partially via GENOMES UNCOUPLED1-mediated signaling[J]. New Phytologist, 2015, 206(3): 1 013-1 023.
