以PMI为选择标记基因的雪柑遗传转化体系的优化
2018-05-14王会全吴少华余志雄
王会全 吴少华 余志雄


摘要 {目的]以PMI为选择标记基因对雪柑的遗传转化体系进行优化。{方法]对农杆菌的菌液浓度、实生苗培养条件、甘露糖筛选压、2,4-D浓度、2,4-D预处理时间、农杆菌侵染時间、共培养时间进行梯度试验来研究转化后的再生率,并对筛选培养基中6-BA和NAA不同浓度组合进行试验来研究抗性大苗的筛选。{结果]经过暗培养20d光培养10d条件的实生苗外植体在农杆菌菌液OD600为0.6,1.0mg/L2,4-D预处理3h,农杆菌侵染30min,共培养时间4d,筛选压为甘露糖20g/L的情况下转化后的再生率大大提高,而在筛选培养基中加入2mg/L6-BA+0.5mg/LNAA有助于抗性大苗的筛选。{结论]通过对影响转化的各种因素的优化试验建立了雪柑以PMI基因/甘露糖选择标记系统的高效遗传转化体系。
关键词 柑橘;6-磷酸甘露糖异构酶;遗传转化
中图分类号S 188文献标识码A文章编号0517-6611(2018)36-0083-07
柑橘(CitrusL.)是当今世界种植面积最大的果树,也是我国南方重要的经济果树。但柑橘作为多年生木本果树,由于童期长、遗传高度杂合性和多胚现象,柑橘育种工作困难重重。不同品种间会有6~20年的漫长童期{1],这使得常规育种周期变得很长。柑橘转基因技术在过去的十多年中取得了长足的进展,为柑橘育种开辟了一条新途径。在柑橘基因转化研究中,大多采用上胚轴、子叶、试管苗叶片、茎段等未度过童期的组织作为基因转化受体,由此得到的转基因植株同样具有童期长的缺点,且转基因植株的园艺与商品性状评价往往需要很长时间。因此,缩短童期是育种工作者的重要目标之一。
目前,转基因作物的安全性问题受到极大关注。利用遗传转化技术改良柑橘品种首先要考虑生物安全性问题,其中主要是选择标记基因的使用。使用安全的选择标记基因也是最有效的方法,这些标记基因与常规标记基因不同,没有抗生素或除草剂抗性,相对来说对生物和环境是安全的。因此,安全的选择标记基因在今后的转基因研究中将具有重要的战略意义。笔者以福建传统优良甜橙品种雪柑(C.sinensisL.Osb.)为材料,在初步建立以PMI(Phosphomannoseisomerase,磷酸甘露糖异构酶)基因为选择标记转基因体系的基础上{2],进一步优化转化体系,建立雪柑转基因技术平台,为雪柑的遗传改良、基因功能研究等奠定基础,并为其他柑橘种类转基因研究中利用这一安全的选择标记系统提供参考。
1材料与方法
1.1材料
1.1.1植物材料。从新鲜成熟雪柑果实中取出种子,选取粒大饱满的完好种子,在无菌条件下于70%乙醇中浸泡30s,再用0.1%升汞消毒8min,用无菌水清洗5~6次,剥去外种皮,划破内种皮,接种于实生苗培养基上,在16h/d(光/暗)周期下,光照度为1500lx,(25±2)℃培养。取暗培养10d、光照20d左右的上胚轴为材料,纵切法切取1cm左右上胚轴为转化材料,每次转化所用的雪柑上胚轴约90个。
1.1.2菌株及质粒。根癌农杆菌EHA105、双元载体质粒pC1301-PMI-LFY均由福建农林大学园艺学院遗传育种实验室提供,载体结构如图1所示。
1.1.3培养基及培养条件。基本培养基:MS;实生苗培养基:1/2MS+蔗糖15g/L;共培养培养基CM:MS+蔗糖30g/L;筛选培养基SMS:MS+BA2mg/L+20g/L甘露糖+Carb250mg/L。
所用培养基均添加7g/L琼脂粉,液体培养基不添加琼脂粉。用1mol/LNaOH调节pH至5.8,121℃灭菌20min。光照培养的光照时间为16h/d,光照强度为1500lx,温度(25±2)℃。
1.2方法
1.2.1E/pC1301-PMI-LFY农杆菌侵染液的准备。将超低温保存的工程菌液接种在加有100mg/LKan和100mg/LStr的YEB培养基上划线培养,28℃活化36h左右,挑单菌落于YEB液体培养基(Kan、Str100mg/L)中220r/min摇床过夜培养,OD600为0.6左右。取菌液分装于已灭菌的50mLEppendorf管中,5000r/min离心20min,去上清液,用等体积MS液体培养基重悬,220r/min摇床适应性培养2h后,再离心、等体积MS重悬,稀释测其OD600。
1.2.2转化的基本程序。
①取暗培养10d光照培养20d左右无菌雪柑实生苗的上胚轴为外植体。
②将上胚轴横切成1cm左右小段,再用手术刀纵切一分为二,置于盛有2,4-D0.5mg/L的无菌三角瓶中,浸泡2h。
③预处理后,将制备好的农杆菌侵染液(OD600为0.4左右)倒入无菌三角瓶中,摇动三角瓶使菌液与外植体充分接触,侵染20min,期间轻微振荡。
④用滤纸吸干上胚轴上的菌液,纵切切口水平朝上放置于共培养培养基CM:MS+蔗糖30g/L+2,4-D0.5mg/L中,25℃黑暗条件下共培养3d。
⑤将共培养后的上胚轴用含250mg/L羧苄青霉素的无菌水洗5~6次,放置在无菌滤纸上吸干水分,转入附加250mg/L羧苄青霉素的诱导筛选培养基SMS:MS+BA2mg/L+20g/L甘露糖+Carb250mg/L中,光下培养。
1.3遗传转化条件的优化
对影响转化率的各个因素进行优化,在单个参数优化试验中,如无特殊说明,按照以上转化基本程序进行,光下培养30d后统计分化率和大苗分化率,筛选单因素的最优梯度。
1.3.1农杆菌菌液不同OD600值对转化的影响。农杆菌侵染液OD600梯度值分别为0.1、0.4、0.6,农杆菌侵染后接种于培养皿中,每个处理接种30个外植体,每个处理3个重复,光下培养30d后统计数据。
1.3.2不同甘露糖筛选压对转化的影响。在筛选培养基SMS中,甘露糖(M)/蔗糖(S)浓度梯度设置为30/0、20/0、20/10、25/5、15/5(g/L),每个处理接种30个外植体,每个处理3个重复,观察甘露糖筛选压对转化的影响。
1.3.3雪柑无菌实生苗不同培养条件对转化的影响。分别取完全暗培养30d、暗培养10d光照20d、暗培养20d光照10d、完全光照30d的雪柑上胚轴进行转化,每个处理接种30个外植体,每个处理3个重复,观察实生苗不同培养条件对转化的影响。
1.3.4不同侵染时间对转化的影响。农杆菌侵染外植体时间梯度设置为20、30、40min,每个处理接种30个外植体,每个处理3个重复,观察侵染时间对转化的影响。
1.3.5不同共培养时间对转化的影响。外植体经农杆菌侵染后接入共培养培养基CM中,共培养时间梯度为2、3、4、5d,每个处理接种30个外植体,每个处理3个重复,观察共培养时间对转化的影响。
1.3.6预处理时2,4-D浓度对转化的影响。在农杆菌侵染前将外植体放入附加不同浓度2,4-D的MS液体培养基中浸泡3h,浓度梯度为0.5、1.0mg/L,每个处理接种30个外植体,每个处理3个重复,比较不同浓度2,4-D预处理对转化的影响。同时,在共培养培养基添加相应浓度2,4-D。
1.3.72,4-D预处理时间对转化的影响。2,4-D预处理时间梯度设置为0、2、3、12、24h。前3个处理用加入2,4-D的MS液体培养基浸泡,后2个处理用加入2,4-D的MS固体培养基培养。每个处理接种30个外植体,每个处理3个重复。同时,在共培养培养基中添加相应浓度的2,4-D。
1.3.8筛选培养基SMS中不同生长调节剂对转化的影响。共培养后,在SMS培养基中分别加入BA2mg/L、BA3mg/L、BA2mg/L+NAA0.5mg/L、BA1mg/L+NAA0.5mg/L、ZT2mg/L+NAA0.5mg/L、ZT1mg/L+NAA0.5mg/L,每个处理接种30个外植体,每个处理3个重复,30d后观察生长调节剂对转化的影响。
2结果与分析
2.1不同OD600值对转化的影响
植物外植体进行农杆菌侵染时,菌液浓度对转化频率影响较大。菌液浓度过高会导致共培养时农杆菌过度生长,造成外植体褐化死亡;菌液浓度过低,则不能使足够的农杆菌附着在外植体的伤口处,导致转化效率严重下降{3]。
从表1可以看出,OD600为0.6时,抗性外植体和大苗分化率远远高于其他2个梯度,在共培养和筛选培养时没有发现农杆菌的过度生长。在OD600为0.1和0.4的情况下,分化率差异不显著(P>0.01)。因此,在进行雪柑外植体转化时较适合菌液浓度的OD600为0.6(图2)。
2.2不同甘露糖筛选压对转化的影响
在以PMI基因为选择标记的遗传转化体系中,必须以甘露糖作为筛选剂。而雪柑上胚轴不定芽的诱导不能以甘露糖作为碳源{2],所以在SMS中设置了甘露糖和蔗糖的不同浓度梯度。从表2可以看出,在SMS培养基中加入不同浓度的蔗糖后,抗性外植体的分化率会比单纯加入甘露糖的培养基分化率要高,但这样也同时增加了假阳性芽苗的比例。在20g/L甘露糖+10g/L蔗糖和25g/L甘露糖+5g/L蔗糖2个浓度梯度时,外植体纵切面上出现大量的愈伤组织,随后在愈伤组织的表面形成芽,不过这些芽大多都有玻璃化现象;这些玻璃化的芽在以后的壮苗筛选中会黄化死亡,很难生长为健壮单株。而在SMS培养基中单纯加入30g/L甘露糖,比单纯加入20g/L甘露糖时抗性外植体的分化率有明显降低,这样就减少了对阳性芽苗的筛选力度。所以在雪柑上胚轴转化时,筛选培养基SMS中适合的甘露糖浓度为20g/L(图3)。
注:邓肯氏新复极差测验,不同字母表示差异达极显著水平(P=0.01)
Note:Differentlettersmeansignificantlydifferentatthe0.01levelbyDuncansmultiplerangetest
2.3雪柑无菌实生苗培养条件对转化的影响
外植體的培养条件对转化也有影响。根据徐海峰{2]得出的结论:外植体的培养条件对雪柑不定芽的诱导存在影响,30d的雪柑上胚轴不定芽分化效率最高。由表3可知,暗培养20d后再光培养10d的上胚轴抗性外植体的分化率为86.9%,大苗分化率为14.3%,效果最好;完全光培养30d的上胚轴抗性外植体分化率和大苗分化率分别为17.6%和0,效果最差;暗培养10d光照20d和完全暗培养30d的上胚轴抗性外植体分化率和大苗分化率差异不显著(P>0.01)。因此,以暗培养20d光照10d的上胚轴作为外植体进行农杆菌转化效果最好(图4)。
2.4不同侵染时间对转化的影响
用农杆菌对植物外植体进行侵染时,在一定的菌液浓度下,侵染时间是一个关键因素,时间不够附着在外植体上的农杆菌细胞不够数量,难以达到好的转化效果;而侵染时间过长又会引起植物外植体严重的农杆菌污染,即使加入高浓度的抑菌抗生素也是无法控制的。由表4可知,侵染30min的分化率明显比20min的高,达57.2%;当侵染时间达40min时,共培养2d时即出现农杆菌污染,无法控制,近1/4外植体由于农杆菌生长过度而软腐黄化,这种现象在侵染20、30min的处理中没有出现。因此,雪柑外植体用农杆菌进行侵染的最佳时间是30min。
2.5不同共培养时间对转化的影响
农杆菌对植物外植体进行侵染时,必须在伤口部位存活16h以上,才能进行T-DNA的转移,此期间涉及农杆菌向受伤部位的附着、Vir区基因的诱导活化及T-DNA的转移整合{3]。在黑暗中共培养适当的时间能提高不定芽的再生效率和转化效率,对共培养时间的优化结果如表5所示:共培养2d的抗性芽分化率只有5.3%,其原因为培养时间过短,阻碍了T-DNA的有效转移;共培养3d的分化率为21.6%;共培养4d的分化率最高达45.1%;而共培养5d时外植体出现大量的褐化死亡,其原因是农杆菌过度生长所致。从这个结果来看,共培养时间4d是最佳的。
2.6不同2,4-D浓度预培养对转化的影响
研究表明,2,4-D在雪柑遗传转化中会不同程度地提高转化效率,而浓度过高会促进愈伤组织的形成,降低抗性外植体的分化效率{4]。故用添加2个浓度的2,4-D的MS液体培养基对外植体进行浸泡预处理3h,共培养培养基中加入相应浓度的2,4-D。由表6可知,1.0mg/L2,4-D处理后抗性外植体的分化率高达58.2%,而0.5mg/L2,4-D处理的分化率只有22.5%。所以选用1.0mg/L的2,4-D对雪柑上胚轴进行预处理转化效果最好。
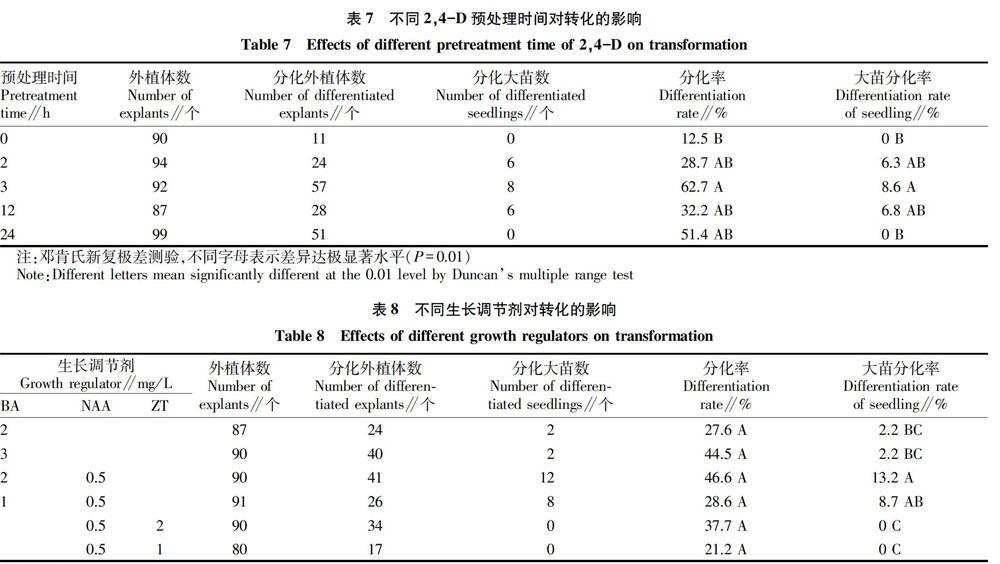
2.7不同预处理时间对转化的影响
在预培养培养基中加入2,4-D起到了活化细胞、促进T-DNA转移的作用,但是预培养时间的长短对雪柑上胚轴的转化同样具有重要的影响。该试验在预处理培养基中加入1.0mg/L2,4-D,同时在共培养培养基中加入1.0mg/L2,4-D。从表7可以看出,预处理3h时抗性外植体分化率最高达62.7%;在3h之前随着时间的增长,抗性外植体分化率逐渐增高;而经过长时间预处理时,抗性外植体分化率缓慢下降。这说明,长时间在无生长调节剂的培养基上培养,阻碍了细胞的进一步分裂生长,加快了细胞的老化,从而使农杆菌侵染效率下降;而适度的预处理则促进了细胞快速分裂,从而有助于转化效率提高。
2.8筛选培养基SMS中添加不同生长调节剂对转化的影响
从表8可以看出,2mg/LBA+0.5mg/LNAA组合的抗性外植体分化率最高达46.6%,大苗分化率也是最高达132%。邓肯氏新复极差测验结果表明,2mg/LBA+0.5mg/LNAA与其他浓度组合对转化效率的影响差异不显著。这说明在筛选培养基中生长调节剂的不同浓度组合不是转化效率的主要影响因素,但是不同组合对抗性芽的筛选有影响。所以在该试验中,SMS中的生长调节剂组合为2mg/LBA+0.5mg/LNAA。
3讨论
笔者通过对影响转化的各种因素的优化试验建立了雪柑PMI基因/甘露糖選择标记系统的高效遗传转化体系。试验结果表明,在菌液OD600为0.6,1mg/L2,4-D预处理3h,农杆菌侵染30min,共培养4d,筛选压为甘露糖20g/L的情况下大大提高了转化后的再生率,而在筛选培养基中加入2mg/LBA+0.5mg/LNAA有助于抗性大苗的筛选,为以后的PMI基因/甘露糖选择标记系统的研究提供了可靠的依据。
3.1农杆菌侵染用工程菌液的制备与OD600的选择
在柑橘的遗传转化研究中,常用的农杆菌菌株主要有LBA4404、A518、EHA105、EHA101和C58,由于它们的染色体背景和所含质粒不同,所采用的柑橘材料也不同,各菌株的转化效率差异显著{5]。该试验中使用的农杆菌菌株为EHA105,农杆菌的工程菌液和适当的OD600都在遗传转化体系中起到至关重要的作用。农杆菌长期在-80℃中保存容易造成质粒丢失,从而影响转化效率,所以在转化前要使用新培养的工程菌液,这样可以保证质粒的完整性,而用MS液体培养基将离心的菌体重悬后适应性培养的时间不能过短,这个过程是一个让农杆菌适应MS培养基和活化细菌的重要环节。而适当的OD600对转化的影响意义更大。植物外植体进行农杆菌侵染时,菌液浓度过高会导致共培养时农杆菌过度生长,造成外植体褐化死亡;菌液浓度过低则不能使足够的农杆菌附着在外植体的伤口处,导致转化效率严重下降。在农杆菌侵染外植体时的试验操作方面,要考虑到农杆菌与受体细胞的互作,二者充分接触,使农杆菌能够稳定附着在受体细胞上{2]。外植体上胚轴在农杆菌菌液中是悬浮的,必须隔几分钟轻微摇动三角瓶使侵染混合体系中每个外植体都能浸没到菌液中与之充分接触,力度也不能太大,否则农杆菌难以附着在外植体细胞上。侵染混合体系比例合适,50mL的三角瓶装工程菌液30mL,外植体数90个左右,过多或过少都影响转化效率,过多了农杆菌无法充分接触外植体细胞,过少了外植体往往附着农杆菌太多,共培养时农杆菌容易过度生长导致外植体死亡。
3.2甘露糖作为筛选剂在PMI选择系统中的应用甘露糖是一种正筛选底物,本身不会对植物组织造成伤害,但是非转化细胞不能利用甘露糖,而在PMI的作用下可以将6-磷酸甘露糖转化为6-磷酸果糖,6-磷酸果糖可以进入糖酵解途径为植物所应用,这就是甘露糖作为筛选底物的原理{6]。如同抗生素浓度过高会造成转化细胞的生长受到强烈抑制一样,只加甘露糖不加蔗糖也会造成大量转化细胞极度饥饿,而一定浓度的蔗糖可以缓解这种负面影响{2]。甜菜转化时,在MS基本培养基中添加30g/L蔗糖,在甘露糖浓度达2.5~3.0g/L时,苗再生完全被抑制,但获得最佳转化率的甘露糖筛选浓度却在1.25g/L左右,有20%~30%的外植体诱导出再生苗{7];转化玉米时筛选培养基中碳源最佳组合为5g/L蔗糖+10g/L甘露糖{8];转化水稻时采用30g/L甘露糖筛选压不变,而将蔗糖含量由30g/L逐渐递减至5g/L,可以得到理想的转化效果{9];转化辣椒时筛选培养基中碳源组合为20g/L蔗糖+15g/L甘露糖{10]。该试验参照徐海峰{2]在建立雪柑转化体系时的甘露糖浓度,按一定的梯度试验寻找合适的筛选压,发现在有蔗糖的筛选培养基SMS中,抗性芽的比例都会比较高,但外植体上长出了大量的丛生芽,多为假阳性植株,这为以后的筛选增加了难度。在转基因植株的继代筛选中,可适当地加入蔗糖加快抗性芽的生长,加快筛选进度。
3.3共培养在转化中的作用
外植体与农杆菌接种后的共培养在整个转化过程中是一个非常重要的环节。农杆菌的附着及T-DNA的切割、转移和整合都是在共培养期间完成。所以,共培养技术条件的掌握是成功转化的关键因素之一。共培养时间对转化效率有很大影响,不同转化材料或不同菌株类型所需的最佳共培养时间不同。农杆菌接种到外植体上后不能立即转化,只有在创伤部位生存16h后才能把T-DNA转移到植物细胞内{3],因此共培养时间必须长于16h。共培养时间过短,农杆菌尚未附着,T-DNA还没有充分切割、转移和整合;时间过长,植物细胞易受毒害,后续培养时难以除菌,农杆菌容易过度生长。根据试验确定在该系统中最佳的共培养时间为4d,超过时间,外植体大量的褐化死亡,农杆菌过度生长。在很多研究中,为了防止共培养时农杆菌过度生长,在共培养培养基上放置不同层数的滤纸,而该研究中未使用滤纸,在4d时农杆菌没有过度生长,这样就降低了试验操作难度。
有研究表明共培养时的温度对遗传转化效率存在影响{11]。而该试验由于条件限制,未能完成对共培养温度的试验,有待于进一步证明共培养温度对雪柑遗传转化的影响。
3.4生长调节剂在转化中的作用
Cervera等{12]发现在共培养和预培养时使用0.2~1.0mg/L2,4-D可以促进愈伤组织形成,进而提高转化率和再生率。Ghorbel等{13]和Domínguez等{14]也报导了2,4-D的加入对不定芽的再生关系不大,推测其可导致植物细胞形成感受态,促进其接收外源DNA,从而提高了转化效率。Yu等{4]用不同浓度的2,4-D对外植体进行预处理并在共培养培养基中加入相应浓度的2,4-D,雪柑转化率由不进行2,4-D处理的8%提高到了12%,其GUS阳性比例相应提高了33.6%;枳的转化率由40%提高到80%,GUS阳性比例提高了26.0%,2,4-D浓度过高则会导致愈伤组织大量形成,过夜处理则导致转化效率降低。这说明2,4-D的加入活化了植物组织细胞,促进了T-DNA的转移,从而提高了转化效率。该研究是在已知2,4-D能够提高转化率的前提下,用一定浓度的2,4-D对雪柑外植体进行预培养,并在共培养时加入相应浓度的2,4-D,来优化雪柑转化中所选2,4-D的浓度。从抗性不定芽的长势来看,1mg/L2,4-D的处理使抗性不定芽筛选后期长势较好。但预培养时间过长则抗性芽的比例下降,这与Yu等{4]的结论一致。
从该试验结果可以看出,在筛选培养基中加入BA、NAA、ZT3种不同浓度的生长调节剂,对抗性芽分化率没有太明显的影响,但是对抗性大苗分化率影响较大。这也说明在筛选培养基中加入生长调节剂不能从根本上影响转化率的提高,而只是在芽的生长分化中起到了作用,加快了其形态建成,这也与以往外源激素在组织培养中的作用研究得到统一。在筛选培养基中不同浓度生长调节剂的组合促进了抗性大苗分化,这为后面转基因植株的筛选和培养提供了便利。
參考文献
{1]PEAL,MARTNTRILLOM,JUREZJ,etal.ConstitutiveexpressionofArabidopsisLEAFYorAPETALA1genesincitrusreducestheirgenerationtime{J].Naturebiotech,2001,19:263-267.
{2]徐海峰.以PMI基因为选择标记雪柑转基因体系的建立{D].福州:福建农林大学,2007.
{3]王关林,方宏筠.植物基因工程{M].2版.北京:科学出版社,2002.
{4]YUCH,HUANGS,CHENCX,etal.FactorsaffectingAgrobacteriummediatedtransformationandregenerationofsweetorangeandcitrange{J].Plantcelltissueandorganculture,2002,71:147-155.
{5]黄涛,李耿光,张兰英,等.柑桔遗传转化技术的研究进展{J].广西植物,2004,24(2):134-138.
{6]杨莉,徐昌杰,陈昆松.PMI/甘露糖筛选体系在植物转基因中的应用{J].林业科学,2005,41(3):137-141.
{7]JOERSBOM,DONALDSONI,KREIBERGJ,etal.Analysisofmannoseselectionusedfortransformationofsugarbeet{J].MolBreed,1998,4(2):111-117.
{8]NEGROTTOD,JOLLEYM,BEERS,etal.Theuseofphosphomannoseisomeraseasaselectablemarkertorecovertransgenicmaizeplants(ZeamaysL.)viaAgrobacteriumtransformation{J].PlantCellRep,2000,19(8):798-803.
{9]LUCCAP,YEXD,POTRYKUSI.Effectiveselectionandregenerationoftransgenicriceplantswithmannoseasselectiveagent{J].Molecularbreeding,2001,7(1):43-49.
{10]KIMJY,JUNGM,KIMHS,etal.Anewselectionsystemforpepperregenrationbymannose{J].Journalplantbiotechnology,2002,4(3):129-134.
{11]胡繁荣,夏英武.辐照对高羊茅愈伤组织诱导及农杆菌介导转化的影响{J].上海交通大学学报(农业科学版),2005,23(2):158-162.
{12]CERVERAM,PINAJA,JUREZJ,etal.Agrobacteriummediatedtransformationofcitrange:Factorsaffectingtransformationandregeneration{J].Plantcellreports,1998,18:271-278.
{13]GHORBELR,JUREZJ,NAVARROL,etal.Greenfluorescentproteinasascreenablemarkertoincreasetheefficiencyofgeneratingtransgenicwoodyfruitplants{J].TheorApplGenet,1999,99:350-358.
{14]DOMNGUEZA,GUERRIJ,CAMBRAM,etal.Efficientproductionoftransgeniccitrusplantsexpressingthecoatproteingeneofcitrustristezavirus{J].PlantCellRep,2000,19:427-433.
