高效生物絮凝剂产生菌的筛选及培养优化
2018-05-14陈成,刘人荣,夏祥,邱成书,谢翼飞,陈存
陈成,刘人荣,夏祥,邱成书,谢翼飞,陈存
摘要 [目的]筛选和优化高效生物絮凝剂产生菌。[方法]从活性污泥中分离筛选得到1株高活性的生物絮凝剂产生菌株B17,从生理生化特征、形态特征等方面对该菌进行初步鉴定,采用单因素试验优化培养时间、碳源、氮源、碳氮比、初始pH 、接种量等培养条件。[结果]B17为克雷伯氏菌属(Klebsiella SP.)。优化后发酵培养基的碳源为乳糖,氮源为乙酸铵,碳氮比为20∶1,发酵初始pH 为6.0~7.0,接种量为3%,在该最优组合的发酵条件下以30 ℃、160 r/min培养24 h,絮凝活性可提高25.0%~38.3%。[结论]该研究可为筛选高效的絮凝剂产生菌、优化菌株的培养条件、提高絮凝剂的活性提供借鉴。
关键词 生物絮凝剂;培养条件;克雷伯氏菌
中图分类号 S181 文献标识码 A 文章编号 0517-6611(2018)06-0052-03
Screening and Culture Optimization of a Highefficiency Bioflocculantproducing Strain
CHEN Cheng1,LIU Renrong1,XIA Xiang2 et al (1.School of Chemistry and Life Science,Chengdu Normal University,Chengdu,Sichuan 611130;2.Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu,Sichuan 610041)
Abstract [Objective]To screen and optimize high efficiency bioflocculant producing bacteria.[Method]Screening of a high activity bioflocculant producing strain B17 was isolated from activated sludge,a preliminary identification of the bacteria was carried out from the physiological and biochemical characteristics,morphological characteristics,using the single factor experiment to optimize incubation time,carbon source,nitrogen source and carbon nitrogen ratio,initial pH,inoculation amount of culture conditions.[Result]B17 was identified as Klebiella SP..Lactose was the optimum carbon source,ammonium acetate was the most optimal nitrogen source,the ratio of carbon to nitrogen(C/N) in the culture broth was at 20∶1,the optimal initial pH was about the scope of 6.0-7.0,and inoculum size was about 3% the highest flocculating activity was obtained.inoculum size 3%,culture temperature 30 ℃,shaking speed 160rpm and incubation time 24 hours.Under the optimum culture conditions,the final flocculating were increased by 25%-38.3%.[Conclusion]This study can be used for reference for screening highly efficient flocculant producing bacteria,optimizing the culture conditions of strains and improving the activity of flocculants.
Key words Bioflocculant;Culture conditions;Klebsiella SP.
生物絮凝劑是天然高分子絮凝剂中的重要组成部分,是一种通过微生物发酵、分离提取而得到的新型污水处理剂[1],与传统的铝盐、铁盐絮凝剂相比,生物絮凝剂安全无毒、易于降解、高效且无二次污染 [2-4],可用于多种水体的处理[4-7],有着广阔的应用前景。
近年来,生物絮凝剂在我国引起了研究开发者的重视,但目前多数处于菌种的筛选阶段,市场上生物絮凝剂的价格较化学絮凝剂昂贵。不同菌种产生的絮凝成分差别较大,而不同培养条件也会对絮凝效果和产量产生较大影响[7-10]。因此,筛选高效的絮凝剂产生菌、优化菌株的培养条件、提高絮凝剂的活性具有重要的现实意义。该研究从活性污泥中筛选出1株高效絮凝剂产生菌,对其进行初步鉴别,并对其在不同培养条件下产生的絮凝剂活性进行探究。
1 材料与方法
1.1 材料 活性污泥取自成都某污水处理厂,培养基中使用的化学试剂NaCl、K2HPO4、KH2PO4、MgSO4·7H2O、CaCl2等均为分析纯。
分离培养基:酵母浸膏5 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,pH 7.2~7.4,自来水1 L,于121 ℃灭菌20 min。种子培养基:葡萄糖10 g,K2HPO4 5 g,KH2PO4 2 g,NaCl 0.1 g,MgSO4·7H2O 0.2 g,尿素0.5 g,酵母膏0.5 g,pH 7.2~7.5,自来水1 L,于121 ℃灭菌20 min。发酵培养基成分与种子培养基相同。
1.2 方法
1.2.1 菌株的分离纯化。将100 mL无菌水和玻璃珠装入已灭菌的250 mL三角瓶中,然后把采集到的10 g活性污泥样品放入三角瓶中。为了使样品充分分散于水中,将三角瓶放在摇床上振荡2 h,摇床转数为200 r/min,静置20 min后,进行倍比稀释。无菌操作吸取0.1 mL各稀释度的样品悬浊液于各分离培养基上,用无菌玻璃刮刀旋转涂布均匀,30 ℃条件下培养24~48 h后观察结果。
通过观察分离得到的菌落,把具有不同菌落特征的菌株挑出,并在平板上反复划线培养纯化。最终,把纯化得到的单菌落转接到种子培养基上,于4 ℃保存,备用。
1.2.2 絮凝剂产生菌的筛选和鉴定。在保存的种子菌株斜面上取一环,接至装有100 mL种子培养基的250 mL锥形瓶中,放置在恒温摇床培养,摇床温度为30 ℃,转速为160 r/min振荡培养24 h。发酵培养方法:按5%的接种量将种子培养液接入装有250 mL发酵培养基的500 mL锥形瓶中,于30 ℃、160 r/min的条件下振荡培养。
一般用于絮凝法处理的颗粒直径的上限为 10 μm,根据斯托克斯的公式,直径为 10 μm 的颗粒在水中的自然下沉所需要时间为每 1 m 水深大于100 min[11],因此用高岭土悬浊液代替废水进行絮凝试验具有很好的代表性。取1 mL絮凝剂液体加入1.25 mL CaCl2,再加入20 mL(5 g/L)高岭土悬液搅拌混匀,室温放置5 min,在550 nm处测量吸光值。
对菌株进行初筛和复筛,确定絮凝效果较好的菌株。采用Olympus生物显微镜及成像系统对筛选出来的菌种形态特征进行观察,并参考《伯杰氏细菌鉴定手册》,结合生理生化试验进行初步鉴定。
1.2.3 高效絮凝劑产生菌的培养优化。测定筛选出来的菌株种龄对生长的影响,开始每2 h取样,用分光光度计测定550 nm处的吸光值,6 h后每间隔1 h取样,绘制生长曲线。采用单因素试验方法,以最优培养时间,分别改变其培养条件,包括培养基的营养成分(不同碳源、氮源及碳氮比)、培养基pH、接种量等,在30 ℃ 160 r/min的摇床中进行培养。对高岭土悬浊液进行絮凝试验,在分光光度计550 nm处测定絮凝率,600 nm处测定菌体的浊度,优化絮凝剂产生菌的培养条件。
2 结果与分析
2.1 高效絮凝剂产生菌的筛选和鉴定 从样品中共分离得到89种菌株,经初筛得到19株对高岭土悬浊液具有明显絮凝活性的菌株,再经过复筛后发现编号为B17的菌株的发酵上清液对高岭土悬液具有较强的絮凝能力,故选定B17为进一步研究对象。该菌株为短杆状、无鞭毛、有荚膜的革兰氏阴性杆菌,在固体培养基上呈半球状乳白色菌落,边缘平整、湿润、黏稠、易挑起(图1)。B17的主要生理生化试验特征见表1,根据其菌落形态和生理生化特征,参考《伯杰氏细菌鉴定手册》,该菌初步鉴定为克雷伯氏菌(Klebsiella SP.)。
2.2 高效絮凝剂产生菌B17的培养优化
2.2.1 生长曲线的绘制。 高效絮凝剂产生菌B17菌体的生长状况随着培养时间的变化规律见图2。由图2可知,0~4 h,菌体处于适应期,菌体数目基本不增加。4~11 h菌体进入对数生长期,该时期菌体快速增殖,培养基中的营养物质迅速被消耗。12~15 h菌体进入稳定期;15 h后菌体进入衰亡期。衰亡期种子液的浊度增加可能是由于菌体进入后期营养物质几乎被消耗完,导致菌体衰亡、裂解,释放菌体内容物,从而使浊度增加。因此,选择培养10 h的种子液作为后续接入发酵液的培养时间。
2.2.2 碳源优化。分别以1%葡萄糖、蔗糖、乳糖、柠檬酸、甘露糖和乙醇作为碳源,在种子培养液培养10 h后接入发酵液,在30 ℃ 160 r/min摇床中进行培养,于550 nm处测定絮凝活性和600 nm处测定菌体量,结果见图3。OD550值越小,上清液越澄清,发酵液絮凝效果越好;OD600数值越高,表明发酵液中菌种生长状况越好。由图3可知,乳糖为碳源的发酵液OD550值为0.059,对高岭土悬液的絮凝活性最好;OD600为0.582,菌体量相对较高。与以葡萄糖为碳源的原始培养基相比,活性明显增加,因此发酵培养基中的最适碳源为乳糖。
2.2.3 氮源优化。分别以1 g/L的乙酸铵、蛋白胨、牛肉膏、硫酸铵代替0.5 g/L尿素和0.5 g/L酵母膏优化培养基氮源,对照为未添加氮源的培养基。碳源选择为乳糖,接种时间为10 h的条件下,发酵培养后测定絮凝剂活性和菌体量,结果见图4。在以乙酸铵为氮源的情况下,其发酵液对高岭土的絮凝效果最佳,OD550为0.090,菌体量OD600为0.557,较原培养基絮凝活性提高了约17%,又因絮凝剂的絮凝活性是评价其是否具有工业化应用潜力的重要指标,故选择最佳氮源为乙酸铵。
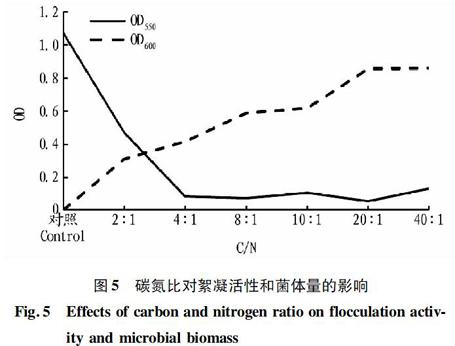
2.2.4 碳氮比优化。调节C/N比分别为2∶1、4∶1、8∶1、10∶1、20∶1、40∶1进行发酵培养,对照为原培养基碳氮比。碳源为乳糖,氮源为乙酸铵。得到的絮凝产物和菌体活性见图5。由图5可知,当碳氮比为20∶1时,对高岭土的絮凝活性最高,OD550为0.048,菌体量较多,OD600为0.712。因此,菌体选择最佳碳氮比为20∶1。
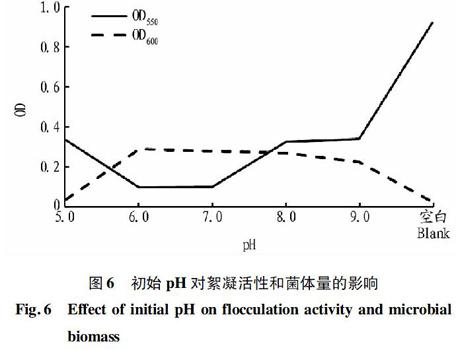
2.2.5 初始pH优化。将培养液的初始pH调至4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0进行发酵培养,得到的絮凝产物和菌体活性见图6。由图6可知,在pH为6.0时,OD550为最低值,仅0.082,菌体量较多,OD600为0.233,而在pH为7.0时的OD550与OD600值与pH为6.0时相差不大。因此,培养液的最适pH为6.0~7.0,对高岭土悬液的絮凝活性最高,可见B17号菌更适合在中性或者偏弱酸性的环境生长。
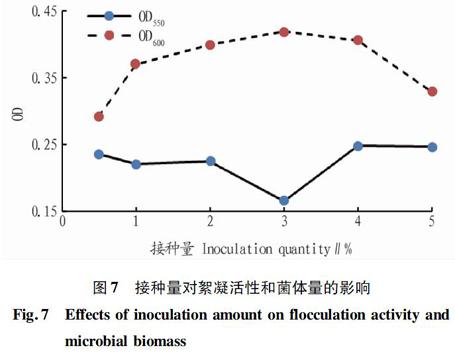
2.2.6 接种量优化。按照1%、3%、5%、7%、10%、12%的接种量将种子液接入发酵液,在前面得到的优化条件下进行培养,结果见图7。图7显示,在接种量为3%时,絮凝活性最好,OD550值最低,且菌体量最高,比原接种量5%活性提高,因此选择最佳接种量为3%。
3 结论
(1)该研究结果表明,生物絮凝剂的产生不仅取决于微生物营养的碳源、氮源、C/N等,还与培养时间、初始pH、接种量等有关。优化后的B17培养条件:最适碳源为乳糖,氮源为乙酸铵,碳氮比为20∶1,发酵初始pH为6.0~7.0,接种量为3%,在此最优组合的发酵条件下置于摇床(温度30 ℃,160 r/min)中培养24 h,絮凝活性可提高25.0%~38.3%。
(2)从活性污泥中初筛和复筛得到絮凝活性较高的菌株B17,通过菌株的形态特征、生理生化试验结果鉴定,确定该菌株为克雷伯氏菌属(Klebsiella SP.)。
参考文献
[1] 何宁,李寅,陈坚,等.生物絮凝剂的最新研究进展及其应用[J].微生物学通报,2005,32(2):104-108.
[2] DENG S B,BAI R B,HU X M,et al.Characteristics of a bioflocculant produced by Bacillus mucilaginosus and its use in starch wastewater treatment [J].Applied microbiology & biotechnology,2003,60(5):588-593.
[3] 刘金亮,姜彬慧,赵鑫,等.一株高效絮凝剂产生菌的分离和鉴定[J].东北大学学报(自然科学版),2016,37(5):706-710.
[4] LIAN B,CHEN Y,ZHAO J,et al.Microbial flocculation by Bacillus mucilaginosus:Applications and mechanisms[J].Bioresource technology,2008,99(11): 4825-4831.
[5] 陈熙,谢经良,鞠建松,等.印染废水高效脱色菌的研究[J].青岛理工大学学报,2008,29(3):66-69.
[6] 朱恋,王熳,张灿,等.多糖生物絮凝劑在酸性煤矿废水处理中的应用[J].给水排水,2013,39(S1):327-330.
[7] 关正军,王新志,杨一盈.藻类生物絮凝剂对沼液的絮凝效果研究[J].农业机械学报,2017,48(5):290-295.
[8] 任宏洋,王新惠,刘达玉.复合菌利用酱油废液制备生物絮凝剂及其絮凝特性分析[J].中国环境科学,2010,30(8):1050-1055.
[9] 赵起政,路宏科,彭涛,等.马铃薯淀粉废水高活性絮凝菌的分离鉴定[J].中国酿造, 2015,34(2):76-81.
[10] LI Q,LIU H L,QI Q S,et al.Isolation and characterization of temperature and alkaline stable bioflocculant from Agrobacterium sp.M503[J].New biotechnology, 2010, 27(6):789-794.
[11]张自杰,林荣忱,金儒霖.排水工程:下[M].北京:中国建筑工业出版社,2000:61-63.
