液相色谱-串联质谱法测定文蛤中3种腹泻性贝类毒素
2018-05-14张秋云朱晓华杨洪生沈美芳谭秀慧夏莉萍
张秋云 朱晓华 杨洪生 沈美芳 谭秀慧 夏莉萍
摘要 [目的]以文蛤中的腹泻性贝类毒素大田软海绵酸贝类毒素(OA)、鳍藻毒素-1(DTX1)、鳍藻毒素-2(DTX2)为研究对象,建立腹泻性贝类毒素的超高效液相色谱-串联质谱(LC-MS/MS)检测方法。[方法]以文蛤样品为代表,用甲醇提取,采用碱水解将乙酰酯化的OA、DTX1、DTX2转化成游离OA、DTX1、DTX 通过Strata-X柱净化,过膜后,用液相色谱-串联质谱测定,以基质标准曲线进行外标法定量。该试验以流动相A为水溶液(含2 mmol/L甲酸铵和1‰甲酸),流动相B为乙腈溶液(含2 mmol/L甲酸铵和1‰甲酸),流速350 μL/min,柱温40 ℃,负离子扫描,多反应监测模式下进行定性与定量分析。[结果]3种腹泻性贝类毒在1~100 μg/L关系良好,3个添加水产的回收率都在75%~90%,RSD都在3.0%~6.6%。[结论]利用此方法检测文蛤中的腹泻性贝类毒素具有灵敏度高、重复性好、操作简单的特点。回收率等均能满足日常对3种常见的腹泻性贝类毒素的检测要求。
关键词 腹泻性贝类毒素;液相色谱-串联质谱;文蛤
中图分类号 TS254.7文献标识码 A文章编号 0517-6611(2018)34-0166-03
腹泻性贝类毒素(diarrhetic shellfish poisoning,DSP)是由有毒赤潮藻类鳍藻属和原甲藻属的一些种类产生的脂溶性多环醚类生物活性物质,不易溶于水,热稳定性极高[1],主要包括大田软海绵酸贝类毒素(OA)、鳍藻毒素-1(DTX1)、鳍藻毒素-2(DTX2)[2]。该毒素可在贝类等滤食性动物体内富集,通过食物链传递至人类,引起腹泻性中毒,危害食用者健康[3]。腹泻性贝类毒素在全球沿岸海域均有分布,是世界范围内最具威胁的赤潮藻毒素之一。腹泻性贝毒虽然不是一种可致命的毒素,通常也只是引起轻微的肠胃疾病,而且症状消失也较快,没有强烈的急性毒素,但是大田软海绵酸贝类毒素是强烈的致癌因子,其长期毒性应该引起重视。目前常用腹泻性贝类毒素检测分析方法主要包括小鼠生物法[4]、液相色谱法[5]、液相色谱-质谱联用法[6]、细胞毒性检测法[7]、免疫荧光层析检测法[8]等。小鼠生物法主要缺陷是操作繁琐,不能确定样本中毒素成分和结构;免疫荧光层析检测法检测成分假阳性率较高,结果不能代表样本整体毒性;液相色谱法需要繁琐的衍生步骤,衍生试剂存在性质不稳定等问题,可能会导致DSP不能够完全衍生化[9-12],而且对结构类似物不能有效地分离,在灵敏度和选择性上还有待改进;液相色谱-串联质谱检测方法结合了质谱强大的定性定量功能和液相色谱优越的分离能力,现在越来越多地被应用到腹泻性贝类毒素的分析检测中。
笔者建立了3种代表性DSP毒素OA、DTX1、DTX2的液相色谱-串联质谱(LC-MS/MS)检测方法。
1 材料与方法
1.1 试材 OA、DTX1、DTX2 标准品购自加拿大海洋生物科学研究所(NRC)。色谱级甲醇(TEDIA公司),色谱级乙腈(TEDIA公司),色谱级甲酸、色谱级氨水(ROE公司),色谱级甲酸铵(含量≥99.0%),色谱级氢氧化钠(含量≥980%),实验室用水为超纯水。文蛤购买于南京市某水产品市场。
1.2 仪器
1290 型高效液相色谱(美国 Agilent 公司),AB 4500Trap 三重四级杆液质联用仪(Applied Biosystems C),TE612-L型电子天平(S 公司),Allegra 64R型高速冷冻离心机(BECKMAN COULTER 公司),Maxi Mix Ⅱ型旋涡混匀仪(美国 Thermolyne 公司),烘箱。
1.3 标准溶液的配制
根据需求,分别吸取适量的各腹泻性贝类毒素标准溶液于5 mL棕色容量瓶中,用50%甲醇水溶液稀释并定容,配制成标准储备液。用空白基质液稀释储备液配制成各个不同浓度的标准工作液。各类标准溶液避光保存于-12 ℃。
1.4 样品预处理
准确称取(1.00±0.05) g样品于25 mL离心管中,加入4.5 mL甲醇,渦旋混匀后,超声5 min,离心5 min,取重复提取1次,合并上清液用甲醇定容至10 mL。取1 mL中提取液,加入125 μL 2.5 mol/L氢氧化钠溶液,于76 ℃温育40 min。冷却后,加入125 μL 2.5 mol/L盐酸。水解液用3 mL水稀释,过Strata-X柱(Strata-X柱活化:1 mL 甲醇,1 mL 30% 甲醇),再用1 mL 20%甲醇淋洗,用1 mL 03% 氨水甲醇洗脱,收集洗脱液。用0.22 μm的有机滤膜过滤,供超高效液相色谱串联质谱分析。
1.5 LC-MS/MS 分析条件
1.5.1 色谱条件。
色谱柱:Agilent C8(2.1 mm×100 mm,2.7 μm);柱温40 ℃;进样量为10 μL,流动相:A为水溶液(含2 mmol/L甲酸铵和1‰甲酸),B为乙腈溶液(含2 mmol/L甲酸铵和1‰甲酸),采用等度洗脱方式,A/B=20/80(V/V);流速350 μL/min。
1.5.2 质谱条件。
离子源:电喷雾离子源 ESI;扫描方式:负离子(ESI-)扫描;检测方式:多反应监测模式(MRM);喷雾电压:-4 500 V;离子源温度:550 ℃;气帘气压力:206.8 kPa;雾化气压力:379.2 kPa;辅助加热气压力:379.2 kPa。碰撞气CAD:Medium。
2 结果与分析
2.1 质谱分析条件的优化
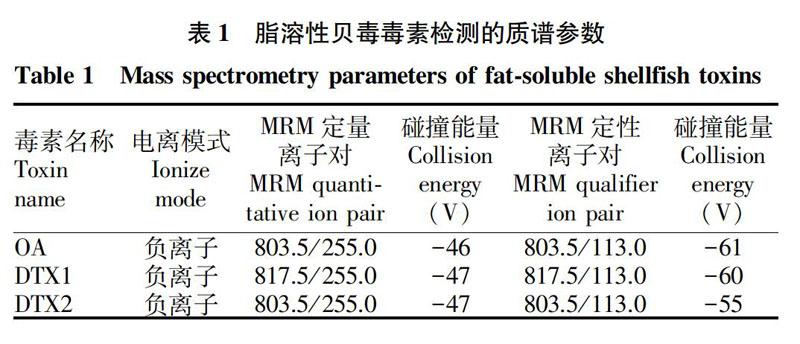
该试验采用ESI源,多反应监测(MRM)。母离子的选择(Q1 Scan)将用50%甲醇水溶液稀释的标准毒素溶液,采用以10 μL/min流速的流动注射泵进样分析,在负离子模式下进行一级离子扫描,寻找各毒素的母离子分子离子峰OA([M-H]-,m/z 803.5)、DTX1([M-H]-,m/z 817.5)、DTX2([M-H]-,m/z 803.5),然后,在离子扫描模式下(Product lon MS2)选择干扰性较小、信号强度较高的2个子离子,在多反应监测模式(MRM)下建立合适的MRM离子对通道,优化并获得最佳的去簇电压(DP)、碰撞能量(CE)。各个毒素选择的母离子、去簇电压(DP)、碰撞能量(CE)参数见表1。
2.2 流动相的选择
流动相的pH和在纯溶剂中添加的物质会影响目标化合物的峰型和保留时间。该试验分别采用乙腈-水、乙腈-甲酸铵(含有2 mmol/mL甲酸铵)、乙腈-甲酸铵(含有2 mmol/mL甲酸铵,0.1%甲酸)作为流动相,经测定分析发现,乙腈-水作为流动相时峰型较宽,响应值较低;而乙腈-甲酸铵(含有2 mmol/mL甲酸铵)作为流动相时,3种DSP的峰型较好,灵敏度提高;乙腈-甲酸铵(含有2 mmol/mL甲酸铵,0.1%甲酸)作为流动相,对3种DSP的响应值有所抑制。但是在实际检测已经添加含有3种DSP的文蛤样品时发现,在乙腈-甲酸铵(含有2 mmol/mL甲酸铵)作为流动相时,响应值很低,几乎不出峰,在乙腈-甲酸铵(含有2 mmol/mL甲酸铵,0.1%甲酸)作为流动相时,响应值较高,峰型较好,甲酸能有效地降解基质中某些杂质的干扰,流动相的pH对3种DSP毒素的影响较大。因此最终选择了乙腈-甲酸铵(含有2 mmol/mL甲酸铵,0.1%甲酸)作为流动相。
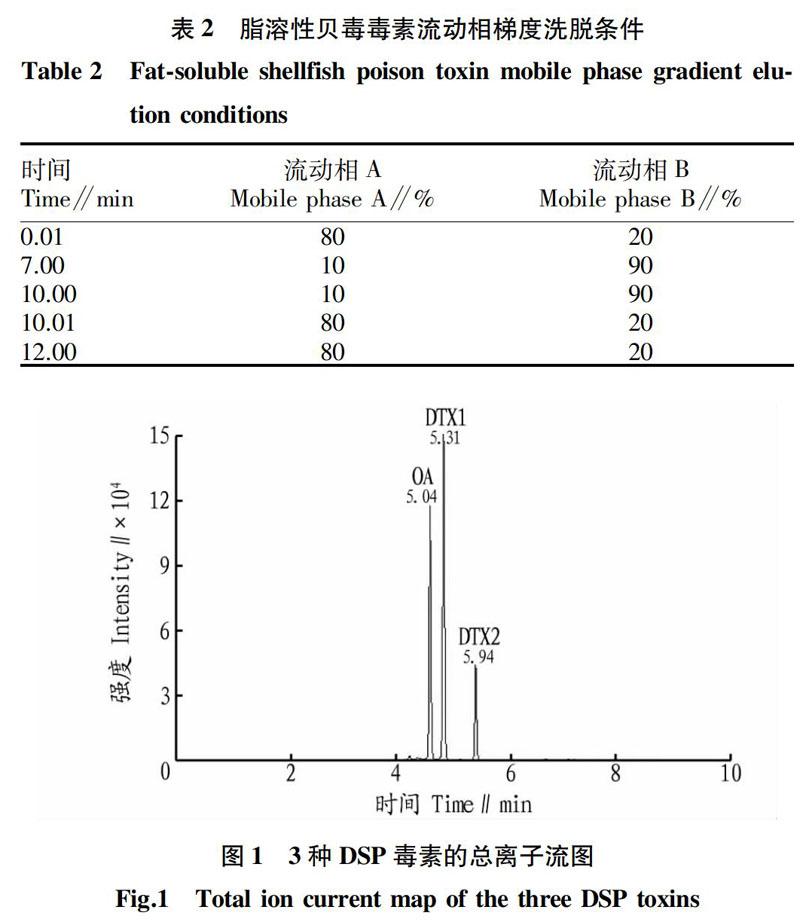
为了能使3种DSP分离开,通过流动相条件的筛选,最终选择梯度洗脱的方式分离毒素。流动相A:水溶液,流动相B:乙腈溶液,二者均含有2 mmol/L甲酸铵和0.1%甲酸;0.01~7.00 min流动相B的比例从20%升高至90%;7.00~10.00 min,维持90%流动相B;10.00~10.01 min,流动相B降为20%,平衡色谱柱2 min。流动相梯度洗脱条件见表 在此流动相洗脱梯度下的3种DSP的总离子流图见图1。
2.3 净化条件的优化
选用3种不同的固相萃取柱Strata-X柱、HLB柱和C18柱进行净化效果分析比较,结果显示,Strata-X柱OA、DTX1、DTX2回收率都可以达到70%以上。HLB柱和C18柱3种DSP各目标组分的回收率都低于60%。因此综合考虑,最终选择的固相萃取柱为Strata-X柱。
2.4 温度条件的选择
选择在室温下静置40 min、50 ℃温育40 min、76 ℃温育40 min的3种试验效果对比分析,结果显示,在76 ℃温育40 min下OA、DTX1、DTX2加标回收率最高,而且能够有效地去除一些杂质基质的干扰。因此该试验选择76 ℃温育40 min作为温度条件。
2.5 基质效应影响
采用LC-MS/MS检测时,基质效应会直接影响目标物的测定结果。为了测定基质对3种DSP测定的结果影响,用文蛤空白样品的基质液和提取溶剂(50%甲醇水)分别配置了同一浓度的标准溶液上机分析。结果发现,用空白基质液配置的DSP标准溶液的响应值明显偏低,表明基质对DSP的响应值有抑制作用。为了提高DSP的检测结果的准确性,因此选择采用空白基质液配制DSP系列的标准工作液。
2.6 线性关系和检出限
用空白基质液分别配制OA、DTX1、DTX2质量浓度为1.00、5.00、10.00、20.00、100.00 μg/L的混合标准溶液系列,按试验方法进行测定,绘制标准曲线,线性回归方程及相关系数表见表3。结果表明,各元素的线性范围为1.00~100.00 μg/L,3种脂溶性贝类毒素的相关系数均达0.999以上。
2.7 回收率与精密度
在空白文蛤样品中添加3个浓度水平的DSP混合标准溶液,每个添加水平6个平行样品,计算回收率和测定值的相对标准偏差(RSD),结果如表4。由表4可知,各毒素的加标回收率都在75%~90%,RSD都在30%~6.6%。
3 结论
该研究建立了同时测定腹泻性贝类毒素OA(大田软海绵酸)及其衍生物DTX1(鳍藻毒素-1)和DTX2(鳍藻毒素-2)的超高效液相色谱-串联质谱法。该方法前处理比较简单,灵敏度高,重现性好,方法的回收率等均能满足日常对DSP的检测要求,适用于实际样品的检测分析。
参考文献
[1]LEE J S,YANAGI T,KENMA R,et al.Fluorometric determination of diarrhetic shellfish toxins by high-performance liquid chromatography [J].Agricultural and biological chemical,1987,51(3):877-881.
[2]李偉才,栾刚,李立,等.中国沿海部分海区贝毒毒素的调查[J].海洋科学,2000,24(9):19-22.
[3]YASUMOTO T,OSHIMA Y,YAMAGUCHI M.Occurrence of a new type of shellfish poisoning in the Tohoku district[J].Bull Japan Soc Sci Fish,1978,44(11):1249-1255.
[4]柳俊秀,胡乐琴,何培民.腹泻性贝毒素软海绵酸的昆明系小鼠生物学检测法的建立[J].生态毒理学报,2009,4(3):446-451.
[5]傅云娜,陈则玲.腹泻性贝毒的高效液相色谱法测定条件改进及其运用[J].海洋通报,2003,22(1):92-95.
[6]马景刚.LC-MS/MS(液相色谱—质谱联用)同步分析多种脂溶性贝毒的方法及应用[D].青岛:中国海洋大学,2012.
[7]黄海燕,黄爱君,庄志雄,等.腹泻性贝类毒素肝细胞毒性研究及其荧光检测法的建立[C]//中国毒理学会第三届中青年学者科技论坛暨2011年全国前列腺药理毒理学研讨会论文集.北京:中国毒理学会,2011.
[8]李军涛,候水平,姬泽薇,等.腹泻性贝类毒素的免疫荧光层析检测方法的初步建立 [J].热带医学杂志,2015,15(2):189-192.
[9]丁君.赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J].大连水产学院学报,200 16(3):212-218.
[10]赵晓芳,计融.国内外腹泻性贝类毒素管理控制措施的比对分析[J].中国热带医学,2006,6(2):350-354.
[11]杨维东,彭喜春,刘洁生,等.腹泻性贝毒研究现状[J].海洋科学,2005,29(5):66-72.
[12]刘仁沿.我国贝类中赤潮毒素腹泻性贝毒免疫检测技术研究[D].大连:大连海事大学,2008.
