发酵乳清蛋白制备抗氧化肽工艺的优化
2018-05-14胡姝敏刘宝华孙欣瑶李晓东王春潮
文/胡姝敏 刘宝华 孙欣瑶 李晓东 王春潮
(1 黑龙江龙丹乳业科技股份有限公司;2 东北农业大学食品学院)
抗氧化剂在国内外发展较快,在越来越广泛的领域进行应用。Harman提出的自由基理论指出,过多的自由基会造成细胞受损害,如磷脂膜、蛋白损害和DNA损害,这和一些疾病息息相关,如肥胖症、动脉粥样硬化、癌症等[1~3]。人们也有这样的意识,即人体内因氧化产生的自由基是导致人衰老和部分疾病的原因[4],抗氧化剂应用范围广,不仅可以用于食品中以延长保质期,而且可用于保健食品及化妆品中作为功能成分。抗氧化剂有繁多的种类,但是化学合成的抗氧化剂如BHA、BHT等使用受限,其使用不当可以引起DNA损伤,且本身具有毒副作用[5,6],为增加安全性,很多国家对抗氧化剂的添加量都规定了ADI值[7]。因此,人们逐渐开始研究提取天然抗氧化剂,主要是从植物、动物组织中提取,已研制出乳清蛋白肽、大豆多肽及肌肽等,根据其不同的功能性应用于不同的产品中,如抗氧化肽、降胆固醇肽、降血压肽、抗菌肽[8]等。活性肽是对机体健康有影响的特殊蛋白质片断,对促进机体健康,防御疾病功能具有积极作用[9],能使机体组织损伤降低到最小,其功能主要取决于所含的氨基酸组成和序列,可以添加到功能性食品或特殊的营养应用中[10]。
发酵方法相比于蛋白酶解法有其独特的优点,微生物产酶的过程和酶水解蛋白的过程结合为一步,酶的分离和产物纯化步骤被省去,生产成本也随之降低。微生物产生的端肽酶对活性肽末端起到修饰的作用,因此小肽不但苦味降低,同时还有发酵产生的天然芳香味,有较好的适口性[11]。抗氧化肽能有效地清除体内累积的自由基生物活性物质,有效保护细胞及组织的生理功能。氧化与人类及其它动物的许多疾病相关[12,13],例如癌症、衰老、心脑疾病等,适当摄入具有抗氧化活性的物质会起到预防疾病的作用。抗氧化肽能避免脂质过氧化的发生,减缓油脂的氧化速率,延长产品的保藏期。通过对抗氧化多肽的研究开发,能够为更多领域提供更安全、更可靠、抗氧化活性更高的抗氧化剂,为抗氧化多肽的进一步研究提供依据,相信抗氧化多肽会有一个更广阔的应用前景。本研究主要是确定发酵菌种和优化抗氧化多肽发酵工艺参数。
1 材料与方法
1.1 材料与试剂
试验菌株:瑞士乳杆菌(lactobacillus Helveticas)CICC22818、CICC22815,干酪乳杆菌(Lactobacillus casei)20538、鼠李糖乳杆菌(Lactobacillus rhamnosus)22173、23119,来自东北农业大学食品学院重点试验室菌种保藏库。
乳清浓缩蛋白(WPC80):湖北欣和生物科技有限公司提供;DPPH:Sigma公司;甘氨酸:天津博迪化工股份有限公司;茚三酮:天津市科密欧化学试剂开发中心。
1.2 仪器与设备
JD500-2电子天平:沈阳龙腾电子称量仪器有限公司;85-2恒温磁力加热搅拌器:常州国华电器有限公司;数显恒温水浴箱:上海比朗仪器有限公司;离心机:上海卢湘仪离心机仪器有限公司;UT-1800紫外可见分光光度计:北京普析通用仪器有限公司;SYQ-DSX-280B手提式蒸汽灭菌锅:上海申安医疗器械厂;PHS-3C精密pH计:上海精密科学仪器有限公司。
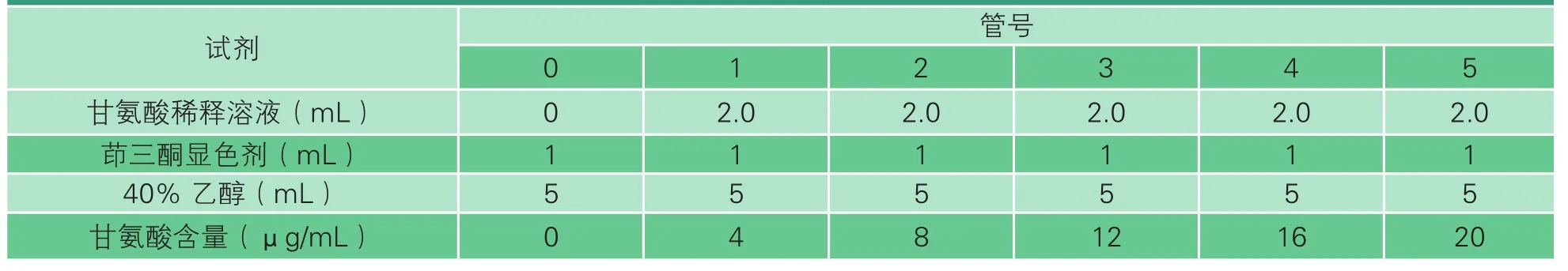
表1 甘氨酸标准曲线的制作
2 试验方法
2.1 菌株的筛选
2.1.1 产酸能力的测定
使用PHS-3C精密pH计进行测定。pH计使用前应分别使用pH值为4.01和6.88的标准缓冲溶液(20 ℃)进行校准。
2.1.2 活菌数的测定
在无菌操作下取5mL发酵样品,加入45 mL无菌生理盐水中,充分振荡混匀,然后根据样品中含菌量的不同,做10 倍系列不同浓度稀释,取适当梯度的稀释液倒在MRS琼脂平板上,37 ℃恒温培养72 h,对菌落数进行计数(以每mL样品中的菌落数进行计数)。
2.1.3 水解度的测定
水解度的测定[14]采用茚三酮显色法,用甘氨酸的量计算。原理为:蛋白质水解物和茚三酮发生显色反应生成蓝色物质,用分光光度计进行测定。
(1)甘氨酸标准曲线的绘制
准确称取0.1g干燥的甘氨酸,溶解定容至100 mL容量瓶中,再吸取2.00 mL溶液定容至100 mL容量瓶中,得到浓度为20 μg/mL的溶液。再以此溶液分别稀释成甘氨酸含量为2~20 μg/mL的溶液用于绘制标准曲线(表1)。取稀释液2.00 mL于试管中,加入1.00 mL显色剂,混匀后沸水浴中加热15 min,同时作空白试验,冷水冷却后,加入5.0 mL 40%(V/V)乙醇溶液混匀,并放置15 min,用空白组在570 nm处调零,测定试验组的吸光值。(2)茚三酮显色剂的配制
2 g茚三酮溶解于100 mL蒸馏水中,溶液置于棕色瓶中保存,现用现配。
(3)茚三酮法测定蛋白水解度
取蛋白水解液0.5 mL定容至50 mL容量瓶中,再从中取0.40 mL稀释液于试管中,用蒸馏水稀释5倍,加入1.00 mL茚三酮溶液,混匀后沸水浴15 min,同时作空白试验。根据测得的吸光度计算乳清浓缩蛋白水解度。
计算蛋白水解度公式如下:

其中:htot是指每克被裂解蛋白质的肽键毫摩尔数,WPC htot=8.8(mmol/g);6.25×N为乳清蛋白含量(g/L),采用凯氏定氮法进行测定。
2.2 乳清蛋白抗氧化肽制作工艺的优化
2.2.1 单因素试验
(1)乳清蛋白含量对水解度和DPPH自由基清除率的影响
取适量乳清蛋白浓缩粉〔6%、8%、10%、12%、14%(W/V)〕,用去离子水配制,在63 ℃条件下灭菌30 min,冷却到室温,并按照2%的比例接种瑞士乳杆菌CICC 22818,在恒温培养箱中37 ℃培养24 h,于6 000 rpm条件下离心15 min,测定蛋白水解度,以蛋白水解度为指标,并测定不同浓度的乳清浓缩蛋白对DPPH自由基清除能力的影响。
(2)发酵时间对水解度和DPPH自由基清除率的影响
取适量乳清蛋白浓缩粉,加入去离子水配制成浓度为10%(W/V)的溶液,在63 ℃条件下灭菌30 min,冷却到室温,并按照2%的比例接种瑞士乳杆菌CICC 22818,在恒温培养箱中37 ℃条件下分别培养24、36、48、60、72 h,取20 mL加入离心管中,6 000 r/min离心15 min,测定蛋白水解度和DPPH自由基清除能力,研究发酵时间对蛋白水解度和DPPH自由基清除率的影响。
(3)接种量对水解度和DPPH自由基清除率的影响
取适量乳清蛋白浓缩粉,加入去离子水配制成浓度为10%(W/V)的溶液,在63 ℃条件下灭菌30 min,冷却到室温,瑞士乳杆菌CICC 22818接种量分别为1%、2%、3%、4%、5%,在恒温培养箱中37 ℃条件下分别培养24 h,取20 mL加入离心管中,6 000 r/min离心15 min,测定蛋白水解度和DPPH自由基清除能力,研究接种量对蛋白水解度和DPPH自由基清除率的影响。
(4)发酵温度对水解度和DPPH自由基清除率的影响
取适量乳清蛋白浓缩粉,加入去离子水配制成浓度为10%(W/V)的溶液,在63 ℃条件下灭菌30 min,冷却到室温,并分别按照2%比例接种瑞士乳杆菌CICC 22818,在恒温培养箱中在37、40、43、45、50 ℃条件下分别培养24 h,取20 mL加入离心管中,6 000 r/min离心15 min,测定蛋白水解度和DPPH自由基清除率,研究温度对蛋白水解度和DPPH自由基清除率的影响。
2.2.2 乳清浓缩蛋白发酵测定指标
(1)水解度
测定方法见2.1.3。
(2)DPPH自由基清除能力
参考Shimada等[15]的方法进行测定,原理为DPPH在乙醇中呈紫色,于517 nm处有强吸收能力,加入抗氧化剂后会褪色,其颜色变浅程度可反映抗氧化剂的抗氧化能力。将 DPPH用无水乙醇配成浓度为6.5×10-4mol/L的溶液,在冰箱存放,用时稀释为6.5×10-5mol/L溶液。将1.0 mL 5.00 mg/mL蛋白水解液加入到2.0 mL DPPH溶液中,避光保存30 min后在517 nm处测定样品吸光值。吸光值越低其抗氧化性越强。

2.2.3 抗氧化肽制备工艺的优化
选择发酵浓度、发酵时间、接种量、发酵温度为变量,选定四因素三水平,Design-Expert 8.0.6软件进行试验设计,采用响应面分析法分析试验,以DPPH自由基清除能力为指标,对抗氧化肽工艺参数进行优化,并做验证试验。
2.3 乳清蛋白肽抗氧化性的测定
瑞士乳杆菌CICC 22818发酵乳清浓缩蛋白WPC 80,在最佳发酵条件下,即发酵温度为43 ℃,发酵时间为60 h,接种量为3%,乳清蛋白浓度为10%时,以水解液的·OH自由基清除能力、还原力为指标,测定蛋白发酵液的抗氧化能力,并与未优化发酵条件的蛋白水解液对比抗氧化能力,检测抗氧化性提高的情况。
2.3.1 ·OH自由基清除能力的测定
根据贾之慎等[16]方法对·OH自由基清除能力进行测定。先取一定量的样品,用磷酸缓冲溶液进行溶解。取0.75 mmol/L邻二氮菲无水乙醇溶液1 mL于试管中,加入0.15 mol/L磷酸缓冲液(pH值7.4)2 mL和蒸馏水1 mL,混匀后加入1 mL 0.75 mmol/L FeSO4溶液和1 mL双氧水,37℃水浴60 min,测得损伤管吸光值A损。未损伤管以蒸馏水代替损伤管中的双氧水,方法同上,测定未损伤管的吸光值A未。样品管用样品代替损伤管中的蒸馏水,在536 nm处测吸光值。按下列公式计算清除率。
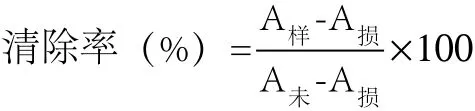
2.3.2 还原力的测定
根据Oyaizu[17]方法对还原力进行测定。取一定质量浓度的乳清蛋白水解产物样品溶液1.00 mL,加入2.00 mol/L磷酸盐缓冲液(pH值6.6)和1%铁氰化钾溶液各2.50 mL,50 ℃水浴20 min,然后加入质量分数为10%的三氯乙酸2.50 mL,3 000 r/min条件下离心10 min。取2.50 mL上清液和 0.50 mL三氯化铁(0.1%,W/V)混合,10 min后在700 nm处测定吸光度A,A越大还原能力越强。
2.4 乳清浓缩蛋白发酵液的纯化及冻干
2.4.1 超滤处理乳清浓缩蛋白发酵液
取乳清浓缩蛋白发酵液,在6 000 r/min条件下离心15 min,除去菌体及部分大分子物质。取上清液超滤去除大分子物质及盐类等杂质,乳清浓缩蛋白发酵液使用10 Ku截留分子量薄膜进行超滤浓缩,超滤温度为40 ℃,压力为0.2 MPa,WPC浓度为10%。
2.4.2 乳清蛋白肽的冷冻干燥
先将多肽降温使其冻结,然后用冷冻干燥机干燥样品。具体操作如下:(1)取发酵得到的水解肽于专用平皿内,在冰箱中冷冻直到成固体为止。(2)将冷冻好的发酵水解肽放入冷冻干燥机内,设置温度维持在-45 ℃,真空度设置为20 Pa。(3)冷冻干燥24 h后取出。
2.5 数据处理
每个试验重复三次,结果表示为平均数±SD。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(p< 0.05)分析使用Tukey HSD程序。采用sigmaplot12.5软件作图。
3 结果与分析
3.1 菌种筛选指标的研究
3.1.1 水解度
如图1所示,以甘氨酸为标准物质建立吸光值y与游离氨基含量x之间的标准曲线,得到回归方程为:y=0.04x+0.0015(R2=0.9992),线性良好,可用于计算乳清蛋白水解度。
3.1.2 乳清蛋白水解度

图1 蛋白质水解度标准曲线

图2 不同菌株的蛋白水解度测定

图3 不同菌株在不同发酵时间的pH值测定

图4 不同发酵时间菌活力的测定

图5 发酵期间CICC 22818的数量变化
不同菌株的蛋白水解度的测定结果如图2。由图可知,不同类型的菌株对乳清蛋白的水解能力有差别,在相同的条件下,菌株CICC 22818对乳清蛋白的水解能力最强,72 h内,蛋白水解度随着时间的延长逐渐增加。蛋白水解度关系到蛋白质分解成小肽段的程度,对后续抗氧化肽的测定会有影响,应优先考虑水解蛋白能力强的菌株,因此选择瑞士乳杆菌CICC 22818。
3.1.3 产酸能力
不同菌株在不同发酵时间的pH值的测定结果如图3所示,由图可知,在发酵一段时间后,各个菌种在发酵过程中,随着培养时间的延长不断产酸,使得发酵液的pH值不断下降,菌株的产酸能力逐渐增加,瑞士乳杆菌(Lactobacillus helveticus)CICC 22815和CICC 22818的pH值很接近,产酸能力较强,pH值降低得最多,最后可达到3.97左右。其它菌株pH值也有相对的降低,但是幅度较小。
3.1.4 发酵过程中的菌活力
不同菌种不同发酵时间菌活力的测定结果如图4所示,可以看出,不同的菌种发酵不同的时间检测菌种的存活情况,菌种在发酵24 h有较强的活力,随着发酵时间的延长,菌种的活力均逐渐下降,其中菌种CICC 22818在发酵乳清浓缩蛋白72 h仍保持8.5 LogCFU/g,显著高于其它菌株。因此本试验选择瑞士乳杆菌CICC 22818作为试验菌株。
3.1.5 瑞士乳杆菌CICC 22818的生长曲线
在乳清蛋白发酵期间内,定期取样,测定其中瑞士乳杆菌CICC 22818的活菌数变化。结果如图5所示,在发酵12 h时,CICC 22818的活菌数达到9.17 LogCFU/g,随后在24 h时略有提高,可以达到9.2 LogCFU/g,之后在24~48 h内活菌数又有所下降,但是下降幅度不明显(P>0.05),48 h后CICC 22818数量一直呈下降趋势,但是84 h时活菌数仍接近8.45 LogCFU/g。
3.2 乳清蛋白抗氧化肽制备工艺的优化
3.2.1 乳清蛋白发酵条件单因素试验
(1)发酵温度对水解度和DPPH自由基清除率的影响
由图6可知,随着发酵温度的升高,蛋白水解度呈现先上升后下降的趋势,瑞士乳杆菌CICC 22818发酵作用需要在一定温度范围内进行,高温或低温都有碍反应进行,45 ℃时水解度达到最大。在最适温度45 ℃时,DPPH自由基清除率也最高。随着温度的升高,菌活力会有所下降,蛋白质裂解的肽键数减少,水解度缓慢下降,小分子肽也随之减少,清除自由基能力受到限制。综合蛋白水解度和DPPH自由基清除率,选取43~50℃为最佳温度范围,并进行后续的优化试验。

图6 发酵温度对水解度和DPPH自由基清除率的影响
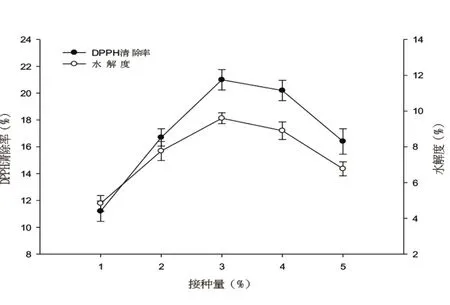
图7 菌株接种量对水解度和DPPH自由基清除率的影响

图8 乳清蛋白含量对水解度和DPPH自由基清除率的影响
在瑞士乳杆菌适应的温度范围内,菌株活力不受影响,乳清蛋白发酵过程中水解能力不受影响,并且随着温度的升高,蛋白水解能力增强,随着蛋白水解程度的增加,乳清蛋白分解成小分子肽的量也逐渐增多,使得具备抗氧化能力的多肽对DPPH自由基的清除能力增强。
(2)接种量对水解度和DPPH自由基清除率的影响
由图7可知,随着瑞士乳杆菌CICC 22818接种量的增加,乳清浓缩蛋白的水解度在发酵期间逐渐增大,原因是随着菌株接种量的增加,菌体本身含有的酶的量也随之累积,水解度也就相应提高。但当菌株接种量大于3%(V/V)时,随着菌株接种量的增加,蛋白水解度逐渐减少。这主要是由于当菌株接种量太低时,菌种活力低,因此蛋白分解能力差;当添加量增加时,活菌数增加,在发酵过程中菌体细胞中的蛋白酶因菌体自溶而被释放出来,因此加快了蛋白质水解,使得蛋白质被更多地分解成多肽,清除DPPH自由基能力的抗氧化肽量也增多。但当菌株接种量过多时,产酸速率也相应加快,较高的酸度环境会抑制菌种蛋白酶的活力,从而使得蛋白质水解度降低,抗氧化肽含量减少,清除自由基能力变小。
(3)乳清蛋白含量对水解度和DPPH自由基清除率的影响
由图8可知,随着乳清蛋白含量的增加,水解度先增加后减少,在8%达到最大。底物浓度刚开始小,而菌的分解能力较强,使得底物供不应求,所以水解度小,分解得到的多肽量也少;当浓度达到一定时,菌在发酵时快速分解,底物与菌产生的酶等比发生反应,水解度变大,自由基清除能力也增强,在蛋白浓度10%(M/V)左右时达到最大;当底物浓度过高时,反应物小于底物浓度,菌株不能使蛋白完全分解,水解度下降。
(4)发酵时间对水解度和DPPH自由基清除率的影响
由图9可知,随着发酵时间的增加,蛋白水解度先逐渐增大后减小,这主要是由于在一定发酵时间范围内,菌株的活性增强,蛋白质水解能力较强,而当发酵时间继续增加,菌株产酸越多,较低的pH值环境降低了菌株的酶活性,导致蛋白水解量降低[18]。而在此过程中,随着蛋白水解能力的增强,自由基的清除率也逐渐增加,但随着时间的增加而越来越缓慢,这可能是由于蛋白水解到一定程度后,蛋白质分解成小分子肽的速度变慢,使具有抗氧化能力的肽量也增加较慢。
3.2.2 BOX-Behnken优化发酵工艺参数
本试验选择接种量(A)、发酵时间(B)、温度(C)、乳清蛋白含量(D)四个因子为自变量,以DPPH自由基清除率为响应值,在单因素试验的基础上进行四因素三水平的响应面设计,建立BOX-Behnken模型,见表2。BOX-Behnken试验设计及试验结果见表3,响应值R表示DPPH自由基清除率。

图9 发酵时间对水解度和DPPH自由基清除率的影响
可以得出该试验的拟合方程为:

此方程式中,R为DPPH自由基清除率预测值,A、B、C和D分别为接种量、发酵时间、温度和乳清蛋白含量的编码值。对得到的四元二次回归方程进行方差分析和系数显著性检验,结果见表4。
该模型中p<0.001,表明本研究所得的回归模型方程极显著,相关系数R2=93.40%,说明该回归方程的回归效果较好,预测值与真实值之间具有高度相关性,DPPH自由基清除率的实测值与预测值两者之间拥有较好的拟合度。变异系数(CV)用于反映模型的置信度,CV值和置信度呈反比的关系,其值越低表示模型的置信度越高,本试验模型中CV值为6.17%,说明此设计的模型可以较真实地预测试验结果;失拟项P=0.7224>0.05,表明不显著,可以用该响应面设计有效表示各因素之间的关系。模型的校正决定系数=86.79%,表明DPPH自由基清除率可以由该响应面设计来解释。综上所述,该回归方程的拟合度和可信度均较好,此方法可靠,可用于 DPPH自由基清除率的预测。
响应面的优化作用可以反映温度、发酵时间、接种量和乳清蛋白含量对DPPH自由基清除率的影响,除此之外还能显示两个变量之间是否具有交互影响。由上表显示,模型方程的一次项x3的P值小于0.0001,说明接种量对DPPH自由基清除率的影响极显著,x1、x2的P值0.0091、0.0010均小于0.05,说明发酵时间和温度对DPPH自由基清除率有显著影响,x4的P值为0.0811>0.05,差异不显著。各因素对DPPH自由基清除率影响作用大小按次序依次是C>B>A>D,即温度>发酵时间>接种量>乳清非常显著,说明DPPH自由基清除率和各变量之间并不是线性关系那么简单,回归方程模型项P值小于0.001,所以该模型非常显著。各因素间两两互作对DPPH自由基清除率的影响响应面图如图10所示。
如图10所示,由相应响应面设计图可以直观地看出四种因素中每两种因素交互作用对DPPH自由基清除率的影响不显著。对比所有响应面图可知,图10(4)交互的等高线最密,响应面最陡,同时二者交互影响的F值大于其它因素两两交互影响的F值,且P值最小,因此二者交互作用对DPPH自由基清除率的影响最大。除此之外,发酵时间和乳清蛋白质量分数的交互作用最小;如图10(5)所示,曲面较平缓,同时方差分析得到二者交互作用的F值最小,说明二者交互作用对自由基清除率的影响最小。因此各因素间交互作用可以忽略不计。上图呈现情况与方差的分析结果一致。

表2 乳清蛋白发酵BOX-Behnken因素水平设计

表3 DPPH自由基清除率的BOX-Behnken 试验设计及结果

表4 试验设计方差分析

图10 各因素交互作用的响应曲面图
3.3 最佳抗氧化肽制备工艺验证试验
用模型的回归方程求导数方程,并计算此导数方程的解,算出模型的最高点即最佳值,经响应面分析得出DPPH自由基清除率的四个因素的最佳水平值是发酵时间63 h、接种量3.4%、发酵温度43.3 ℃、乳清蛋白浓度9.86%,响应面最值的DPPH自由基清除率为26.4 %。为验证模型预测的可靠性,将响应面设计优化后的结果与实际值比较,按照上述优化后参数进行验证试验,得到DPPH自由基清除率的实际值,将最佳条件修改为接种量3.5%、发酵时间63 h、发酵温度43.3 ℃、乳清蛋白含量10%。验证试验最终显示,DPPH清除率实际值为(27.52±0.26)%,实际值与预测值相差较小,证明该模型重现性好,进一步验证了模型的可靠性。
为了得到较高的DPPH自由基清除率,本试验对主要影响因素进行单因素试验,在单因素的基础上选取各因素的试验水平,通过响应面设计得到DPPH自由基清除率的最优参数为接种量3.5%、发酵时间63 h、发酵温度43.3 ℃、乳清蛋白含量10%。
3.4 乳清蛋白肽抗氧化性的测定
自由基清除能力和铁离子还原能力可以显示瑞士乳杆菌发酵乳清蛋白得到的抗氧化钛的抗氧化活性。发酵乳清蛋白制备的抗氧化肽纯化并干燥后,对DPPH和·OH自由基的清除能力及还原能力分别为35.62%,20.58%,A=0.384。Liu等[19]以kefir发酵豆奶,发现发酵可显著增强豆奶的抗氧化活性,他们认为在发酵过程中蛋白质降解为小分子的肽,从而增强了豆奶的抗氧化活性。Virtanen等[20]以多种乳酸菌发酵制备酸奶,结果表明发酵产品的抗氧化能力与其中蛋白质的水解度成正比。此外,在发酵过程中产生的氨基酸、乳酸及抗氧化性维生素都可增加蛋白质的抗氧化活性。
4 结论
研究发现,相同发酵时间下,瑞士乳杆菌CICC 22818的菌株活力及蛋白水解能力较强,分别达到8.5 LogCFU/g、9.36%,为最适菌株。通过响应面优化试验得出:在发酵乳清蛋白时,当温度为43.3 ℃、发酵时间为63 h、接种量为3.5%、乳清蛋白含量为10%时,DPPH自由基清除能力最大达到26.4%,经验证试验得出实际值为(27.52±0.26)%。综上所述,瑞士乳杆菌发酵CICC 22818乳清蛋白制备乳清蛋白肽的最佳工艺为:接种量3.5%、发酵时间63 h、发酵温度43.3 ℃、乳清蛋白含量10%。经纯化后的抗氧化肽的DPPH自由基清除率显著提高,可达到35.62%,另外·OH自由基清除率为20.58%,同时也具有一定还原能力。
[1] Collins A R. Antioxidant intervention as a route to cancer prevention[J]. European Journal of Cancer,2005,41(13):1923-1930.
[2]Hiller B,Lorenzen P C. Functional properties of milk proteins as affected by enzymatic oligomerisation[J]. Food Research International,2009,42(8):899-908.
[3] Halliwell B. Free radicals,antioxidants,and human disease:curiosity,cause,or consequence?[J]. The lancet,1994,344(8924):721-724.
[4] Harman D. Aging:a theory based on free radical and radiation chemistry[J]. Journal of Gerontology,1956,11(3):298-300.
[5] Ito N,Hirose M,Fukushima S,et al.Studies on antioxidants:their carcinogenic and modifying effects on chemical carcinogenesis[J]. Food and Chemical Toxicology,1986,24(10):1071-1082.
[6] Pan Y,Liang Y,Wang H,et al.Antioxidant activities of several Chinese medicine herbs[J]. Food Chemistry,2004,88(3):347-350.
[7] 中华人民共和国卫生部. GB 2760-1996食品添加剂使用卫生标准[S]. 北京:中国标准出版社,1996.
[8] Silva S V,Malcata F X. Caseins as source of bioactive peptides[J]. International Dairy Journal, 2005,15(1):1-15.
[9] Kitts D D,Weiler K. Bioactive proteins and peptides from food sources. Applications of bioprocesses used in isolation and recovery[J]. Current pharmaceutical design,2003,9(16): 1309-1323.
[10] Meisel H,Fitzgerald R J. Biofunctional peptides from milk proteins:mineral binding and cytomodulatory effects[J].Current pharmaceutical design,2003,9(16):1289-1296.
[11] 于长青,赵学明,姚琨,等. 高产蛋白酶芽孢杆菌的选育及其在大豆活性肽制备中的应用[J]. 中国农业大学学报,2005,10(1):34-37.
[12] Collins A R. Antioxidant intervention as a route to cancer prevention[J]. European Journal of Cancer,2005,41(13):1923-1930.
[13] Halliwell B. Role of free radicals in the neurodegenerative diseases[J]. Drugs &aging,2001,18(9):685-716.
[14] 赵新淮,冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学,1994(11):65-67.
[15] Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J]. Journal of agricultural and food chemistry,1992,40(6):945-948.
[16] 贾之慎,乌卜建敏,唐孟成. 比色法测定反应生成的自由基[J]. 生物化学与生物物理进展,1996(23):184-186.
[17] Oyaizu M. Antioxidative activities of browning reaction prepared from glucose amine [J]. Japan Journal of Nutrition,1986(44):307-315.
[18] 梁美艳. 瑞士乳杆菌发酵乳制备ACE抑制肽条件的优化[J]. 食品科学,2009(30):155-160.
[19] Liu J R,Chen M J,Lin C W.Antimutagenic and antioxidant properties of milk-kefir and soymilk-kefir[J]. Journal of agricultural and food chemistry,2005,53(7):2467-2474.
[20] Virtanen T,Pihlanto A,Akkanen S,et al. Development of antioxidant activity in milk whey during fermentation with lactic acid bacteria[J]. Journal of Applied Microbiology,2007,102(1):106-115.
