海洋红酵母的酶法破壁及在发酵鸡饲料中的应用
2018-05-14李靖靖
岳 春,姚 虹,李靖靖,初 峰
(1.南阳理工学院 生物与化学工程学院,河南 南阳 473004;2.郑州工程技术学院 化工食品学院,郑州 450044)
海洋红酵母是自然海域中存在的一种酵母菌,其细胞中富含蛋白质、肝糖、不饱和脂肪酸、动物幼体生长激素及以虾青素为主的类胡萝卜素等多种营养物质。随着水产养殖业的蓬勃发展,海洋红酵母已经被广泛选用为海参、虾、蟹、贝的幼体浮游期的鲜活饵料。[1]研究表明,海洋红酵母能显著提高幼苗的存活率、饲养效果和饲料报酬率,并能增强动物体的免疫功能,减少抗生素用量,是生态养殖的优良添加剂。[2]目前国内的饲料主要以传统的蛋白饲料为主,还停留在较低水平。近年来国内有厂家开始工业化试生产红酵母饲料,国外已用于饲料添加剂中,[3-4]但类胡萝素是红酵母细胞内产物,破壁效果及提取方法直接影响红酵母发酵生产类胡萝素的产量、质量和生产成本。[5]因此,研究红酵母破壁方法具有重要意义。
海洋红酵母的破壁方法有很多,目前研究较多的是化学法,但化学法破壁条件苛刻,并有可能改变虾青素的理化性质。酶法破壁近年才开始研究,条件温和,能很好的避免虾青素等多种营养物质被破坏,并有利于提取。温和的化学渗透剂可以改变酵母细胞壁或膜的通透性,从而使内含物有选择地渗透出来并保持活性不变。[6]
1 材料与方法
1.1 原料与试剂
海洋红酵母菌种:南阳理工学院实验室保存;发酵鸡饲料:实验室自制;β-甘露聚糖酶:湖北佳诺信生物化工有限公司,酶活力为50000U/g;蛋白胨:博欧特(天津)化工贸易有限公司;酵母膏:河南三顺教学仪器有限公司; 葡萄糖:北京鹏彩精细化工有限公司;硫酸镁、氯化钠、硫酸铜、硫酸钾:上海埃彼化学试剂有限公司;磷酸氢二钾、二甲基亚砜:德州市富凯化工有限责任公司;丙酮:南京化学试剂有限公司;浓硫酸、硼酸:天津赛孚瑞科技有限公司。
1.2 仪器与设备
BPX-82型电热恒温培养箱:上海科晓科学仪器有限公司;DK-98-1型恒温水浴锅:天津市泰斯特仪器有限公司;101-2A型电热鼓风干燥箱:天津市泰斯特仪器有限公司;PHS-3B 型精密pH计:上海雷诺仪器厂;BS 100 S型电子天平:北京赛多利斯天平有限公司;YX-280A型高压灭菌锅:南京市科立华仪器仪表有限公司;TGL-20B型台式离心机:上海沉黄科学仪器有限公司;HZQ-X100A型恒温培养震荡箱:南京晓晓仪器设备有限公司;WF2-2000型721分光光度计:上海龙尼柯仪器有限公司。
1.3 试验方法
1.3.1 培养基的制备
(1)斜面活化培养基:葡萄糖25.0g/L,蛋白陈8.0g/L,酵母粉5.0g/L,琼脂20.0g/L,pH 5.0。
(2)液体种子培养基:葡萄糖25.0g/L,蛋白陈8.0g/L,酵母粉5.0g/L,磷酸二氢钾 5.6g/L,氯化钠 10.0g/L,硫酸镁3.0g/L,pH 4.8~5.0。
(3)发酵培养基:葡萄糖25.0g/L,蛋白陈8.0g/L,酵母粉5.0g/L,磷酸二氢钾5.6g/L,氯化钠10.0g/L,硫酸镁3.0g/L,pH 4.8~5.0。
pH由缓冲剂来调节,各种培养基经过121℃,30min灭菌后冷却至常温备用。
1.3.2 菌株的培养[7]
(1)菌株活化
将保藏于冰箱中的菌种接种在上述斜面培养基上,于30℃活化48h。
(2)种子培养
从斜面接2环到装量为50mL/250 mL三角瓶中,于28℃,300r/min离心培养24h。
(3)发酵培养
以10%接种量接入与种子培养基相同的培养基中,装量50mL/250 mL,于30 ℃,300 r/min培养72h。
1.3.3 加酶破壁
称取一定量β-甘露聚糖酶,将其溶于无菌水中配成溶液,将酶溶液加入发酵培养一定时间后的摇瓶中,然后在300r/min转速下旋转振荡一定时间。[8]
1.3.4 分析测定方法
(1)蛋白质含量的测定:凯氏定氮法(测定饲料中蛋白质的含量)。
(2)类胡萝卜素总量的测定:二甲基亚砜(DMSO)法[9]。
(3)破壁率的测定[10]:取4mL发酵液,离心后用去离子水洗涤离心3次,加10mL丙酮直接提取,4000r/min转速下离心10 min,上清液在480nm处以丙酮为空白测定吸光度Aa。酵母破壁率计算式为:酵母破壁率=Aa/A×100%。
1.3.5 单因素试验设计
考虑不同的加酶量、酶解时间、酶解温度、pH对细胞破壁率的影响。
1.3.6 正交试验设计
以破壁率为考察指标,采用L9(34)正交表进行三因素三水平正交试验,根据单因素试验的结果选择酶解时间、酶解温度、加酶量三个因素进行正交试验,筛选出最佳的因素水平。正交试验因素水平见表1。

表1 正交试验因素水平表
1.4 应用[11-12]
(1)发酵饲料的准备:通过计算,称取一定量的发酵饲料。
(2)添加破壁酵母:按照最优条件对海洋红酵母进行破壁,将破壁后的酵母按照一定比例添加于发酵饲料中,制成高蛋白、含类胡萝卜素的饲料,并测定其中蛋白质和类胡萝卜素的含量。
2 结果与分析
2.1 单因素试验结果及分析
2.1.1 加酶量对甘露聚糖酶酶解效果的影响
分别称取0.01g,0.02g,0.03g,0.05g,0.07g的酶,依次装入试管中加入等量的无菌水配制成溶液,然后分别加入到发酵培养72h的发酵液中,放入摇床中在50℃,300r/min条件下酶解5h,之后取出将三角瓶放置在沸水浴中灭酶活,测吸光度,计算破壁率。加酶量对海洋红酵母破壁率的影响如图1所示。

图1 加酶量对破壁效果的影响
由图1可以看出,随着加酶量的增多,吸光度和破壁率也随之提高,当加酶量大于0.05g之后,吸光度和破壁率增加的趋势变小。可能是因为底物浓度一定,酶解程度近乎达到完全,环境的改变也可能在一定程度上影响酶的作用,所以当酶量达到一定值后吸光度和破壁率不再随之增加。故最佳酶量选择0.05g为宜。
2.1.2 酶解时间对甘露聚糖酶酶解效果的影响
将海洋红酵母发酵培养72h后,分别加入β-甘露聚糖酶0.05g,于300r/min,50℃条件下振荡酶解2h,4h,5h,6h,8h后在沸水浴中进行灭酶活,测定发酵液的吸光度,计算破壁率,结果见表2和图2。

表2 不同酶解时间下的测定结果
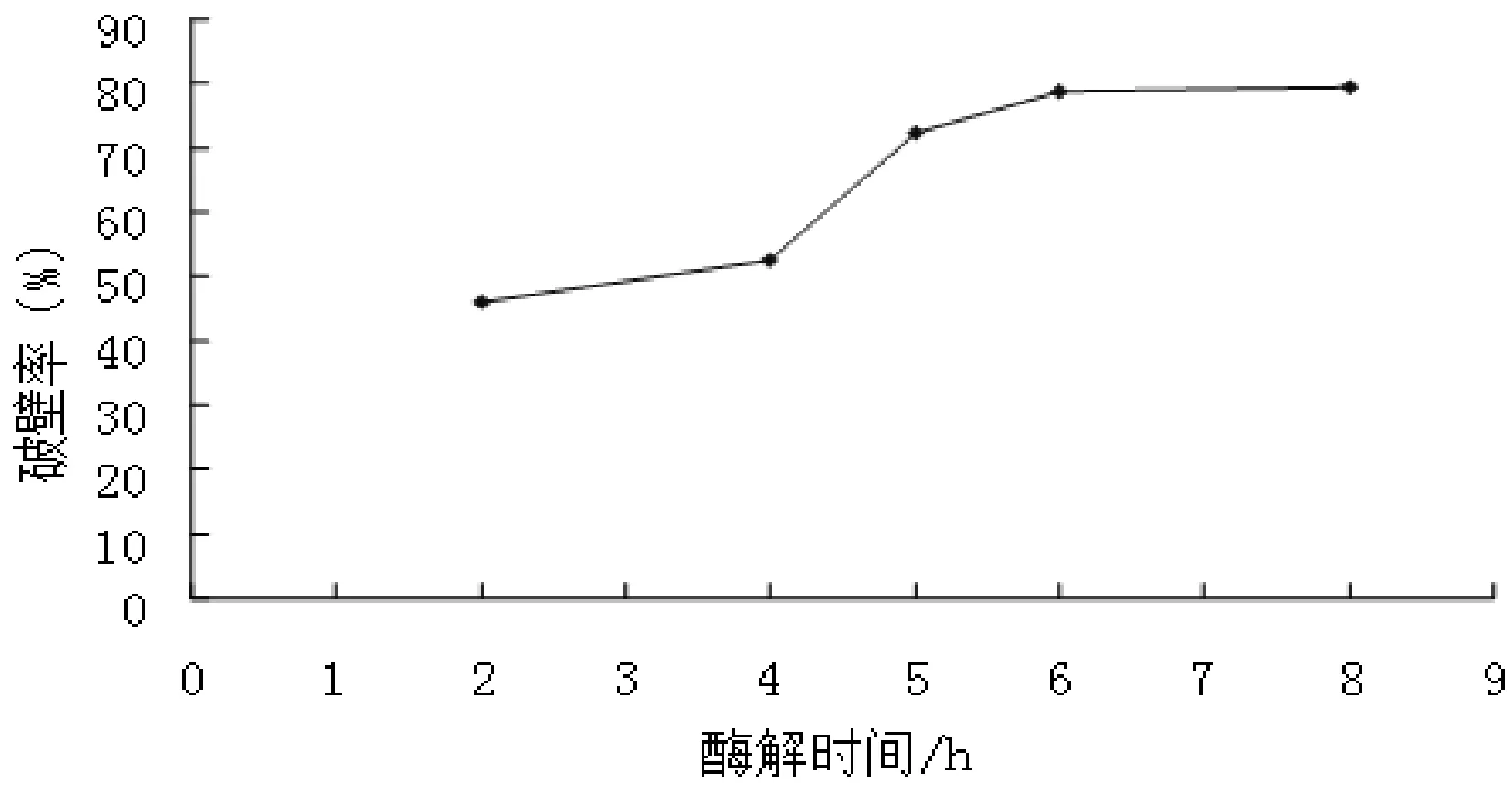
图2 酶解时间对破壁效果的影响
由图2可以看出,在β-甘露聚糖酶水解海洋红酵母发酵液的过程中,随着β-甘露聚糖酶水解时间的增加,吸光度和破壁率也随之增加,当水解6h后含量继续增加,但随着时间的延长,增加趋势变小,可能是因为酶的水解作用已达完全。因此,选择6h左右为最佳酶解时间。
2.1.3 酶解温度对甘露聚糖酶酶解效果的影响
将海洋红酵母发酵培养72h后,加入β-甘露聚糖酶0.05g,分别于30℃,40℃,45℃,50℃,55℃和60℃水解6h,迅速取出放在沸水浴中灭酶活,经过离心,提取,测定上清液的吸光度,计算破壁率,结果见表3和图3。

表3 不同酶解温度下的测定结果

图3 酶解温度对破壁效果的影响
由图3可以看出,50℃时海洋红酵母的破壁率最高,可能是因为当温度逐渐升高到50℃时,温度逐渐接近酶的最适温度,所以甘露聚糖酶的破壁率逐渐升高,但随着温度升高,由于酶慢慢失去活性,酶解效果减弱,故破壁率呈下降趋势。因此,酶解温度选择50℃左右较适宜。
2.1.4 pH对破壁效果的影响
按照0.05g加酶量在50℃酶解温度下,分别调整发酵液的pH,震荡酶解6h。测定结果和酶解曲线分别见表4和图4。

表4 不同pH下的测定结果
由图4曲线可知,pH4~5时,破壁率随pH的上升而增加,pH大于5时,细胞破壁率随pH上升而下降,应该是因为pH接近5时逐渐接近甘露聚糖酶的最适pH,此时酶活力比较高,而当pH继续增大,环境的改变使酶不再适应,酶活力也降低,所以破壁率随pH增大而下降。因此,酶解pH取5左右为佳。
2.2 甘露聚糖酶酶解海洋红酵母条件的优化结果与分析
根据1.3.6的方法在单因素试验的基础上进行正交试验设计[12]。
2.2.1 正交试验结果与极差分析
采用L9(34)表设计试验,试验结果及极差分析见表5和图5。

图5 因素与指标趋势图
由表5可以看出,对于A因素而言,k1>k2>k3,由于破壁率是越大越好,所A1为A因素的最优水平;对于B因素而言,k2>k1>k3,所以B2为B因素的最优水平;对于C因素而言,k2>k3>k1,即C2为C因素的最优水平。故本试验的最优水平组合为A1B2C2,即甘露聚糖酶酶解海洋红酵母的最佳条件为加酶量0.05g,酶解温度50℃,酶解时间6h。

表5 正交试验结果
由极差分析以及因素与指标趋势图可以得出,RC>RB>RA,各因素对破壁率影响的主次顺序为C>B>A,即加酶量的影响最大,其次是酶解温度和酶解时间。
2.2.2 正交试验设计方差分析
通过计算进行显著性检验,列出方差分析表,结果由SPSS软件得出,结果见表6。

表6 方差分析表
由表6可见,因素C最显著,A和B均不显著,各因素对试验结果的影响主次顺序为C>B>A。
2.2.3 正交试验小结
通过对正交试验结果的极差分析和方差分析,可见试验结果一致。加酶量为主要的影响因素,不同的加酶量对海洋红酵母细胞壁的破壁率影响最大,最合适的加酶量为0.05g;酶解温度的变化对红酵母破壁率的影响次之,以50℃为最好;酶解时间的变化对海洋红酵母破壁率的影响最小,以6h为最佳。通过正交试验的优化组合,得到海洋红酵母菌细胞酶法破壁的最优条件:50mL海洋红酵母培养液发酵培养72h,加酶量为0.05g,酶解温度为50℃,酶解时间为5h,pH为5,摇床300r/min。在此优化的培养条件下,海洋红酵母的破壁率可达81.25%。
2.3 最优条件在发酵饲料中的应用
根据以上正交试验所得最佳海洋红酵母破壁条件,将制备的50mL破壁海洋红酵母培养液直接加入到50g饲料中混匀,然后将其烘干,测定蛋白质含量与类胡萝卜素含量,结果见表7。
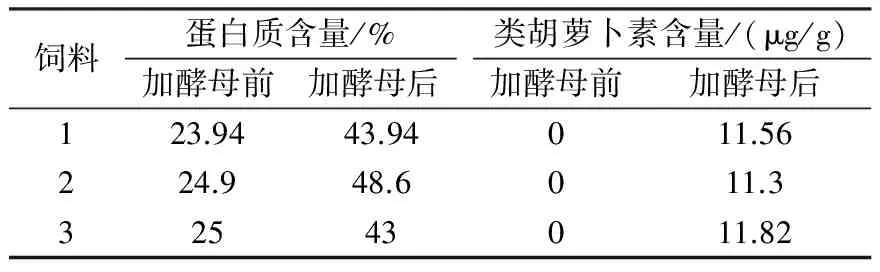
表7 测定结果
由表7可知,添加酵母后可明显增加蛋白质含量,在一定程度上也增加了类胡萝卜素的含量,试验条件可行。
2.4 应用分析与讨论
由以上试验结果可知,在试验条件下,的确能增加蛋白质和类胡萝卜素含量,但是在实际应用时还应进一步验证,主要有以下几个问题:
(1)本试验目的是提高红酵母在饲料中的利用率,即破坏酵母细胞壁,使细胞内类胡萝卜素释放,最终增加畜禽产品的感官色泽与营养价值。关于本试验的结论最终应用结果如何,添加多少能达到最好效果,还要在饲喂之后才能最终定论。
(2)试验与实际应用的量之间还有很大的差别。试验是短时的,实际应用中更要考虑饲料的成本问题,以及饲料本身的保藏问题。
(3)最终符合要求的饲料中的添加量,还需要在实际应用中探究。
(4)本试验采用的是甘露聚糖酶酶解的方法,但是酵母细胞壁中含有少量蛋白,试验中并未用到蛋白酶。考虑原因:其一,饲料本身原料中有豆粕,大豆蛋白比较多,蛋白酶的加入会使其水解,容易出现苦味,从而影响饲料本身的风味。虽然有一定的方法掩盖苦味,但方法比较复杂,另外还需要进一步考虑成本问题。其二,加入蛋白酶虽然在一定程度上能提高氨基酸的含量,并且能提高消化率,但是氨基酸产品不容易保藏。
3 结论
本试验以实验室保藏海洋红酵母为菌种,采用酶法对海洋红酵母进行细胞破壁,通过对影响破壁条件的几个因素(加酶量、酶解时间、酶解温度、pH)的单因素研究,采用正交试验得出较佳的酶解条件组合,并将其添加到发酵鸡饲料中,通过分析测定蛋白质的含量,来确定破壁海洋红酵母在饲料中的应用效果。具体结论如下:
(1)通过正交试验得出最佳酶解条件:海洋红酵母发酵培养72h,加酶量为0.05g,酶解温度为50℃,酶解时间为6h,摇床300r/min。在此条件下,海洋红酵母的破壁率可达81.25%。
(2)按照以上条件所制得的破壁酵母,将其加入到发酵饲料中,加入之前饲料蛋白含量为25%左右,加入之后蛋白含量为45%左右,比之前蛋白含量提高了20%。
(3)本方法不仅增加了饲料蛋白质含量,提高了饲料的营养价值,同时也增加了类胡萝卜素的含量,测得类胡萝卜素的含量为11.56μg/g。
参考文献:
[1]刘秀莲,王宇光.海洋红酵母的研究进展[J].生物技术通讯,2008(2):293-295.
[2]李红,张坤生.红酵母发酵生产β-胡萝卜素[J].食品研究与开发,2004,25(3):58-60.
[3]王岁楼.红酵母类胡萝卜素高产菌株的筛选及其发酵生理学条件研究[J].工业微生物,2001,3l(1):19-22.
[4]殷禄阁,熊坂清弘.“海洋酵母”和EPA·DHA强化饲料[J].国外畜牧学(饲料),1995(4):17-19.
[5]王岁楼,张鑫,张平之.红酵母类胡萝卜素提取方法研究[J].食品与机械,2000(6):30-31.
[6]贾艳萍,魏群,赵军.对酵母细胞酶法破壁的研究[J].中国酿造,2005(9):11-13.
[7]童应凯,韦东胜,刘婷,等.海洋红酵母培养条件的研究[J].食品研究与开发,2006(8):75-79.
[8]马相杰,汪立平,冷向军,等.β-甘露聚糖酶水解酵母细胞壁水解条件的研究[J].食品科技,2009(2):7-10.
[9]周鲜娇,吴雪梅.二甲基亚砜法提取海洋红酵母β-胡萝卜素的最佳工艺[J].贵州农业科学,2011,39(7):184-187.
[10]李兴鸣,徐学明.法夫酵母的酶法破壁研究[J].粮食与饲料工业,2006(6),38-39.
[11]徐红芯.β-甘露聚糖酶之国内外最新研究概况[J].湖南饲料,2008(2):30-32.
[12]周响艳,谭会泽,冯定远,等.β-甘露聚糖酶在饲料中的应用研究[J].养殖与饲料,2006(4):21-24.
