湿热环境对CCl4诱导大鼠肝炎模型的影响及代谢组学研究*
2018-05-10蔡志钢张永煜
王 洋,蔡志钢,张永煜
(1.上海中医药大学中医方证与系统生物学研究中心 上海 201203;2.上海中医药大学附属曙光医院 上海 201203;3.麦特绘谱生物科技(上海)有限公司 上海 201203)
湿热既是常见的致病因素,又是疾病过程中容易出现的特殊病理状态,常使疾病缠绵难愈。湿热证在一些疾病中分布突出,如肝炎[1]、关节炎[2]、原发性肾小球疾病[3]。随着中医症候研究的深入,症候动物模型的复制成为中医症候研究的瓶颈之一。湿热证的规范化、标准化、客观化的动物模型研究将为湿热证的证物质内涵研究奠定了良好的基础[4]。目前为止,湿热证动物模型建立大都遵循模拟传统病因“外湿引动内湿”的基本要求,一般采用“饮食+环境+致病因子”复合因素造模[5,6]。有研究对湿热环境下正常饮食和高脂饮食的湿热动物模型进行了比较,发现饮食对动物模型的影响无显著差异性[7],本课题组在前期研究中采用“高糖高脂饮食+湿热环境+酒精”复合因素进行了模型筛选,根据临床以及湿热证动物模型筛选研究结果提示湿热环境对湿热模型的影响可能更突出。因此,本研究考察湿热环境对四氯化碳致大鼠慢性肝炎疾病的影响作用。通过一般体征指标、生化指标、病理切片、代谢组学四个方面探讨湿热环境对疾病的影响作用,并分析湿热环境对疾病影响的物质基础及机制。
1 材料
1.1 动物
Wistar雄性大鼠24只,120-140 g,饲养于上海中医药大学动物实验中心(清洁级)。室内温度20-25℃,相对湿度为55-65%。购买于上海斯莱克实验动物有限责任公司,动物合格证编号:2015000524543。
1.2 试剂
N-O-双(三甲硅基)三氟乙酰胺(BSTFA,含1%TMCS,美国Sigma-Aldrich公司,批号:33148),甲氧胺盐酸盐(美国Sigma-Aldrich公司,批号:226904),十七酸(美国Sigma-Aldrich公司,批号:H3500),甲醇(国药集团化学试剂有限公司,批号:80080418),四氯化碳(批号:10006480),水合氯醛(批号:30037517),氯仿(国药集团化学试剂有限公司)。
1.3 仪器
气相色谱-质谱联用仪(GC/MS,Agilent6890/5975B,Agilent科技有限公司),气相毛细管色谱柱(DB-5 MS,Agilent科技有限公司),微型漩涡混合器(Vortex-Genie 2,美国 Scientific Industries,Inc),样品浓缩仪(SBH 130D/3,英国Stuart公司),高速冷冻离心机(Centrifuge 5415R,德国Eppendorf公司),Milli-Q超纯水系统(Milli-Q Gradient,Millipore中国有限公司),数控超声仪(KQ-250DB型,昆山市超声仪器有限公司),低温冷冻冰箱(U9260-020,英国),人工气候箱(上海三腾仪器有限公司)。
2 方法
2.1 动物分组及造模
Wistar大鼠适应性饲养一周左右,体重达200 g左右后,进行随机分组。动物分组:正常组、模型组一(单纯CCl4,6周)、模型组二(CCl4+湿热环境,6周)。模型组一和模型组二第一次以CCl4纯溶液5ml/kg进行灌胃,随后每周两次以50%CCl4橄榄油溶液1ml·kg-1进行腹腔注射。模型组二第三周开始,每天放入人工气候箱(温度为32℃,湿度为90%)6小时,其他时间在室温下饲养。所有组于第六周全部处死。
2.2 动物取材
将大鼠禁食不禁水12小时,收集动物各类生物样本。
血清:10%水合氯醛将大鼠麻醉,剂量为0.3ml·100g-1。完全麻醉后,腹主动脉取血。血液静置3 h后,于4℃离心机4000 rpm离心10 min,取150 μl血清于1.5 ml离心管中,随后放于冷冻盒中,-80℃冰箱中保存。血清取两份,一份用于生化指标检测,一份供代谢组学检测用。
肝脏:取血结束后,进行肝脏分离,并称量肝重,然后取肝脏最大叶中间部分组织固定于10%中性福尔马林溶液中,进行HE染色和Masson染色;其余部分放入冻存管,投入液氮中,之后转移至-80℃冰箱,供代谢组学检测用。
2.3 一般体征检测
每周对大鼠体重、饮食量、饮水量等进行两次检测,对毛色、粪便等进行观察。
2.4 生化指标检测
取150 μl大鼠血清,采用生化自动分析仪对血清进行TP、ALB、GLO、TBIL、ALP、GGT、TBA,采用南京建成生物工程研究所试剂盒按照说明书操作步骤对血清AST、ALT、SOD、MDA 及肝脏 Hyp进行检测。
2.5 代谢组学检测
2.5.1 血清衍生化处理方法及GC/MS检测条件[8]
取100 μl大鼠血清于1.5 ml离心管中,加入内标十七酸甲醇溶液(1mg·ml-1)10 μl(沿内壁加入,不接触血清)。加入300 μl甲醇、氯仿混合提取液(两者体积比为3:1),涡旋振荡30 s,放入-20℃冰箱中10 min进行蛋白沉淀。随后进行10000 rpm离心10 min,吸取上清液300 μl于GC/MS进样瓶,30℃下用氮气进行吹干。加入甲氧胺吡啶溶液(15 mg·ml-1)80 μl,封盖。涡旋振荡30 s,在30℃的摇床中以250 rpm的频率振荡反应90 min,进行羰基反应。反应结束后,加入80 μl BSTFA(含1%TMCS),封盖振荡30 s,放入70℃烘箱中进行反应,60 min后取出后振荡10 s。待GC/MS进样。
质谱参数:离子源温度230℃,四级杆温度150℃,AUX温度260℃,高纯氦气流速1.0 ml·min-1,前进样口温度270℃,离子源电压为70 ev,溶剂延迟5 min。质谱全扫描荷质比扫描范围(m/z)为30-600。升温程序如下:80℃保持2 min,随后以10℃·min-1速度升高到120℃保持4 min,以10℃·min-1速度升高到180℃,随后以5℃·min-1速度升高到195℃保持3 min,以5℃·min-1速度升高到240℃保持3 min,以30℃·min-1速度升高到300℃保持7 min。最后以300℃再保持2 min。
2.5.2 肝脏衍生化处理方法及GC/MS检测条件[9]
将冷冻的肝组织在冰浴中称取50 mg于1.5 ml离心管中,加入3倍量的生理盐水,用均浆机研磨成浆。加入提取剂甲醇500 μl,涡旋1 min,放入-20℃冰箱放置10 min。取上清 200 μl于GC/MS进样瓶中,30℃下氮气吹干。加80μl甲氧胺吡啶溶液(15mg·ml-1),封盖。涡旋30 s。30℃摇床反应90 min。加入80 μlBSTFA(含1%TMCS),封盖振荡30 s。70℃烘箱中反应60 min,取出振10 s,待GC/MS进样。
质谱参数:离子源温度230℃,四级杆温度150℃,AUX温度260℃,高纯氦气流速1.0 mL·min-1,前进样口温度270℃,离子源电压为70 ev,溶剂延迟5 min。质谱全扫描荷质比扫描范围(m/z)为30-600。气相色谱升温程序如下:80℃保持2 min,随后以10℃/min速度升高到120℃保持4 min,以10℃·min-1速度升高到180℃,随后以5℃·min-1速度升高到195℃保持3 min,以5℃·min-1速度升高到240℃保持3min,最后以12.5℃·min-1速度升高到290℃保持15 min。最后升高到300℃保持2 min。
2.6 数据处理
生化指标等统计采用mean±SD,T-test法进行统计分析。用GC/MS工作站及R软件对代谢组学数据进行处理,采用多维统计及单维统计分析相结合的方法对差异代谢物进行分析与鉴定,最终将同时满足VIP>1.0、单维统计p<0.05的代谢物鉴定为最终差异代谢物,并通过 KEGG(http://www.genome.jp/kegg/)数据库联合HMDB(http://www.hmdb.ca/metabolites/)检索各种差异代谢物及其KEGG化合物号,通过KEGG Mapper(http://www.genome.jp/kegg/mapper.html)和 MBRole(Metabolites Biological Role,http://csbg.cnb.csic.es/mbrole/index.jsp)数据库进行代谢通路分析,选择p<0.05的代谢通路进行深入分析。
3 实验结果
3.1 一般体征变化
大鼠造模开始,每周称两次体重,饮食量,饮水量,此处将按每周一个时间点呈现体重变化趋势,见表1及图1。由图表看出,造模开始,纯四氯化碳灌胃急剧减轻大鼠体重,随后模型组一和模型组二的大鼠体重增长明显比正常组缓慢。模型组二比模型组一的大鼠体重增长更加缓慢。说明湿热环境对大鼠体重增长具有抑制作用。根据不同组别的饮食量和饮水量的比较,发现饮水量在各组之间变化趋势不明显。而饮食量中,正常组每日饲料摄入量最多,其次是模型组一,最少组为模型组二,说明湿热环境可以抑制大鼠饲料摄入量。随着湿热环境下造模时间增长,模型组二出现毛色发黄、大便稀溏、倦怠等症状。
3.2 生化指标
取150 μl大鼠血清,采用自动生化仪对TP、ALB、GLO、TBIL、ALP、GGT、TBA进行检测。血清中ALT、AST、MDA、SOD以及肝脏Hyp指标则采用试剂盒进行检测。如表2。由结果可以看出ALT、AST、GLO、TBA、TBIL、Hyp共6个生化指标在模型组与正常组中均存在统计学差异,且模型组二比模型组一变化差异更大。TP、SOD、GGT三个生化指标在模型组一与正常组之间无统计学差异,但是在模型组二中存在统计学差异。因此,通过生化指标结果提示湿热环境可以加重疾病的严重程度,图2。

表1 不同时间点三组大鼠体重表

图1 不同组别大鼠体重随时间变化趋势图
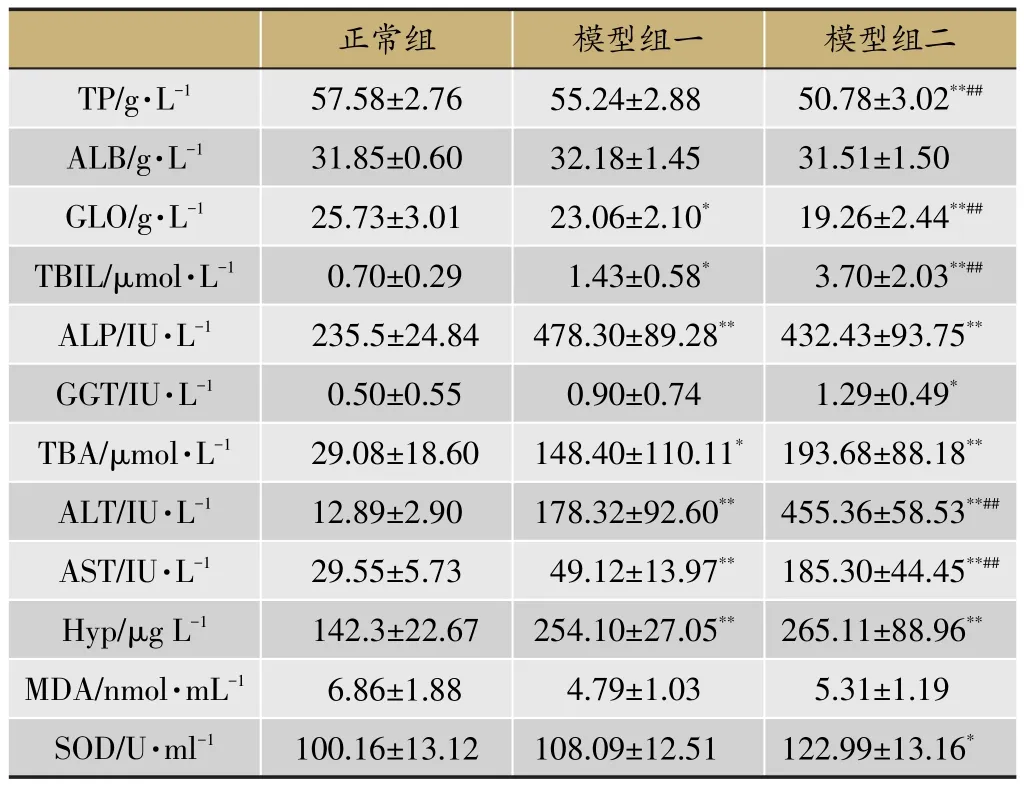
表2 各组血清生化指标统计表

图2 不同组别大鼠血清生化指标柱状图

图3 不同组别肝组织HE染色(×100)
3.3 组织病理观察
肝组织HE染色结果显示(图3):正常组肝脏结构正常;中央静脉旁肝细胞索呈放射状排列,肝细胞体积较大。模型组一中大部分肝细胞肿大,发生脂肪性病变且病变区域多、面积大,病变区域占30%左右,炎症细胞浸润。模型组二中出点胶原纤维与网状纤维沉积形成纤维间隔,肝小叶结构紊乱,脂肪性病变区域达35-40%。
肝组织Masson染色结果显示(图4):正常组结构完整,肝细胞索排列整齐;模型组一中出现大量脂肪变性以及胶原纤维,分析该组全部动物肝组织切片,大部分出现少量胶原纤维度。模型组二中出现大量脂肪变性以及数量较多的胶原纤维,一般胶原纤维不完全分隔包饶肝小叶,严重者出现胶原纤维沉积和形成明显的假小叶。说明湿热环境加重疾病模型严重程度。
3.4 血清代谢组学结果

图4 不同组别肝组织Masson染色(×100)

图5 模型组与正常组比较得分图
通过PCA图就可以看出正常组与模型组二分别出现不同区域的聚集,提示两组之间存在一定差异,PLS-DA分析显示这种差异更加清晰明显(图5)。为了获得湿热环境对模型影响的代谢物质基础,将模型组二与正常组比较,进行OPLS分析,筛选符合VIP>1.0并且p<0.05条件的差异变量,最终定性分析获得17个差异峰,结果见表3。
3.5 肝脏代谢组学结果
模型组二和正常组的肝脏代谢轮廓之间PCA分析结果可以看出在不同的区域聚集,说明两组在肝脏部位代谢物差异明显(图6A)。PLS-DA得分图显示差异性更明显(图6B)。通过多维统计和单维统计,选择VIP>1并且单维统计p<0.05的差异变量,对差异变量进行鉴定核对,代谢差异物结果见表4。
3.7 血清、肝脏代谢通路分析
将血清、肝脏中筛选出的代谢差异物用MBRole数据库进行富集分析,计算出p小于0.05的差异性通路。如表5。可以看出血清、肝脏中存在4条共同的代谢通路,同时又具有各自特异的代谢通路。血清中有4条特异代谢通路,分别为Butanoate metabolism、Glycine,serine and threonine metabolism、Lysine degradation、Primary bile acid biosynthesis。肝脏中也有4条特异代谢通路,Arginine and proline metabolism、Biosynthesis of unsa-
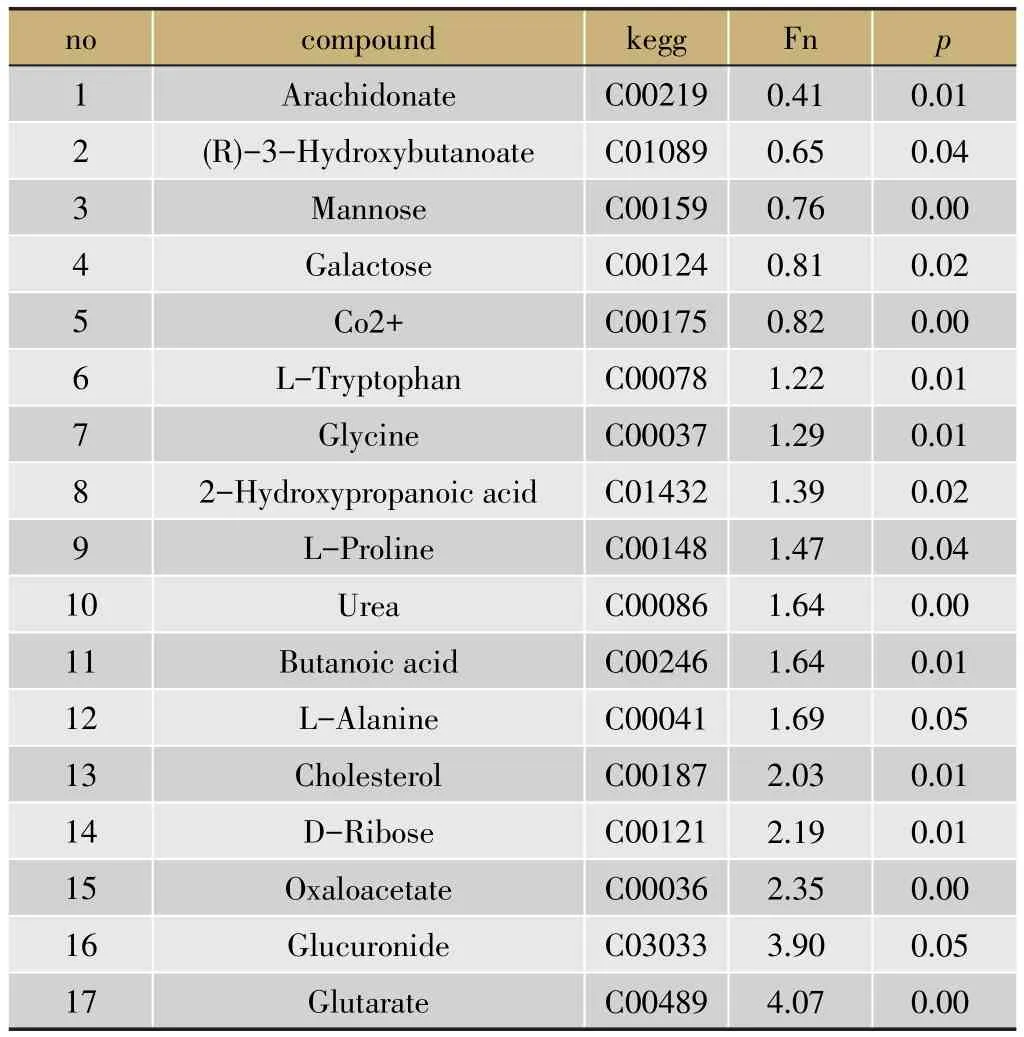
表3 正常组与模型组二之间血清差异性代谢物列表
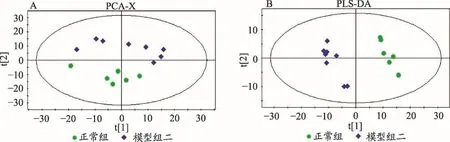
图6 各模型得分图及模型参数
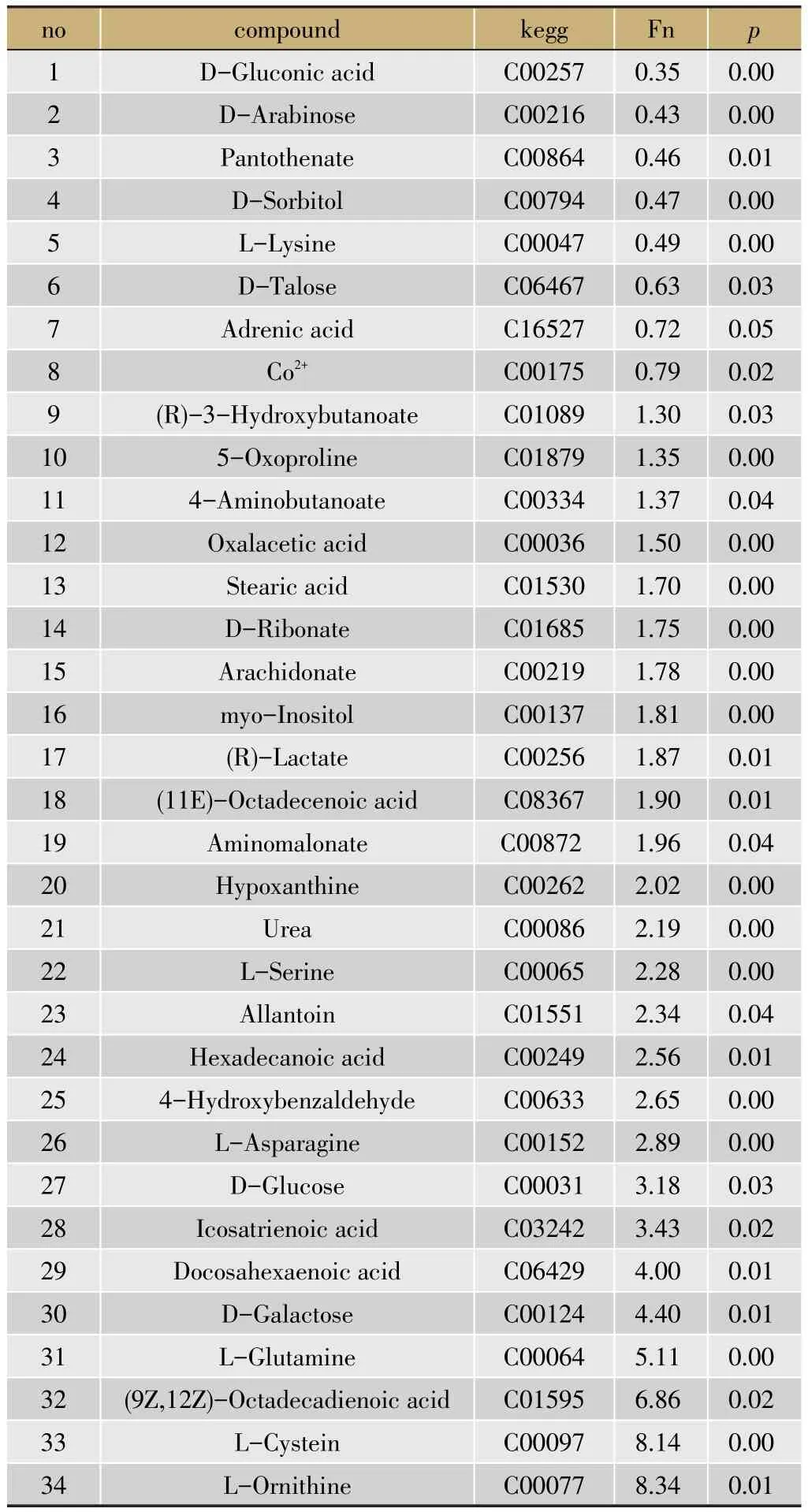
表4 正常组与模型组二之间肝脏差异性代谢物列表
4 讨论
4.1 湿热环境与疾病体征、生化指标
本研究发现正常环境下模型组比正常组大鼠体重明显减轻,其原因为四氯化碳造成,但是在湿热环境下,与正常组相比体重减轻更加明显,同时其饮食量也存在这种变化趋势,即食欲不振。此外,湿热组模型大鼠出现大便稀溏、体毛发黄,肛温升高等体征,与临床湿热表现相似。刘晓鹰等[10]进行IgA肾病湿热证模型复制时,模型组大鼠出现了耸毛、食欲不振、大便稀溏等现象。复制脾胃湿热证大鼠模型过程中发现温病湿热证动物会出现肛温升高、体重减轻、饮食减少、活动减少、大便黏滞等症状,在慢性胃炎大鼠湿热证中,也发现正常组体重高于单纯胃炎组体重,单纯胃炎组高于脾胃湿热组[11]。本研究结果与文献报道相一致。说明了湿热环境因素抑制了大鼠体重的增长,并导致类似临床湿热症状的出现。
血清中ALT、AST含量高低是肝细胞损害程度指标之一。两项指标在湿热环境下模型组中比正常环境下模型组变化更明显,提示湿热环境加重肝细胞损伤。临床研究发现慢性乙型肝炎肝胆湿热证与ALT、AST、GLO、TBIL、GGT等生化指标存在直线正向相关关系[12-14]。研究中正常环境下模型ALT、AST、GLO、TBA、TBIL、ALP与正常组相比具有统计学差异,而湿热环境下这些生化指标的差异性进一步增大,同时,TP、SOD、GGT三个指标也出现了统计学差异。说明湿热环境会使疾病的严重程度加重,与临床研究相似。从组织病理切片(HE染色,Masson染色)结果中可以进一步湿热环境会加速疾病的进展以及加重疾病严重程度。
4.2 湿热环境影响疾病进展的物质基础
通过生化指标、病理组织结果可以得出模型组二比模型组一疾病状态更严重,说明湿热环境加重疾病严重程度。为寻找疾病严重程度与体内代谢物质水平之间的关联,通过代谢组学PCA和PLS-DA模型分析分别在血清、肝脏中找到17、34种差异代谢物,大部分代谢物在湿热环境中比正常环境水平变化更明显,如血清中Mannose、Cholesterol、Oxaloacetate、Glutarate;肝脏中变化明显脂肪酸如Stearic acid,Hexadecanoic acid。对差异代谢物进行通路分析,发现ABC transporters、Alanineaspartateglutamate metabolism、Aminoacyl-tRNA biosynthesis、Galactose metabolism在血清、肝脏中均发生了变化。在血清、肝脏中还发现各自特有代谢通路,其中血清中有4条,肝脏包含4条。将代谢通路进行归类分析,血清中代谢通路主要为氨基酸代谢,肝脏中主要为脂质代谢、氨基酸代谢为主,如图7。血清、肝脏中均发现脂质代谢存在异常,血脂异常则会促使一些炎症因子分泌,如IL-6、TNF-α等表达增加,进而启动了一系列物质表达和信号传递异常[15]。药物肝毒性会引起肝细胞内长链脂肪酸代谢发生紊乱,尤其是脂肪酸的氧化过程,脂类化合物水平会发生显著变化[16],这些改变意味着肝损伤大鼠体内氨基酸代谢、脂代谢、胆汁酸代谢以及体内氧化-抗氧化作用失衡[17]。湿热环境则进一步加重了这些代谢水平紊乱导致加深疾病严重程度。

表5 血清、肝脏差异性通路列表

图7 血清、肝脏代谢通路分析
1 毛果.基于回顾性流行病学调查的1868例慢性乙型肝炎患者中医 证候分布特征研究.湖南:湖南中医药大学硕士学位论文,2015.
2 牛洁.膝骨性关节炎湿热证分布规律及诊断标准探讨.北京:中国中医科学院硕士学位论文,2006.
3 李小会,谢桂权.290例原发性肾病综合征中医证型分布及与感染的相关性研究.辽宁中医杂志,2011(4):616-618.
4 廖荣鑫,吴仕九,文小敏.湿热证的现代研究及进展探讨.辽宁中医杂志,2005,32(10):1007-1008.
5 王瑾,陈宜鸿,赵志玲.中医温病湿热证动物模型实验的研究.解放军药学学报,2002,(04):209-211.
6 冯雪梅.温病湿热证证候规范化研究.广东:广州中医药大学博士学位论文,2007.
7 程方平,李家庚,刘松林,等.湿热证大鼠模型的研制与评价.中华中医药学刊,2007,12:2549-2551.
8 戴建业.整体代谢视角下黄芩柴胡药对对于两种疾病湿热证的药效评价及机制研究.上海:上海中医药大学博士学位论文,2014.
9 孙淑军.补虚化瘀方治疗原发性胆汁性肝硬化的药效机制研究.上海:上海中医药大学博士学位论文,2015.
10刘晓鹰,杜恒,王文广,等.IgA肾病湿热证模型的研制.中华中医药学刊,2008,9:1947-1949.
11赵艺.慢性胃炎大鼠脾胃虚证和湿热证证候模型的造模方法.中国中西医结合消化杂志,2014,(4):221-223.
12李亚萍.慢性乙型肝炎肝胆湿热证规范化诊疗方案的研究.山东:山东中医药大学博士学位论文,2012.
13李梢,张宁波,李志红,等.慢性乙型肝炎患者肝胆湿热证和肝郁脾虚证的决策树诊断模型初探.中国中西医结合杂志,2009,(11):993-996.
14李妮矫,王君,姚树坤.湿热证与肝脏炎症指标的相关性研究.中国中医基础医学杂志,2011,(3):294-295.
15刘子志,尚文璠,常东.舒胆胶囊干预肝胆湿热证疗效观察及对血脂和炎症因子表达的影响.新中医,2014,(9):54-56.
16刘晓燕,刘艳秋,程孟春,等.超高效液相色谱-质谱联用技术在药物肝损伤代谢组学研究中的应用.色谱,2015,(7):683-690.
17杨丽娜,温静,孙毅,等.四逆散抗肝损伤作用的大鼠血清UPLC-MS/MS代谢组学研究.药学学报,2014,(3):368-373.
