黄秋葵水提物的组分及体外抗氧化活性分析
2018-05-10王华
王 华
(河北环境工程学院,河北秦皇岛 066102)
黄秋葵[Abelmoschusesculentus(L.)Moench]为锦葵科秋葵属一年生草本植物,目前在国内多个地区均有栽培,其资源较为丰富。黄秋葵嫩果特有黏性物质,富含蛋白质、不饱和脂肪酸、维生素、多糖、黄酮类化合物等,且营养丰富,黄秋葵还可作为菜、药、花兼用,具有很高的开发利用价值和应用前景[1-2]。目前对于黄秋葵功效研究,主要集中在其抑菌作用、抗氧化、抗疲劳、降血糖血脂、保健护胃等方面[3-6]。
自由基作为生命活动的天然中间代谢产物,与生命体损伤、衰老和一些疾病密切相关。因此,天然抗氧化物质清除自由基的能力已经成为体外抗氧化活性研究的热点[7-9]。已有利用黄秋葵水提物进行抗疲劳与降血糖等相关研究[3-5],但目前未见对黄秋葵水提物体外抗氧化作用的系统研究报道。本研究以黄秋葵嫩荚的水提物为基础,通过2种不同干燥方法获得黄秋葵水提物干品,进行系统的体外抗氧化研究,以期为黄秋葵水提物的综合利用提供理论和实践依据。
1 材料与方法
1.1 材料与试剂
黄秋葵,购自北京新发地农产品批发市场。2,2′-联氨-二(3-乙基-苯并噻唑-6-磺酸)(ABTS),Sigma;1,1-二苯基-2-三硝基苯肼(DPPH),Sigma;2,4,6-三吡啶基三嗪(TPTZ),Sigma;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),Sigma;2,2′-偶氮二(2-甲基丙基咪)二盐酸盐(简称AAPH),Sigma;其他试剂为国产分析纯。
1.2 仪器与设备
2802紫外-可见分光光度计,UNICO公司;XH-C旋涡振荡仪,金坛市医疗仪器厂;RE-6000亚荣旋蒸蒸发器,上海亚荣生化仪器厂;HZQ-F160全温振荡培养箱,常州诺基仪器有限公司;EpochTM微孔板分光光度计,美国伯腾仪器有限公司(BioTek);Infinite M200 Pro多功能酶标仪,帝肯(上海)贸易有限公司(Tecan Group Ltd)。
1.3 黄秋葵水提物的提取工艺
黄秋葵嫩荚→切片→自然晾干→加水浸泡(加热搅拌)→过滤→滤液烘干→称质量。
黄秋葵水提物提取率计算公式:
水提物得率=(水提物质量/黄秋葵鲜质量)×100%。
1.4 测定方法
1.4.1 多糖和总糖测定方法
1.4.1.1 标准曲线的绘制[10]配制0.2 mg/mL葡萄糖标准溶液,分别吸取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL葡萄糖标准溶液,各以水补至2.0 mL,加入6%苯酚1 mL,然后迅速加入5 mL浓硫酸,静止10 min,摇匀,室温放置20 min后于490 nm测定吸光度,用2 mL水按同样显色操作作为空白对照,横坐标为多糖浓度(mg/mL),纵坐标为吸光度,得到标准曲线。
1.4.1.2 黄秋葵多糖含量的测定 称取1.00 g黄秋葵水提物,加入100 mL蒸馏水,超声溶解,然后加入4倍体积的无水乙醇,静置2 h,离心,烘干。
将黄秋葵粗多糖加入一定体积的蒸馏水中溶解,经适当稀释后,参照“1.4.1.1”节标准曲线的制作方法进行样品中多糖含量的测定。
1.4.1.3 黄秋葵总糖含量的测定 称取1 g黄秋葵水提物,加入100 mL蒸馏水,超声溶解,定容至100 mL,取1 mL样品,稀释至100 mL,参照“1.4.1.1”节标准曲线的制作方法进行样品中总糖含量的测定。
1.4.2 水分含量的测定 参照GB 5009.3—2016《食品中水分的测定》。
1.4.3 灰分含量的测定 参照GB 5009.4—2016《食品中灰分的测定》。
1.4.4 果胶含量的测定 参照NY/T 2016—2011《水果及其制品中果胶含量的测定》。
1.5 抗氧化测定方法
1.5.1 ABTS+·清除能力 参考Li等的方法[11],分别配制ABTS储备液(7.4 mmol/L)、K2S2O8储备液(2.6 mmol/L)、Trolox标准液(0.3 mmol/L),以及不同浓度的黄秋葵水提物水溶液。取上述ABTS储备液0.2 mL与K2S2O8储备液 0.2 mL 混匀,于室温黑暗处存放12 h,稀释40~50倍即为ABTS工作液,使其在734 nm处的吸光度为0.7±0.02。取ABTS工作液0.8 mL和样品0.2 mL,混匀,振荡10 s,静置 6 min。以蒸馏水作为空白对照,以Trolox标准液作为阳性对照。ABTS+·清除率计算公式如下:
ABTS+·清除率=[D734 nm(0)-D734 nm]/D734 nm(0)×100%。
式中:D734 nm(0)为空白对照在734 nm处的吸光度。
1.5.2 DPPH自由基清除能力 参考Li等的方法[11],取 1 mL DPPH乙醇溶液(0.05 mg/mL),在519 nm处测吸光度(以1.2~1.3最佳)。取2 mL上述DPPH溶液加入试管中,加入1 mL不同浓度的样品液,混合,静置30 min,测D519 nm。以蒸馏水作为空白对照,以Trolox标准液作为阳性对照。DPPH自由基清除率计算公式如下:
DPPH自由基清除率=[D519 nm(0)-D519 nm]/D519 nm(0)×100%。
式中:D519 nm(0)为空白对照在519 nm处的吸光度。
1.5.3 ·OH清除能力[12]参考文镜等的方法[12],稍作改动。清除羟自由基能力参照水杨酸捕捉羟自由基法测定。取9 mmol/L FeSO4溶液、9 mmol/L水杨酸溶液各1 mL,加入不同浓度的样品溶液1 mL与适量蒸馏水,最后加入 1 mL 8.8 mmol/L H2O2溶液后摇匀,37 ℃水浴加热15 min,测其D593 nm。空白对照溶液为去离子水,参比溶液为不加双氧水的体系。·OH清除率计算公式如下:
·OH清除率={D593 nm(0)-[D593 nm(x)-D593 nm(x0)]}/D593 nm(0)×100%。
式中:D593 nm(0)为空白对照在593 nm处的吸光度;D593 nm(x0)为空白参比溶液在593 nm处的吸光度;D593 nm(x)为样品参比溶液在593 nm处的吸光度。


式中:ΔD325 nm(0)为空白对照时在300 s与0 s时于325 nm处吸光度的差值;ΔD325 nm(sample)为样品在300 s与0 s时于 325 nm 处吸光度的差值。
1.5.5 铁离子还原/抗氧化能力(ferricion reducing atioxidant power,简称FRAP) 参考Benzie等的方法[13-14],稍作修改。取0.3 mL样品,加2.7 mL预热至37 ℃的FRAP工作液,摇匀后放置10 min,于593 nm处测其吸光度,以蒸馏水为空白对照。根据所得D593 nm,在标准曲线上求得相应FeSO4浓度,定义为FRAP值(单位μmol/g,以Trolox计),其值越大,抗氧化活性越强。以Trolox作为阳性对照。
1.5.6 氧化自由基吸收能力(oxygen radical absorbance capacity,简称ORAC) 参考相关方法[15-16],取荧光素钠溶液(80 nmol/L)100 μL于96孔荧光板中,加入不同浓度样品溶液50 μL振荡5 min,37 ℃温育10 min后迅速加入AAPH液(153 mmol/L)50 μL启动反应,每隔2 min测定1次荧光值(记为Fn,激发波长485 nm,发射波长535 nm)。以Trolox作为阳性对照,计算ORAC值(单位μmol/g,以Trolox计)。
2 结果与分析
2.1 黄秋葵水提物的制备
将10 kg新鲜黄秋葵用自来水清洗后切片(5~10 mm),自然晾干称质量得1.28 kg。取干品500 g,料液比 1 g ∶20 mL,95 ℃提取1 h,提取2次,过滤合并滤液,浓缩、干燥后得到173 g,黄秋葵水提物得率为4.43%。
2.2 水提物主要营养成分
由表1可以看出,冻干水提物中功能成分多糖含量高达12.01%,黄酮含量为1.10%,果胶含量为2.0%。在不同干燥条件下,除水分含量,水提物中功能成分含量没明显差异。
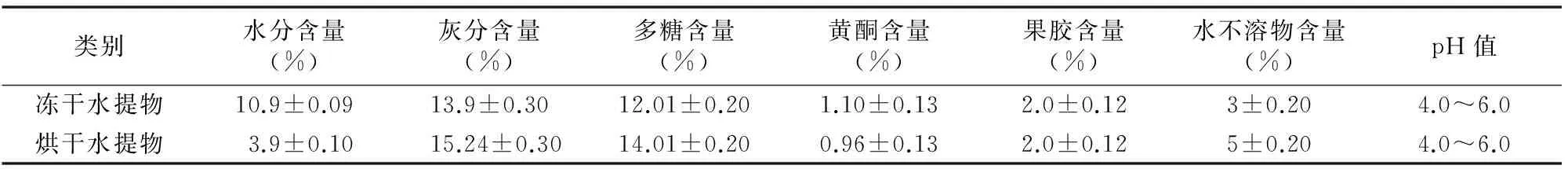
表1黄秋葵水提物各营养成分(n=3)
2.3 抗氧化能力
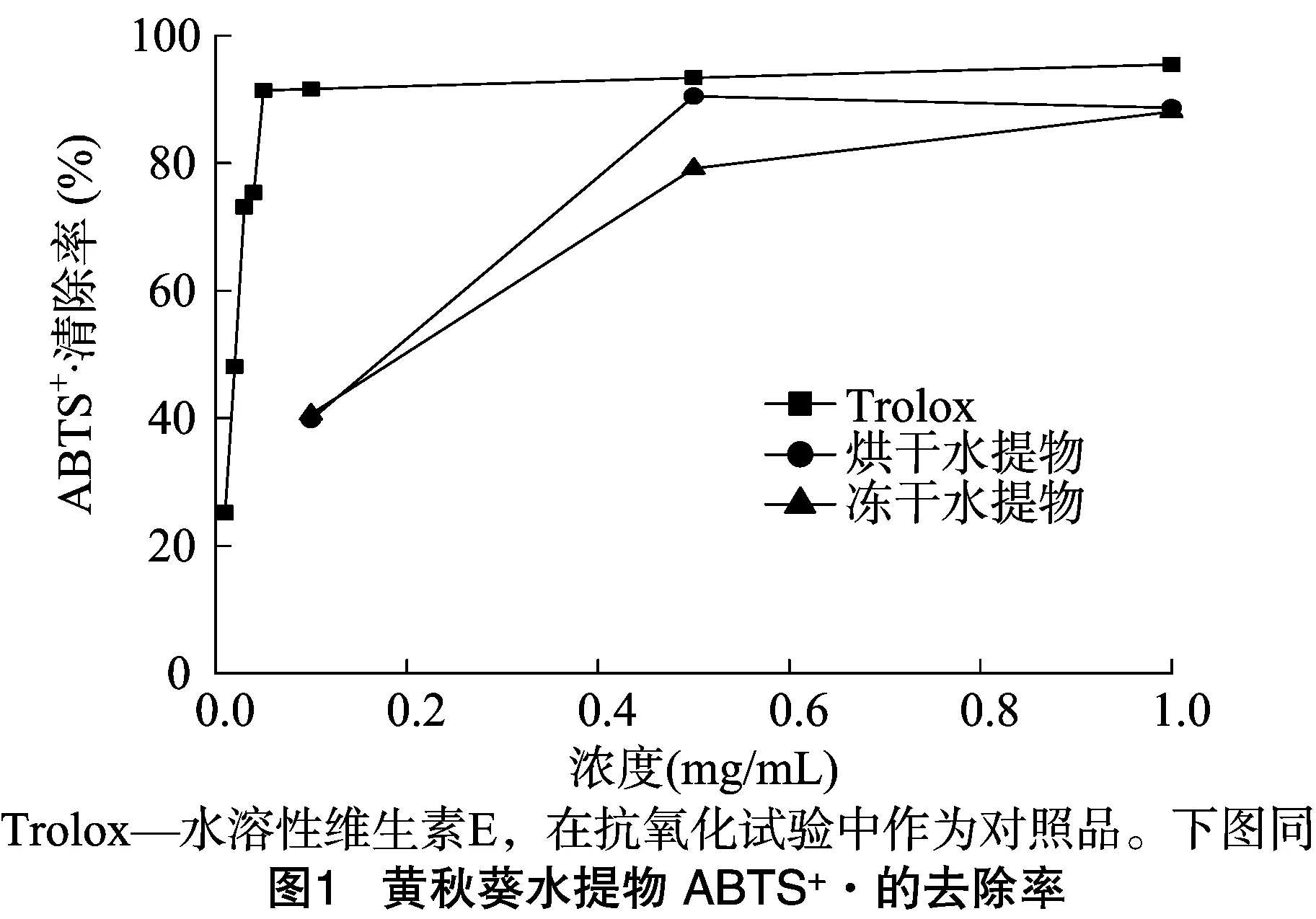
2.3.1 ABTS+·清除能力 由图1可见,当黄秋葵水提物浓度≥0.5 mg/mL时,黄秋葵水提物的ABTS+·清除能力均高于79%,当黄秋葵水提物浓度为0.1 mg/mL时,黄秋葵水提物的ABTS+·清除能力下降了50%。可见黄秋葵水提物的不同干燥方式对ABTS+·清除能力影响不明显,烘干处理的EC50约为0.2 mg/mL。
2.3.2 DPPH·清除能力 如图2所示,黄秋葵水提物经烘干后,当浓度达到0.6 mg/mL时,DPPH·清除率达到最大值,黄秋葵烘干水提物的EC50约为2.3 mg/mL;而经冻干的黄秋葵水提物其DPPH·清除率随着浓度增大而增高,当浓度达到1.0 mg/mL时,DPPH·清除率达到79.1%,黄秋葵冻干水提物的EC50约为0.1 mg/mL。
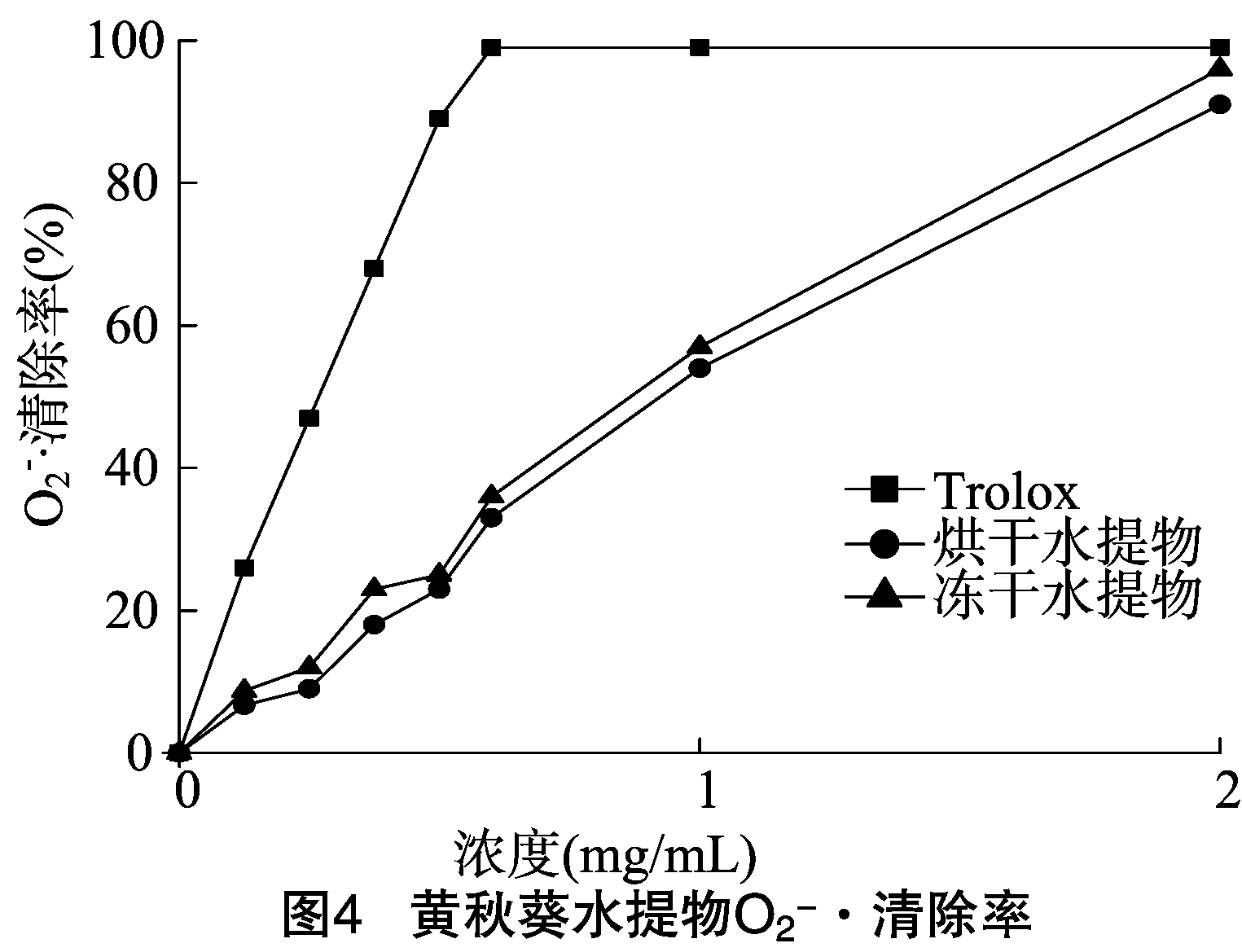
2.3.3 ·OH清除能力 如图3所示,黄秋葵水提物干燥后,对·OH清除能力具有一定的浓度依赖关系,随着浓度增大而增强,冻干处理黄秋葵水提物的EC50约为8.3 mg/mL。



2.3.5 其他抗氧化活性 参考Benzie等方法[13-14],稍作修改。以FeSO4作为标准品,其标准曲线回归方程为y=0.002 3x+0.319(r2=0.993);以Trolox作为阳性对照,其标准曲线回归方程为y=0.005 9x+0.030 8(r2=0.998)。根据回归方程计算,烘干水提物与冻干水提物FRAP如表2所示。在测定水提物FRAP的过程中,发现其抗氧化能力和浓度有一定量效关系,与李孟秋等的研究结果一致[9]。
参考相关方法[15-16],以Trolox为阳性对照,其标准曲线回归方程为y=0.276 6x+15.311(r2=0.991)。根据回归方程计算烘干水提物与冻干水提物的ORAC如表2所示,可见水提物总抗过氧化自由基能力ORAC高于常见蔬菜青花菜(总ORAC为168 μmol/g)。
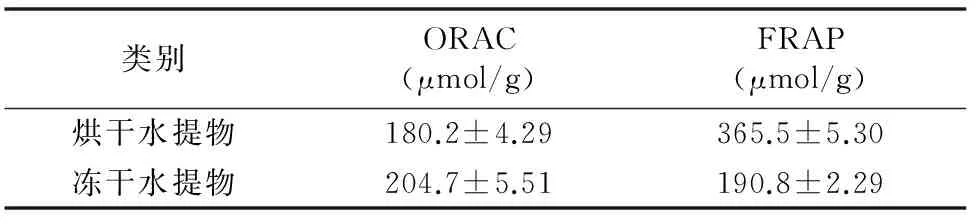
表2黄秋葵水提物FRAP和ORAC(n=3)
3 结论
黄秋葵水提物经热风烘干或冷冻干燥,在其体外抗氧化性研究中,不同干燥方法对体外抗氧化性有一定影响,干燥方法除对DPPH·清除率与ORAC有明显影响外,对其抗氧化能力没有明显影响。在后续试验中,在选取FRAP的测定过程中,发现其抗氧化能力和浓度有一定量效关系,并且在模拟胃液和肠液代谢研究过程中具有不同的变化规律,这需要在今后进行系统的研究。
参考文献:
[1]Savello P A,Martin F W,Hill J W. Nutrition composition of okra seed meal[J]. Journal of Agricultural and Food Chemistry,1980,28(6):1163-1166.
[2]董彩文,梁少华. 黄秋葵的功能特性及综合开发利用[J]. 食品研究与开发,2007,28(5):180-182.
[3]张灵敏,王 玲,贾 奥,等. 黄秋葵水提物对2型糖尿病大鼠糖代谢的影响[J]. 食品工业科技,2016,37(3):355-358,363.
[4]Wang H,Chen G,Ren D,et al. Hypolipidemic activity of okra is mediated through inhibition of lipogenesis and upregulation of cholesterol degradation[J]. Phytotherapy Research,2013,28(2):268-273.
[5]钟 雨,闫明珠,张泽生,等. 黄秋葵水提物抗运动疲劳作用研究[J]. 食品科技,2015(7):221-225.
[6]Sabitha V,Ramachandran S,Naveen K R,et al. Antidiabetic and antihyperlipidemic potential ofAbelmoschusesculentus(L.) Moench. in streptozotocin-induced diabetic rats[J]. J Pharm Bioallied Sci,2011,3(3):397-402.
[7]Du L Q,Shen Y X,Zhang X M,et al. Antioxidantrich phytochemicals in miracle berry (Synsepalumdulcificum) and antioxidant activity of
its extracts[J]. Food Chemistry,2014,153(9):279-284.
[8]Zeng W C,Zhang Z,Jia L R. Antioxidant activity and characterization of antioxidant polysaccharidesfrom pine needle (Cedrusdeodara)[J]. Carbohydrate Polymers,2014,108(108):58-64.
[9]李孟秋,翟俊乐,田 欢,等. 黄秋葵提取物体外抗氧化活性的研究[J]. 中国食品添加剂,2015(10):65-69.
[10]DuBois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[11]Li X C,Lin J,Gao Y X,et al. Antioxidant activity and mechanism of rhizoma Cimicifugae[J]. Chemistry Central Journal,2012,6(1):140.
[12]文 镜,贺素华,杨育颖,等. 保健食品清除自由基作用的体外测定方法和原理[J]. 食品科学,2004,25(1):190-195.
[13]Benzie I F,Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”:the FRAP assay[J]. Anal Biochem,1996,239(1):70-76.
[14]Pulido R,Bravo A L,Saura-Calixto F. Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/antioxidant power assay[J]. J Agric Food Chem,2000,48(8):3396-3402.
[15]续洁琨,姚新生,栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报,2006,22(8):1015-1021.
[16]Dávalos A,Gómez-Cordovés C,Bartolome B. Extending applicability of the oxygen radical absorbanee capacity (ORAC-fluorescein) assay[J]. J Agric Food Chem,2004,52(1):48-54.
