MS-222麻醉剂对短须裂腹鱼人工繁殖的麻醉影响
2018-05-10邓龙君甘维熊刘小帅曾如奎刘明昌
邓龙君, 甘维熊, 刘小帅, 曾如奎, 刘明昌, 曾 焱, 朱 欧, 冯 钢
(雅砻江流域水电开发有限公司,四川成都 610051)

1 材料与方法
1.1 材料
试验用水:采用雅砻江支沟磨子沟水,符合国家二类水质标准。经循环水系统和温控系统处理,车间和催产池水温(14.5±1)℃,pH值为8.4,溶解氧(dissolved cxygen,简称DO)含量≥8 mg/L。
试验用鱼:短须裂腹鱼苗为锦屏·官地鱼类增殖站2014年自行繁殖的鱼苗,平均体长(17.9±1.7)cm,平均体质量(50.8±15.3)g,健壮无伤,试验前暂养于养殖缸(r=1 m)内,试验开始前24 h进行停食。雌亲鱼腹部膨大柔软,体长44.5~64.5 cm,体质量0.9~3.3 kg;雄亲鱼珠星明显,体长37.5~48.0 cm,体质量0.5~1.3 kg,产前暂养于25 m2的催产池内,进行流水刺激,产卵期间不投食。
试验药品及仪器:鱼用麻醉剂MS-222(间氨基苯甲酸乙酯甲磺酸盐),购自上海康汀生物科技公司(纯度≥98%)。HI 9829多参数水质测定仪,哈纳沃德仪器公司;FA2004电子天平(最大称量值=200 g,精确度=0.1 mg),上海舜宇恒平科学仪器公司;Scout SE电子天平(最大称量值=600 g,精确度=0.01 g),奥豪斯仪器公司。
1.2 试验设计
在人工繁殖中,亲鱼在催产和授精时需多次重复麻醉,麻醉后的亲鱼在授精时会离水并于空气中暴露一定时间,暴露时间依据卵子的排空时间而定。本研究选择MS-222并设置40、60、70、80、100 mg/L共5个浓度,首先以鱼苗为对象,测定有效麻醉浓度;其次在有效浓度中深度麻醉鱼苗并于空气中暴露2~12 min后复苏,确定适宜的暴露时间范围;同时在有效浓度中每隔4 h深度麻醉鱼苗1次,共4次,测试反复麻醉对复苏的影响。在此基础上,以待产亲鱼为对象,测定有效浓度、空气中暴露时间和重复麻醉对其人工繁殖和受精率的影响。
1.3 不同浓度MS-222溶液的pH值
不同浓度MS-222溶液测得的pH值见表1,可见pH值变化包含在淡水渔业水质标准的pH值6.5~8.5范围内,因而各组未添加NaHCO3进行pH值调节。

表1不同浓度MS-222溶液的pH值
1.4 麻醉和复苏判定标准
参考MS-222麻醉鳜鱼研究中的麻醉和复苏不同阶段鱼的行为特征[3]作为判断标准,并结合试验鱼的实际表现,将麻醉和复苏分别分为5个阶段和4个阶段(表2)。麻醉时间从鱼被放入麻醉液中开始到麻醉A3期为止。复苏时间从麻醉鱼进入清水中开始到复苏R3期为止,1 h内未苏醒判定为死亡。根据Marking等认定的理想麻醉浓度标准[8],本试验有效麻醉浓度设定为3 min内麻醉,5 min内复苏,15 min后成活率是100%的浓度。

表2麻醉和复苏过程分期及鱼的行为特征
1.5 预试验
(1)MS-222对鱼苗的麻醉效果:依据设计浓度,准确称取MS-222分别放入6个圆形塑料盆内(r=23 cm),每盆均装有10 L洁净的循环水,充分搅拌均匀并静止2 min。将75尾鱼苗随机分成5组,每组15尾,分别放入以上配好的MS-222溶液中浸浴15 min后立即移出放入相同体积的循环水中进行复苏。观察鱼的行为特征,记录麻醉和复苏时间,以≥8尾鱼苗达到某一阶段特征的时间为准,测定有效麻醉浓度,并统计成活率。
(2)暴露时间对深度麻醉鱼苗复苏的影响:将35尾鱼苗放入有效麻醉浓度中8 min深麻,然后移出并用湿毛巾包裹鱼体中后部,置于空气中暴露0(对照)、2、4、6、8、10、12 min,之后再放入相同体积的循环水中复苏,记录复苏时间,每分钟数用鱼5尾,并统计复苏率。
(3)反复麻醉对深度麻醉鱼苗复苏的影响:将5尾鱼苗放入有效麻醉浓度中8 min深麻,然后移出并用湿毛巾包裹鱼体中后部,置于空气中暴露6 min后放入相同体积的循环水中复苏,记录复苏时间。每间隔4 h重复麻醉1次,连续麻醉4次。
1.6 MS-222对亲鱼人工繁殖的影响
3月19日挑选一批短须裂腹鱼亲鱼,20日19:00用有效麻醉浓度的MS-222将其麻醉后一次性注射促黄体激素释放激素类似物A2型(LHRH-A2)(16 μg/kg)、马来酸地欧酮(DOM)(5 mg/kg)和绒毛膜促性腺激素(HCG)(1 400 IU/kg),23日 08:30 挑选临产雌鱼8尾,配对雄鱼8尾,随机分为2组。麻醉组采取单对试验法,将1对雌雄亲鱼放入有效浓度中麻醉,观察鱼的行为特征,记录麻醉时间;将进入麻醉期的亲鱼移出并计时,用湿毛巾包裹并拭干,实施采卵授精,记录离水拭干和卵子排空时间;延长亲鱼在空气中暴露时间至4 min,然后立即放入清水中进行复苏,记录复苏时间。对照组亲鱼不麻醉,直接采卵授精。授精后将受精卵清洗3次并脱黏放入孵化框中孵化,统计受精率。
1.7 数据处理
所有数据采用SPSS 19.0软件进行单因素方差分析,结果以“平均数±标准差”表示。采用Excel进行回归分析,结果以回归方程和相关系数表示。
2 结果与分析
2.1 MS-222对鱼苗的麻醉效果
由表3可知,随着浓度的增加,麻醉时间呈现递减,而复苏时间呈现增加的变化趋势,各组鱼苗在浸浴15 min后全部存活,24 h后无一死亡。40 mg/L浓度下,鱼苗一直处于深度镇静的A1期,在358.6 s后小部分鱼苗在缓慢游动,大部分鱼苗静止不动,少数个体身体微侧,使其平躺后挣扎能恢复,15 min后放入清水中迅速恢复。60 mg/L浓度下不能达到深度麻醉的A4期,70 mg/L浓度下不能达到延髓麻醉的A5期。80 mg/L浓度下麻醉时间(140.4 s)<3 min,复苏时间(181.3 s)<5 min,而100 mg/L浓度下的复苏时间(327.2 s)则>5 min,因此80 mg/LMS-222为鱼苗的有效麻醉浓度。
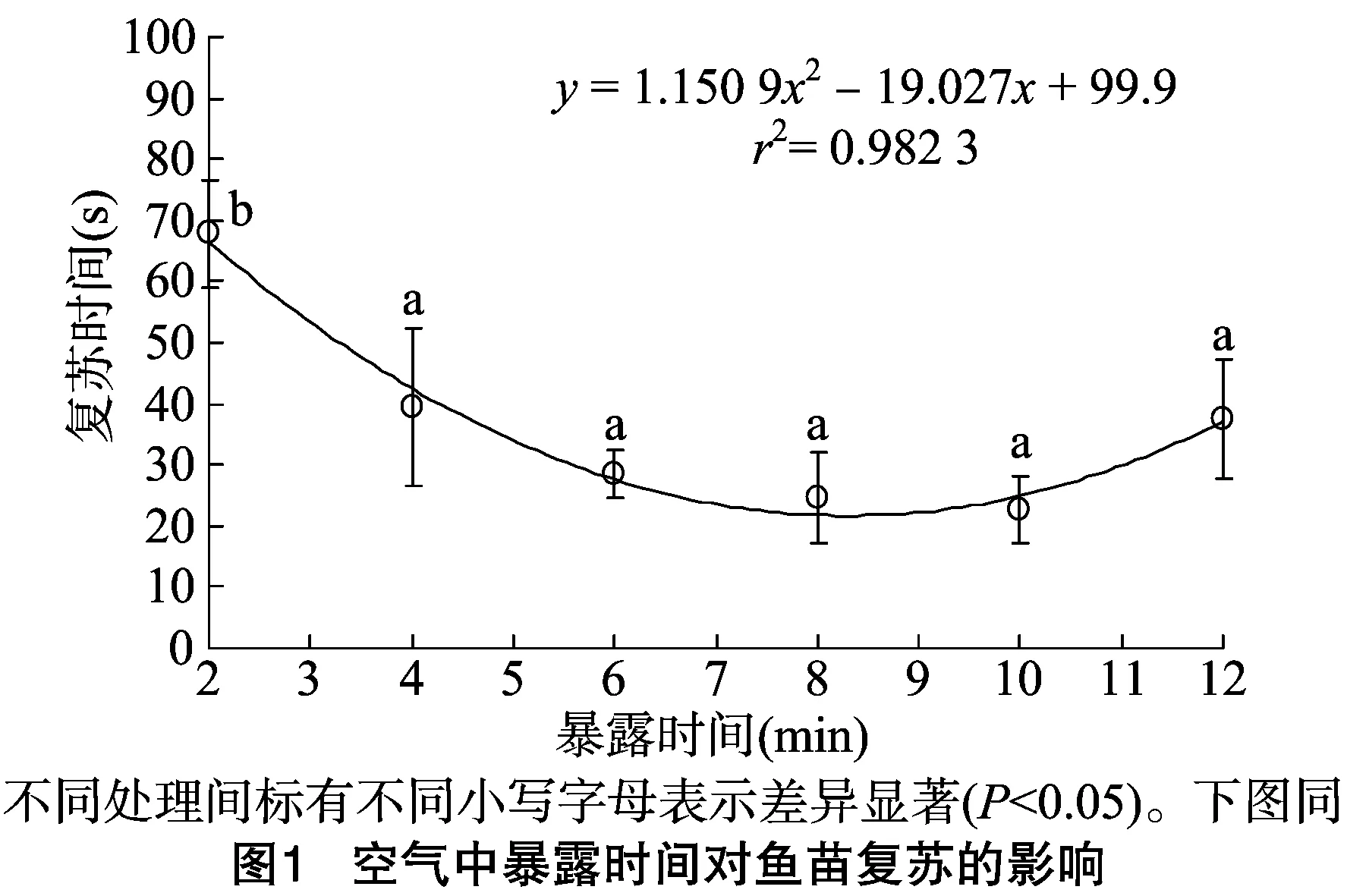
2.2 暴露时间对深度麻醉鱼苗复苏的影响
深度麻醉的鱼苗在暴露不同时间全部复苏成活,由图1可知,暴露初期,各组鱼苗均呈现A4期深度麻醉的典型特征,鱼体平躺静止,对外界刺激无反应。随着暴露时间的增加,呼吸逐渐恢复,在空气中暴露286 s后,暴露时间为6~12 min 的4个组均有1尾鱼头部或尾部上翘挣扎,随时间延长挣扎越强烈。复苏时间随着暴露时间的延长呈现先下降后增加的趋势。暴露0 min(对照)时,复苏时间为129.8 s,极显著高于其他各组(P<0.01);暴露2 min时复苏时间为 67.8 s,显著高于暴露4~12 min的5个组(P<0.05);暴露10 min时复苏时间最少, 为22.6 s, 暴露12 min时复苏时间(37.6 s)则开始上升;但暴露4~12 min的5个组的复苏时间差异并不显著(P>0.05)。

表3不同浓度MS-222对鱼苗的麻醉效果
注:“—”表示试验过程中未观察到相应的状态。
2.3 反复麻醉对深度麻醉鱼苗复苏的影响
反复深度麻醉鱼苗的复苏时间变化,由图2可知,经过4次重复麻醉后,鱼苗的复苏时间差异不显著(P>0.05),平均复苏时间为30 s。
2.4 MS-222对亲鱼麻醉和暴露后复苏的影响
80 mg/L MS-222对亲鱼麻醉和暴露4 min后复苏的影响见表4,可见雌鱼进入麻醉A3期的平均时间为 181.3 s,显著高于雄鱼(157 s)(P<0.05),极显著高于鱼苗(140 s)(P<0.01),雄鱼也高于鱼苗,但差异不显著。暴露后复苏,雌鱼达到复苏R3期的平均时间为135.5 s,显著高于雄鱼(101.3 s)(P<0.05),均极显著高于鱼苗(39.4 s)(P<0.01)。雌鱼的麻醉时间略高于3 min,可见MS-222 80 mg/L对鱼苗和亲鱼均能起到较好的麻醉效果,但随着个体大小的增加,尤其是对于3 kg以上的亲鱼,应适当增加麻醉剂量。

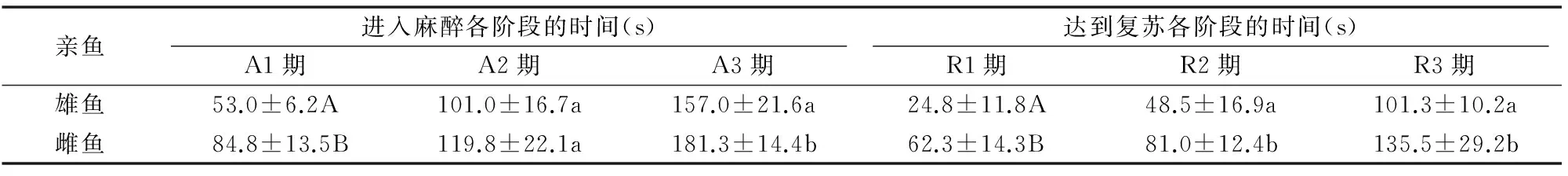
表4MS-222对亲鱼麻醉和暴露后复苏的影响
注:同列数据后不同大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。
2.5 MS-222对亲鱼人工繁殖的影响
80 mg/L MS-222对亲鱼人工繁殖的影响见表5,麻醉组雌鱼离水至卵子排空的平均时间为49 s,卵子排空的平均时间为25 s,分别极显著低于对照组的83.3和50.5 s(P<0.01);且挣扎多发生于离水拭干时,雌鱼平均挣扎1.8次,尾巴左右摆动2.3次,雄鱼挣扎0.6次,尾巴摆动0.4次,仅有1尾雌鱼在采卵时挣扎1次,尾巴摆动1次。而对照组雌鱼平均挣扎3.2次,尾巴摆动4.3次,1尾雌鱼离水时剧烈挣扎并掉落在海绵垫上,3尾雌鱼在采卵时挣扎;雄鱼挣扎1.4次,尾巴摆动2.9次,3尾雄鱼在采精时挣扎,可见麻醉后亲鱼的挣扎次数和强度均明显降低。在空气中暴露110和89 s后,雌雄亲鱼逐渐恢复苏醒并翘起头部挣扎, 随着时间推移挣扎越强烈,尾部也摆动挣扎,甚至有腾空跳起现象,鳃盖张合开度明显大于平时,类似于人的“深呼吸”。麻醉组的平均受精率为77%,相比对照组(74.6%)差异不明显。
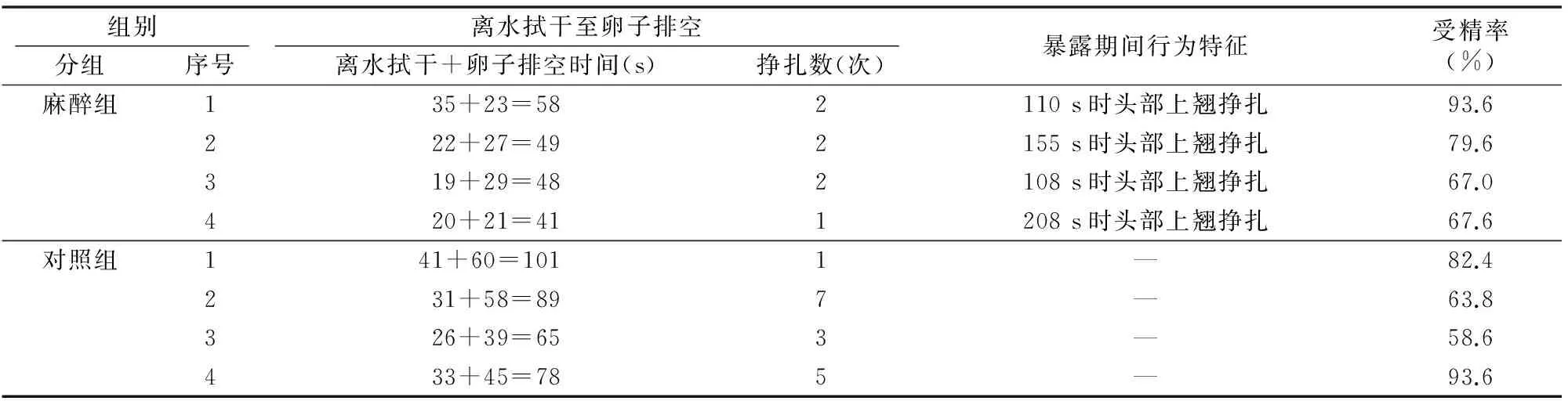
表5MS-222对亲鱼人工繁殖的影响
注:“—”表示未麻醉对照组无相应的状态及数据。
3 讨论
3.1 MS-222对短须裂腹鱼的麻醉效果
影响MS-222麻醉效果的因素较多,但在相同条件下,浓度起着决定性作用。本试验中,用不同浓度MS-222麻醉鱼苗,麻醉时间与浓度呈负相关,复苏时间与浓度则呈正相关。研究认为深度镇静期是运输的适宜时期[9],麻醉期是操作的最佳时期[10]。当MS-222浓度为40 mg/L时,鱼苗可深度镇静,但不能麻醉,故40 mg/L可作为短须裂腹鱼苗运输和亲鱼站内转运的参考浓度,但是否适宜长途运输需进一步研究;60~100 mg/L 浓度时均能麻醉,可进行短时间的试验和生产操作,但60 mg/L浓度时不能深度麻醉,故60 mg/L可作为短时间操作的安全浓度;100 mg/L浓度时麻醉时间小于 3 min,而复苏时间比5 min长了27 s,推测90 mg/L可能也为有效麻醉浓度,尚有待进一步研究证实。这与MS-222麻醉光唇裂腹鱼稚鱼[7]的30~40 mg/L轻度镇静,60~70 mg/L不能深度麻醉,75~80 mg/L能深度麻醉的结论相似。
一般来说,鱼的规格越大,所需麻醉剂的剂量越高。本试验中,80 mg/L浓度时鱼苗进入麻醉期的时间最短,雄亲鱼次之,雌亲鱼最长(181.3 s)且略长于3 min,故在亲鱼催产授精时可适当增加麻醉剂量,如3 kg以上的亲鱼可用90 mg/L。这与MS-222麻醉泥鳅[1]、施氏鲟[4]、大鲵[11]的研究得出的规格越大,进入麻醉期时间越长的结论相符。Oikawa等研究认为,仔鱼期皮肤呼吸占很大比重,造成其对麻醉剂的敏感性较强;随着生长,皮肤呼吸的相对重要性逐渐下降,而鳃呼吸逐渐占据主导地位[12]。这可能就是光唇裂腹鱼稚鱼的有效麻醉浓度(60 mg/L)低于本试验短须裂腹鱼苗的主要原因,其次可能还有种间差异的缘故。
3.2 暴露时间和反复麻醉对短须裂腹鱼的影响
反复麻醉试验结果显示,4次重复麻醉对短须裂腹鱼苗的复苏时间无显著影响,说明在人工繁殖中可以多次使用 MS-222 重复麻醉亲鱼,以减少在挑选转运、催产授精时造成的损伤。本试验中,亲鱼在注射催产激素和采卵授精时的2次麻醉也充分证明了这一点。随着鱼的年龄和规格的增加,鳃呼吸逐渐占据主导地位,所需麻醉剂量也随之增加,但经鳃吸收的麻醉剂却极易导致窒息,且复苏率偏低[13],故在生产中不可随意增加用量和任意延长麻醉时间。
暴露试验结果显示,鱼苗在空气中暴露4~10 min时,复苏时间无显著差异。为此选择将进入麻醉期的亲鱼在空气中暴露4 min后立即复苏,雌鱼的复苏时间最长,雄鱼次之。研究表明,将麻醉后的鱼体转入清水中,MS-222由鳃、皮肤等逐渐排出体外,其完全排出的先后顺序为肌肉、肝脏、脑和血液[14]。规格越大的鱼,麻醉后富集的MS-222越多,推测亲鱼暴露于空气中后,原本通过水体的排出通道不能顺畅进行,体内神经系统的麻醉剂则随着血液循环向身体其他部分分散,由此形成“神经系统—肌肉—湿润的外部环境”之间的排出通道[15],使得神经麻醉程度逐渐降低,鱼在一定程度上恢复苏醒,复苏时间也随之减少。
3.3 MS-222对短须裂腹鱼人工繁殖的影响
经麻醉后的短须裂腹鱼亲鱼在采卵授精时,其挣扎次数和强度明显弱于未麻醉的对照组,且主要集中于离开水体和拭干体表水分的10 s左右时间。分析原因为进入麻醉期的亲鱼并未完全丧失反应能力,呼吸减弱但尚未停止,所以当亲鱼离水后会发生潜意识地挣扎,但麻醉作用使得鱼体挣扎力不从心,促使亲鱼采卵时间大为缩短,人工繁殖得以流畅进行,故亲鱼在繁殖过程中被人为损伤的程度就会大大降低。暴露期间,雌雄亲鱼分别在110和89 s后开始头部翘起挣扎,表明亲鱼在一定程度上已经苏醒并亟需水分和氧气。因此为不影响亲鱼的健康,完成1组麻醉后亲鱼的采卵授精应控制在 89 s 内,并立即放入清水中进行复苏。
受精卵的采集是增殖放流过程中的关键环节,影响受精率的主要因素为精卵质量和授精方法,其次为环境因素。麻醉后的短须裂腹鱼亲鱼在授精时还需要考虑麻醉剂的影响。Billard研究认为,麻醉剂在授精稀释液中的浓度大于0.05%时才会影响精子的活力,麻醉剂对人工授精时产生不利影响的概率很低[16]。Wagner等研究认为,丁香油、MS-222和CO2麻醉虹鳟时不会影响运动精子的百分比例,但能影响精子持续运动的时间,随着麻醉剂浓度的增加,精子持续运动的时间随之缩短,但麻醉组受精卵的发育和孵化出苗的畸形率均与对照组无显著差异[17]。本试验采用干法人工授精,拭干亲鱼体表带有MS-222的多余水分,以降低MS-222对精子持续运动时间的影响,统计分析麻醉组的受精率与对照组并无明显差异。
参考文献:
[1]韩光明,毕建花,张家宏,等. 间氨基苯甲酸乙酯甲磺酸盐对泥鳅的麻醉效果[J]. 广东海洋大学学报,2015,35(4):17-23.

[3]郭丰红,汪之和. MS-222对鳜鱼成鱼麻醉效果的研究[J]. 湖南农业科学,2009(7):150-153.
[4]陈细华,朱永久,刘鉴毅,等. MS-222对中华鲟和施氏鲟的麻醉试验[J]. 淡水渔业,2006,36(1):39-42.

[6]曲焕韬,刘 勇,郭文韬,等. 间氨基苯甲酸乙酯甲磺酸盐对厚颌鲂幼鱼麻醉效果的研究[J]. 水产科学,2014,33(6):374-378.
[7]吴敬东,刘跃天,李光华,等. MS-222麻醉光唇裂腹鱼稚鱼的初步研究[J]. 现代农业科技,2014(11):290,294.
[8]Marking L L,Meyer F P. Are better anesthetics needed in fisheries[J]. Fisheries,1985,10(6):2-5.
[9]Cooke S J,Suski C D,Ostrand K G,et al. Behavioral and physiological assessment of low concentration of clove oil anaesthetic for handing and transporting largemouth bass(Micropterussalmoides)[J]. Aquaculture,2004,239(1):509-529.
[10]魏锁成. 用于鱼类的麻醉剂及麻醉管理[J]. 西北民族大学学报(自然科学版),2005,26(1):43-45.
[11]姜 维,王启军,赵 虎,等. MS-222对大鲵麻醉效果的初步观察[J]. 淡水渔业,2014,44(1):94-97.
[12]Oikawa S,Takeda T,Itazawa Y. Scale effects of MS-222 on marine teleost,progyPagrusmajor[J]. Aquaculture,1994,121(4):369-
379.
[13]刘长琳,何 力,陈四清,等. 鱼类麻醉研究综述[J]. 渔业现代化,2007,34(5):21-25.
[14]崔冶建,易有荣,汪 艳,等. 高效液相色谱测定鱼体组织中鱼静安的浓度[J]. 中国生物工程杂志,2003,23(6):84-86.
[15]何小燕,袁显春,潘 志,等. MS-222对布氏鲷幼鱼的麻醉效果研究[J]. 四川动物,2013,32(5):729-733.
[16]Billard R. Effect of some fish anesthetics on gamete survival during artificial insemination of rainbow trout[J]. The Progressive Fish-Culturist,1981,43(2):72-73.
[17]Wagner E,Arndt R,Hilton B. Physiological stress responses,egg survival and sperm motility for rainbow trout broodstock anesthetized with clove oil,tricaine methanesulfonate or carbon dioxide[J]. Aquaculture,2002,211(1/2/3/4):353-366.
