普通黄颡鱼、瓦氏黄颡鱼及其杂种一代遗传特征的微卫星分析
2018-05-10李景芬采克俊公翠萍周志金
李景芬, 采克俊, 公翠萍, 王 曙, 周志金
(1.湖州师范学院,浙江湖州 313000; 2.浙江省湖州市水产技术推广站,浙江湖州 313000)
1 材料与方法
1.1 试验材料
1.2 试验方法
取出无水乙醇固定的鳍条于另一1.5 mL离心管中,挥干乙醇,用小剪刀尽量剪碎鳍条,加入裂解液和蛋白酶K混匀,于55 ℃摇床中消化至溶液澄清透明。再向裂解液中加入RNase于37 ℃水浴锅中保温1 h。然后按传统的酚、三氯甲烷、异戊醇法提取基因组DNA。用1.2%琼脂糖凝胶电泳检测DNA的纯度和完整性,用紫外分光光度计检测质量浓度,并稀释至50 ng/μL,存于-20 ℃冰箱中待用。
微卫星引物序列参照文献[7],由生工生物工程(上海)股份有限公司合成,引物信息见表1。PCR反应体系总体积25 μL:10×Buffer 2.5 μL,dNTP 1 μL,引物2 μL,50 ng/μL DNA 2 μL,rTaq0.2 μ L,ddH2O 17.3 μL。PCR扩增反应条件:94 ℃ 预变性4 min;94 ℃变性30 s,58~70 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸5 min,4 ℃终止延伸 5 min。PCR扩增产物用12%非变性聚丙烯酰胺凝胶电泳分离,硝酸银染色,数码相机拍照。
利用Popgen 1.32软件统计所有位点的等位基因数、观测杂合度、期望杂合度。利用Cervus 3.0软件分析多态信息含量。利用MEGA 4.0软件构建不同群体的非加权组平均法(unweighted pair-group method with arithmetic means,简称UPGMA)亲缘关系树。

表16个微卫星位点引物序列及退火温度
注:F为正向引物,R为反向引物。
2 结果与分析
2.1 普通黄颡鱼、瓦氏黄颡鱼及杂交黄颡鱼(普通黄颡鱼♀×瓦氏黄颡鱼群体遗传特征
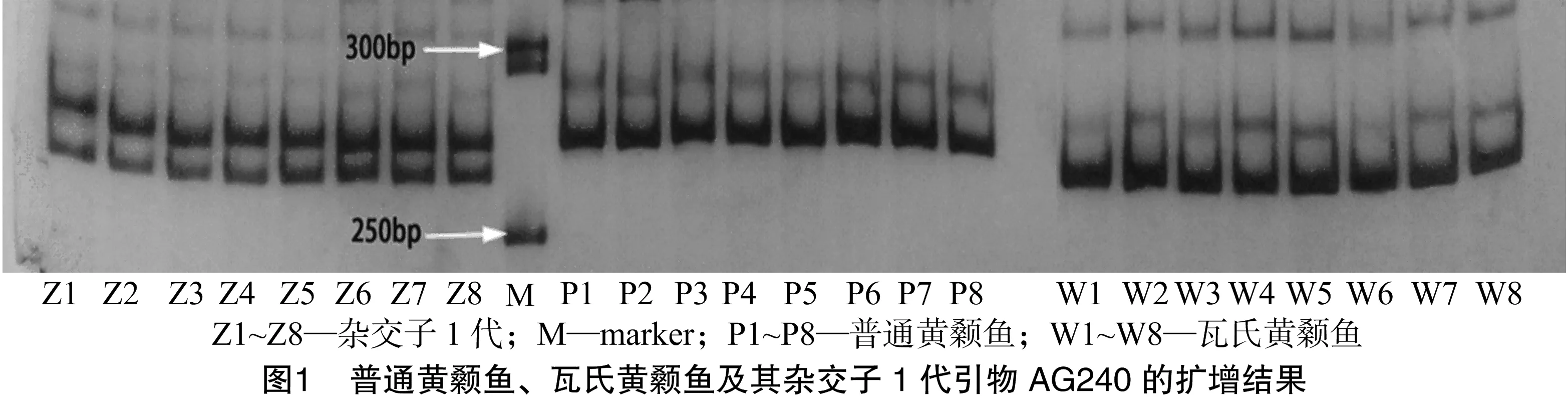
参考文献[7]的9对微卫星引物中,有6对引物(表1)能在普通黄颡鱼、瓦氏黄颡鱼及杂交黄颡鱼中扩增出清晰条带,扩增条带为90~460 bp。其中,引物AG240表现为种间特异性扩增,即普通黄颡鱼与瓦氏黄颡鱼的扩增条带间存在明显差异。杂交黄颡鱼均显示2个条带,表现为亲本普通黄颡鱼与瓦氏黄颡鱼的杂交组合带(图1)。
普通黄颡鱼、瓦氏黄颡鱼、杂交黄颡鱼的等位基因数、观测杂合度、期望杂合度、多态信息含量见表2。6个座位中,每个位点的等位基因数为1~9个。普通黄颡鱼与瓦氏黄颡鱼在6个座位中除了AG240位点表现为单态,其余5个位点均表现为多态。瓦氏黄颡鱼群体有效等位基因数为3.026 8个(表中未列)、观测杂合度为0.349 0、多态信息含量为0.508 0,均高于普通黄颡鱼群体[有效等位基因数为2.008 2个(表中未列)、观测杂合度为 0.109 4、多态信息含量为0.320 3]。
杂交黄颡鱼有效等位基因数(2.863 2个,表中未列)、观测杂合度(0.338 5)、多态信息含量(0.501 2)高于母本普通黄颡鱼,低于父本瓦氏黄颡鱼。
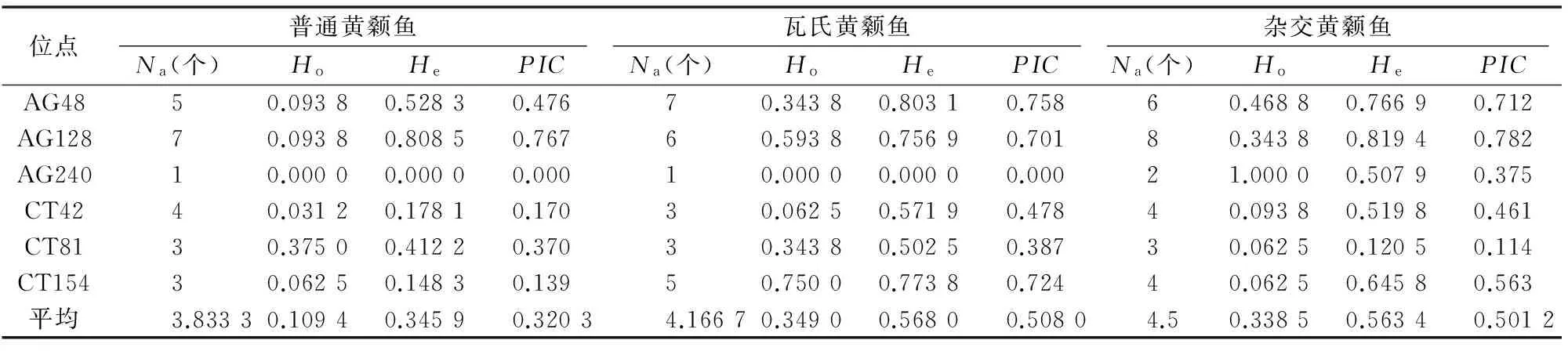
表2普通黄颡鱼、瓦氏黄颡鱼、杂交黄颡鱼的遗传多样性参数
注:Na为等位基因数;Ho为观测杂合度;He为期望杂合度;PIC为多态信息含量。
根据Nei’s上计算所得群体间遗传相似性系数和遗传距离,由表3可以看出,杂交黄颡鱼与母本普通黄颡鱼遗传相似度最高,为0.673 1,遗传距离最小,为0.395 9;杂交黄颡鱼与父本瓦氏黄颡鱼遗传相似度居中,为0.542 1,遗传距离也居中,为0.612 4;父本瓦氏黄颡鱼与母本普通黄颡鱼遗传相似度最小,为0.249 2,遗传距离最大,为1.389 6。
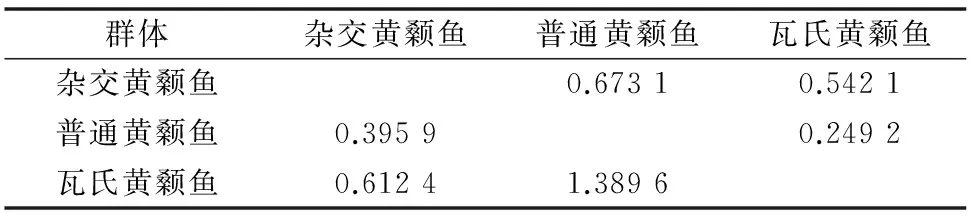
表3普通黄颡鱼、瓦氏黄颡鱼和杂交黄颡鱼
注:对角线以下为遗传距离,对角线以上为遗传相似性系数。
根据群体间的Nei’s遗传距离,采用MEGA 4软件构建普通黄颡鱼、瓦氏黄颡鱼和杂交黄颡鱼群体间的亲缘关系UPGMA树(图2),可见杂交黄颡鱼(zjh)和母本普通黄颡鱼(pth)先聚为一支,再与父本瓦氏黄颡鱼(wsh)聚合。

2.2 微卫星位点亲子代间遗传传递
采用PopGene32软件对普通黄颡鱼、瓦氏黄颡鱼及其杂交1代群体基因条带进行统计、分析。由表4可以看出,普通黄颡鱼群体的基因型为1~9种,瓦氏黄颡鱼群体的基因型为1~9种,杂交子1代的基因型为1~14种。从各个微卫星位点看,杂交子1代的基因型种类与父本瓦氏黄颡鱼相当或略丰富(除去CT154位点),且普遍比母本普通黄颡鱼基因型种类丰富。
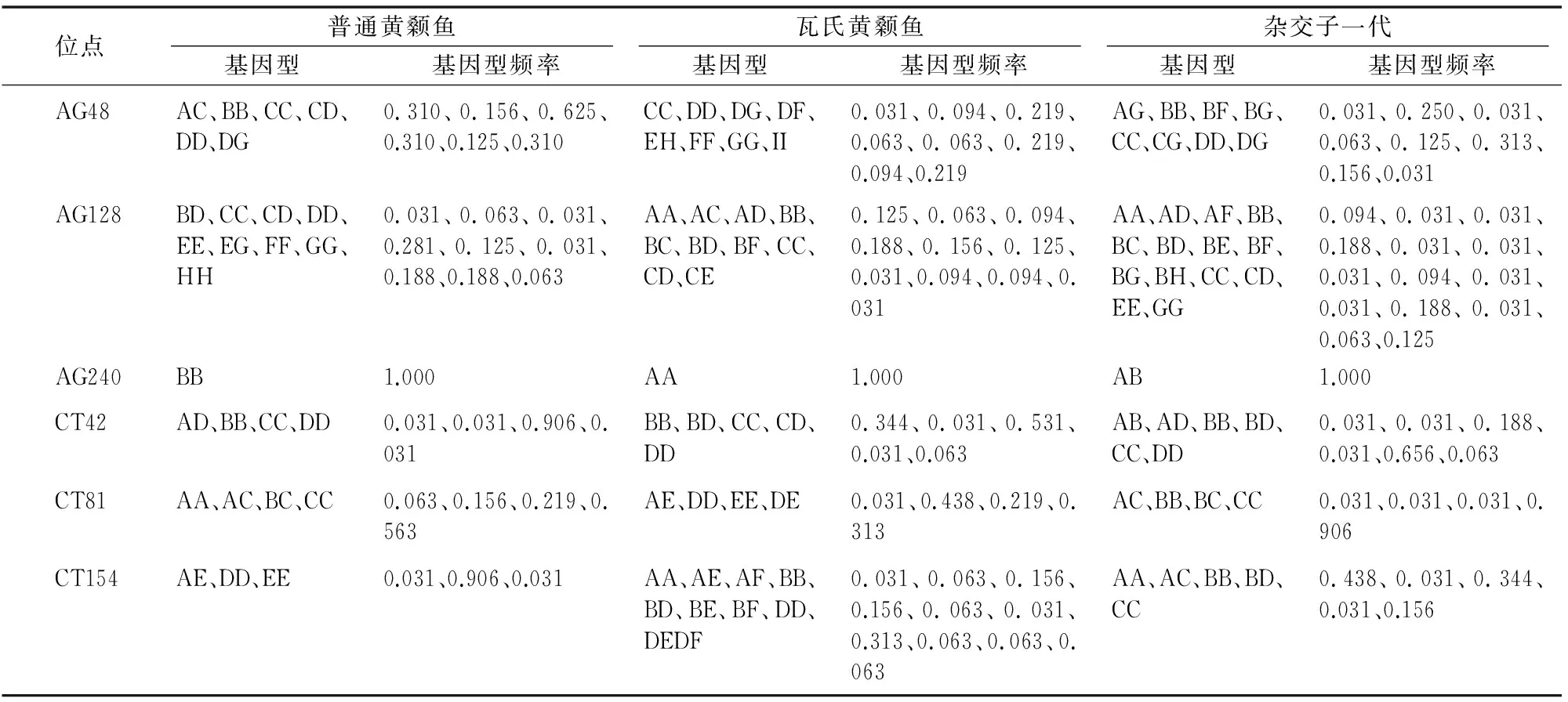
表4普通黄颡鱼、瓦氏黄颡鱼及其杂交1代中基因型频率分布
注:A、B、C、D、E、F、G、H、I代表等位基因。
3 讨论与结论
3.1 普通黄颡鱼、瓦氏黄颡鱼及杂交黄颡鱼群体遗传多样性
3.2 种质资源鉴定
种质资源鉴定对探明物种和遗传资源有很重要的意义,是一项非常基础性的工作。传统的形态学特征作为鉴别依据在有些情况下很困难[12],如黄颡鱼属的不同种鱼在形态上很相似,很难区别,尤其是处于早期生活史阶段的鱼苗及幼鱼。用同工酶法容易受到自然环境的影响[13],而利用DNA分子标记则很少受到自然环境的限制,具有较高多态性的RAPD方法增加了种内和种间鉴定的可行性[14-15]。赵文学等采用RAPD方法对4种黄颡鱼进行了鉴定,筛选出6个引物可以用来准确鉴别黄颡鱼属的4种鱼类[10]。本研究采用SSR方法对普通黄颡鱼、瓦氏黄颡鱼和它们的杂种1代进行了遗传多样性分析,筛选出1个引物(AG240)可以准确鉴别这3种鱼。
参考文献:
[1]胡大雁,周志金,朱 强,等. 杂交黄颡鱼和普通黄颡鱼抗鲇鱼爱德华氏菌病能力的评价[J]. 科学养鱼,2016(11):54-55.
[2]王明宝,陈 强,陈耀炳,等. 黄颡鱼与瓦氏黄颡鱼杂交技术研究[J]. 现代农业科技,2012(24):273-273,278.
[6]唐忠林,周国勤,茆健强,等. 黄颡鱼与瓦氏黄颡鱼的规模化杂交繁殖[J]. 江苏农业科学,2016,44(10):303-305.
[7]吴勤超,梁宏伟,李 忠,等. 黄颡鱼微卫星标记的筛选及三个野生群体的遗传结分析[J]. 生物技术通报,2010(3):154-159.
[8]赵哲霞,蒋 珊,王滨花,等. 黄颡鱼属SSR分子鉴定及其遗传多样性[J]. 南昌大学学报(理科版),2014,38(5):498-501.
[9]肖调义,张学文,章怀云,等. 洞庭湖四种黄颡鱼基因组DNA遗传多样性的RAPD分析[J]. 中国生物工程杂志,2004,24(3):84-89.
[10]赵文学,杨 星,彭 智,等. 黄颡鱼属物种的RAPD分子鉴定及杂种遗传分析[J]. 水生生物学报,2006,30(1):101-106.
[11]Botstein D,White R L,Skolnick M,et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. The American Journal of Human Genetics,1980,32(3):314-331.
[12]Briolay J,Galtier T,Brito R M,et al. Molecular phylogeny of Cyprinidae inferred from cytochrome b DNA sequences[J]. Molecular Phylogenetics and Evolution,1998,9(1):100-108.
[13]Caccone A,Allegrucci G,Fortunato C,et al. Genetic differentiation within the European see bass(D.labrax)as revealed by RAPD-PCR assays[J]. Journal of Heredity,1997(88):316-324.
[14]Williams J G,Kubelik A R,Livak K J,et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucleic Acids Research,1990,18(22):6531-6535.
[15]Haymer D S,McInnis D O. Resolution of populations of the Mediterranean fruit fly at the DNA level using random primers for the polymerase chain reaction[J]. Genome,1994,37(2):244-248.
