播期对藜麦农艺性状及产量的影响*
2018-05-10任永峰杨亚东王志敏赵沛义
任永峰, 梅 丽, 杨亚东, 王志敏**, 赵沛义, 高 宇
播期对藜麦农艺性状及产量的影响*
任永峰1,2, 梅 丽3, 杨亚东1, 王志敏1**, 赵沛义2, 高 宇2
(1. 中国农业大学农学院 北京 100193; 2. 内蒙古农牧业科学院 呼和浩特 010031; 3. 北京市农技推广站 北京 100029)
藜麦具有较高的营养价值和广泛的适应性, 近年来在内蒙古地区进行了引种种植, 且种植面积逐年扩大。阴山北麓农牧交错区降雨少、蒸发量大、气候条件复杂, 限制了藜麦的引种和生物学特性研究。为了深入探讨播种时间对藜麦生长发育的影响和藜麦适宜播期对地区气候条件的响应, 于2014—2015年在阴山北麓区进行藜麦播期研究的基础上, 于2016年设置10个播期处理S1—S10(早播: S1—S3, 4月18—28日; 常规: S4—S7, 5月3—18日; 晚播: S8—S10, 5月23日—6月2日), 调查不同播期下藜麦的生长、生理及产量。结果表明: 1)该地区藜麦成熟所需生长季≥10 ℃积温为2 112~2 214 ℃, 灌浆至成熟期积温≥344.2 ℃, 藜麦大田生育期为114~150 d, S10处理(6月2日播种)没有满足该条件籽粒不能正常成熟; 2)早播处理营养生长和生殖生长阶段均长于常规和晚播处理, 分别多出7.8~14.4 d和9.0~17.8 d; 3)处理S1—S5干物质积累量和叶面积指数较高, 其中S2(4月23日)干物质量、叶面积指数均最高, 与常规处理和晚播处理间均呈极显著差异; 4)藜麦开花期存在光合午休现象, 处理S2(4月23日)光合性能表现较强, 光合速率、气孔导度和蒸腾速率均显著高于其他处理; 5)各处理中单株籽粒重和产量均为S2(4月23日)处理最高, 与常规和晚播处理间呈极显著差异, S2处理产量比产量最低的S9(5月28日)处理高2.87倍; 6)通过对不同播期间降雨和积温气象因子分析发现, 积温是影响阴山北麓藜麦生长发育和产量形成的重要气象因子, 积温主要通过调节灌浆至成熟期小穗数和单穗重来影响产量。因此, 早播有利于藜麦前期干物质量和叶面积形成, 增加灌浆期—成熟期积温, 促进籽粒养分积累, 获得较高的生物产量和经济系数, 具有较大的增产潜力。本试验表明阴山北麓区藜麦种植的适宜播期为4月中旬—5月上旬, 应合理安排播期, 重视积温对藜麦生长发育及产量形成的影响, 尤其应重视生育后期低温的制约, 是保证藜麦大面积推广的重要措施。
藜麦; 播期; 生育期; 干物质积累量; 叶面积指数; 产量
藜麦(Willd)被人们称为“假谷物”, 在南美洲大陆具有几千年的栽培历史[1]。至今,在安第斯山沿麓地区广泛种植, 如玻利维亚、厄瓜多尔、秘鲁、阿根廷和智利等地[2]。藜麦籽粒具有较高的营养价值, 受到了人们的广泛关注[3-5]。藜麦籽粒淀粉含量约为53.5%~69.2%[6]、蛋白含量高达14%~ 16%[7-9], 与小麦(L.)相近[10]。藜麦籽粒富含组氨酸和赖氨酸等必需氨基酸, 其中, 赖氨酸含量达2.4~7.8 g∙(100g)-1(蛋白)[11]。此外, 藜麦籽粒膳食纤维为1.3~6.1 g∙(100g)-1(籽实), 维生素B2、B6和叶酸含量明显高于小麦, VC含量为4.0~16.4 mg∙(100g)-1(干物质)[12], 还富含钙、铁、镁、铜和锌等矿物质[13]。联合国粮食及农业组织(FAO)将藜麦选定为“21世纪保证粮食安全主要作物之一”, 并将2013年定为“国际藜麦年”。
藜麦适应环境能力较强, 能够适应盐碱[14-18]、寒冷[19]和干旱[20-21]等恶劣环境。一方面, 藜麦具有丰富的营养价值和较强的生态适应性。另一方面, 国际藜麦市场需求量和价格持续增加。藜麦在世界各地区的引种栽培面积逐年扩大。藜麦在美国、加拿大、印度、英国、丹麦、希腊、意大利和其他欧洲国家等多个不同气候地区都被成功引种和种植[22]。近年来, 在我国西北地区也兴起了藜麦的种植热潮。2011年开始在甘肃、山西、青海等地成功引种种植[23], 2014—2015年在内蒙古地区进行引种, 并获得成功[24], 但藜麦的适宜播期及生物学特性尚未明确。本试验根据内蒙古阴山北麓区积温和降雨情况, 结合藜麦生长季积温水平, 选取了10个播期, 研究了各播期下藜麦不同生长阶段表观形态特征和经济产量。旨在为藜麦新品种的引种和大面积种植提供理论参考, 并为藜麦育种及抗逆性研究提出了新思路。
1 材料与方法
1.1 试验地概况
试验于2016年4月至9月在农业部野外观测试验站武川站(111°31¢E, 41°14¢N)进行。该试验站地处阴山北麓农牧交错带, 位于内蒙古自治区中部地区, 属半干旱温带大陆性季风气候。海拔1 576 m, 年降水量300~350 mm, 年蒸发量高达1 850 mm, 年平均气温2.7 ℃, 无霜期110 d左右。地形以缓坡丘陵为主, 土壤以栗钙土、灰褐土、石质土为主, 沙性较重。
藜麦生育期内降雨总量为335.4 mm, 降雨集中在6—7月。生育期积温为2 455.8 ℃, 高温天气出现在7月至8月。藜麦全生育期内日平均气温和降雨量如图1所示。试验前0~20 cm土壤碱解氮、速效磷和速效钾分别为53.4 mg·kg-1、11.5 mg·kg-1和147.0 mg·kg-1, 有机质含量为22.9 g·kg-1。
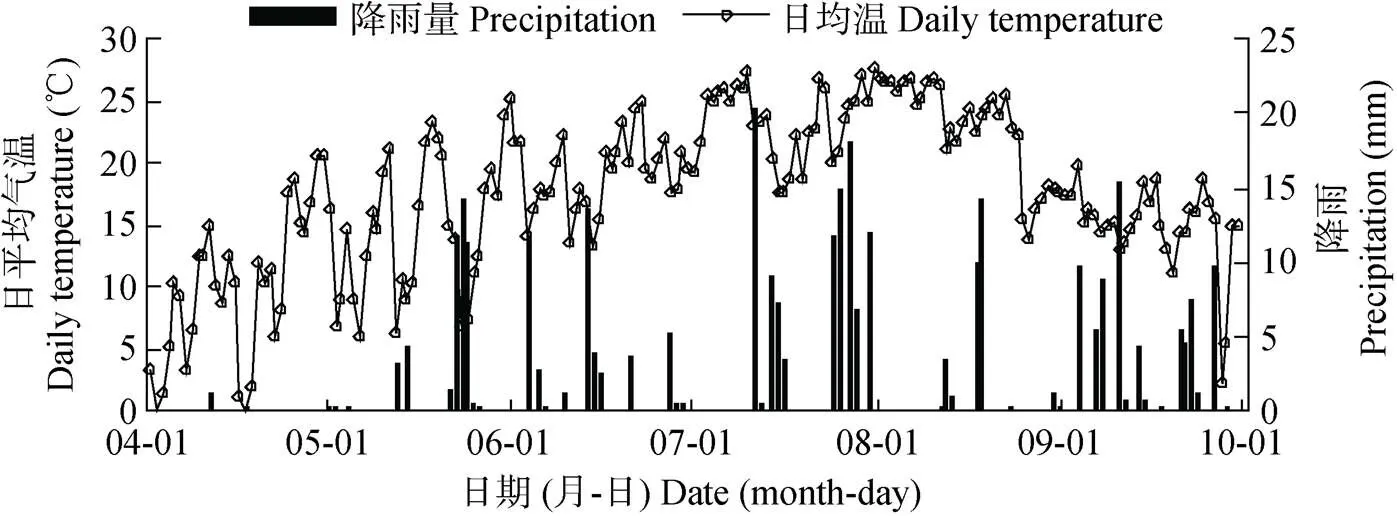
图1 研究区藜麦生育期日平均气温和降雨量
2014—2015年内蒙古地区在乌兰察布市凉城县、四子王旗和呼和浩特市武川县上秃亥乡等地开始引种种植, 规模较大的企业有益稷生物有限责任公司, 种植规模在2016年达到100 hm2, 平均产量为3 000 kg∙hm-2。本试验于2014—2015年5月3—13日播种藜麦, 9月15—20日收获, 2014年产量为2 008.8 kg∙hm-2, 2015年为2 362.5~5 106.3 kg∙hm-2。
1.2 试验设计
2014—2015年藜麦成功在阴山北麓农牧交错带引种试种成功的基础上[24], 2016年设置了10个播期,包括早播: 4月18日(S1)、4月23日(S2)、4月28日(S3); 常规: 5月3日(S4)、5月8日(S5)、5月13日(S6)、5月18日(S7); 晚播: 5月23日(S8)、5月28日(S9)、6月2日(S10)。小区面积为30 m2(5 m×6 m), 3次重复。供试藜麦品种为‘旱藜1号’, 由中国农业大学引进, 自选品系。
为保证良好的土壤墒情, 播种3 d前灌底墒水, 保证各播期0~100 cm土体土壤墒情一致。播前先开沟8~10 cm, 撒施基肥, 施肥量为450 kg·hm-2, 肥料为硫酸钾复合肥(N-P2O5-K2O=13-17-15), 购于内蒙古齐华矿业有限责任公司。将肥料掩埋后播种, 播种方式为穴播, 每穴4~5粒种子, 播深4~5 cm, 穴距25 cm, 行距50 cm, 播后覆土2 cm, 用脚沿播种行轻踩镇压。出苗后间苗, 每穴1株, 实际留苗数45 000株·hm-2。在分枝期灌水1次, 灌水量为300 m3·hm-2。9月15—20日(藜麦叶片80%枯黄并有部分开始脱落, 为藜麦完熟期)进行收获测产。
1.3 测定指标与方法
1.3.1 生育时期观测
根据藜麦生育过程生理及形态特征的变化, 参照Jacobsen和Sosa-Zuniga等[25-26]相关研究, 将藜麦一生(生育期)重新划分为7个生育时期(表1)。分别为播种、苗期、分枝期、显穗期、开花期、灌浆期和成熟期。记录各生育时期具体日期, 以50%植株达到此时期生育进程为依据。
1.3.2 植株干物质积累和单株叶面积
藜麦出苗后每小区选择株型和生育进程一致的植株50株进行挂牌标记, 分别于苗期、分枝期、显穗期、开花期、灌浆期和成熟期测定植株干物质量和单株叶面积, 每个生育时期每小区取5株。单株叶面积测定: 采用美国LI-COR公司生产的 LI 3000C仪器测定, 测定前将藜麦完全展开叶剪下, 茎叶分开, 剪下的完全展开叶用于叶面积测定, 未展开叶计为茎成分。单株干物质量测定: 将用于叶面积测定后的叶片和茎秆在105 ℃下杀青0.5 h, 80 ℃烘12 h至恒重后称量。
1.3.3 光合性能测定
利用美国LI-COR公司生产的LI-6400便携式光合系统分析仪, 于藜麦开花期测定标记植株近顶穗叶片光合性能, 包括净光合速率[μmol(CO2)·m-2·s-1]、气孔导度[mol(H2O)·m-2·s-1]、胞间CO2浓度[μmol(CO2)·mol-1]和蒸腾速率[mmol(H2O)·m-2·s-1]。选择晴朗无云天气每2 h测定一次(测定时间为9:00—17:00)。
1.3.4 产量测定
在藜麦叶片80%枯黄并有部分开始脱落时(完熟期)进行收获测产, 每小区取5株分别进行脱粒, 测定单穗籽粒重, 计算产量=平均单穗籽粒重´实际留苗数(45 000株·hm-2)´损失率(该试验中主要为茎秆倒伏和侧枝折断, 田间统计损失率平均为60%)。
1.4 数据分析
叶面积指数计算: 单株叶面积(1.3.2中测得)´实际留苗数(45 000株·hm-2)/单位土地面积, 其中单位土地面积为1 hm2。

表1 藜麦生育进程及形态特征
时间列为播种后天数(d)。The column of time is days after sowing (d).
产谷阈值计算: 单株干物质重()和单株籽粒重()进行回归分析得出回归方程=+,为回归方程系数,为常数, 当=0时, 求得值即为产谷阈值。
用Microsoft Excel 2016进行数据计算和处理和绘图, 用SPSS 16.0进行数据的差异显著性检验和相关性分析。
2 结果与分析
2.1 不同播期下藜麦生育期的差异
由于藜麦在生殖生长阶段同时伴随着形态建成, 不能将生殖生长和营养生长阶段明显分割, 本文定义藜麦营养生长阶段为播种至显穗期, 生殖生长阶段为开花期至成熟期。早播处理(S1—S3)营养生长阶段为90~97 d, 生殖生长阶段为48~57 d; 常规处理(S4—S7)营养生长阶段为82~89 d, 生殖生长阶段为41~48 d; 晚播处理(S8—S10)营养生长阶段为79~80 d, 生殖生长阶段为35~38 d (表2)。
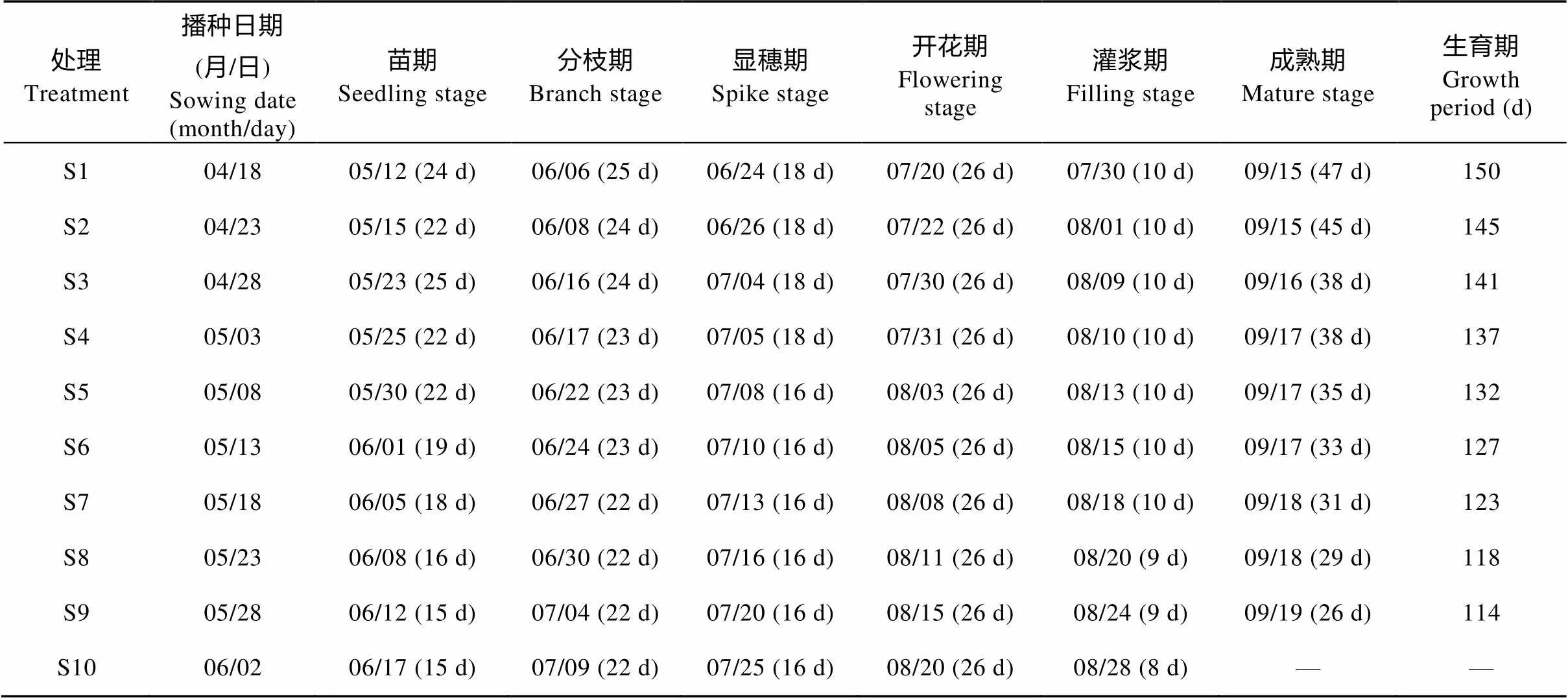
表2 不同播期处理下藜麦生育期及持续时间
括号外数字为生育期时间(月/日), 括号内数字为相邻生育时期间隔天数。Number out bracket is time of the growth stage in form of ‘month/day’, number in bracket is the days between two growth stages.
不同播期下生育时期经历日数差异较大的为播种—苗期和灌浆—成熟期两个阶段。播种—苗期阶段时长顺序为S3>S1>S2/S4/S5>S6>S7>S8>S9/S10, 灌浆—成熟期阶段时长顺序为S1>S2>S3/S4>S5> S6>S7>S8>S9, 总体均表现为早播长于常规和晚播。早播处理较常规和晚播处理两个阶段平均分别多3.4~8.4 d和9.0~15.8 d。另外, 早播处理营养生长和生殖生长阶段长于常规和晚播处理, 分别多7.8~14.4 d和9.0~17.8 d。
由表3可知, 播期与生育时期持续时间呈极显著负相关, 即随着播期的推迟, 藜麦生育时期总体呈缩短趋势, 其中, 播期与开花期无显著相关关系; 播期与积温在成熟期呈极显著负相关, 在灌浆期呈显著性负相关, 在分枝期呈显著正相关, 在开花期呈极显著正相关, 全生育期呈极显著负相关。即随着播期推迟, 全生育期积温呈减少趋势, 且各生育时期中灌浆至成熟期影响最为明显, 其次为开花至灌浆期。
由不同播期处理藜麦生育期情况可知, 除晚播处理S10植株不能正常成熟, 未能完成其整个生育周期外, 其他9个播期处理均能够完成整个生育周期。处理(S1—S9)藜麦大田生育期为114~150 d, 生育期内积温为1 990.3~2 395.4 ℃, 灌浆期至成熟期积温为344.2~812.1 ℃(表4)。处理S10灌浆期起始于8月28日, 9月10日左右易遇平均10 ℃低温(图1), 植株养分积累变缓, 生长受抑制, 不能正常灌浆和成熟。
2.2 不同播期下藜麦叶面积指数(LAI)动态变化
由表5可知, 不同播期处理下苗期—成熟期藜麦群体叶面积指数变化均呈“缓慢增加—指数增加—缓慢增加”趋势。苗期—显穗期藜麦主要以生根和主茎叶片形态构建为主, 显穗—成熟期藜麦主茎叶片继续生长的同时侧枝叶片数量及大小也快速增加, 表现为叶面积指数增加速率为整个生育期内最大。不同播期处理间叶面积指数表现为早播>常规>晚播, 其中处理S2在全生育期内叶面积指数均表现为最高, 该处理各生育时期叶面积指数分别为0.110 m2·m-2、0.248 m2·m-2、0.587 m2·m-2、1.592 m2·m-2、1.970 m2·m-2和2.458 m2·m-2, 苗期S2处理与S3、S4和S5间叶面积指数无显著性差异, 与其他处理间呈极显著差异; 分枝期, S2处理与S1处理间无显著差异, 与其他处理间呈极显著差异; 显穗期至成熟期, 不同处理间叶面积指数差异变大, S2处理与其他处理间差异均呈极显著水平。
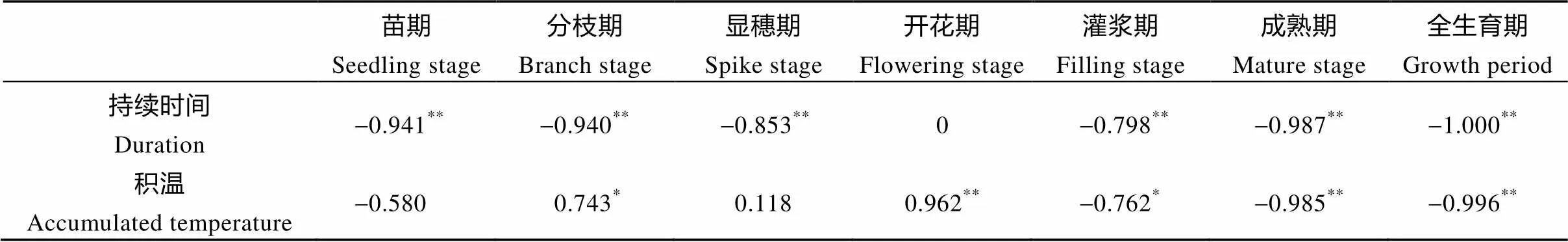
表3 播期与生育期持续时间及积温相关关系
*、**分别表示在0.05和0.01水平显著相关。* and ** indicate significant correlation at 0.05 and 0.01 probability levels, respectively.
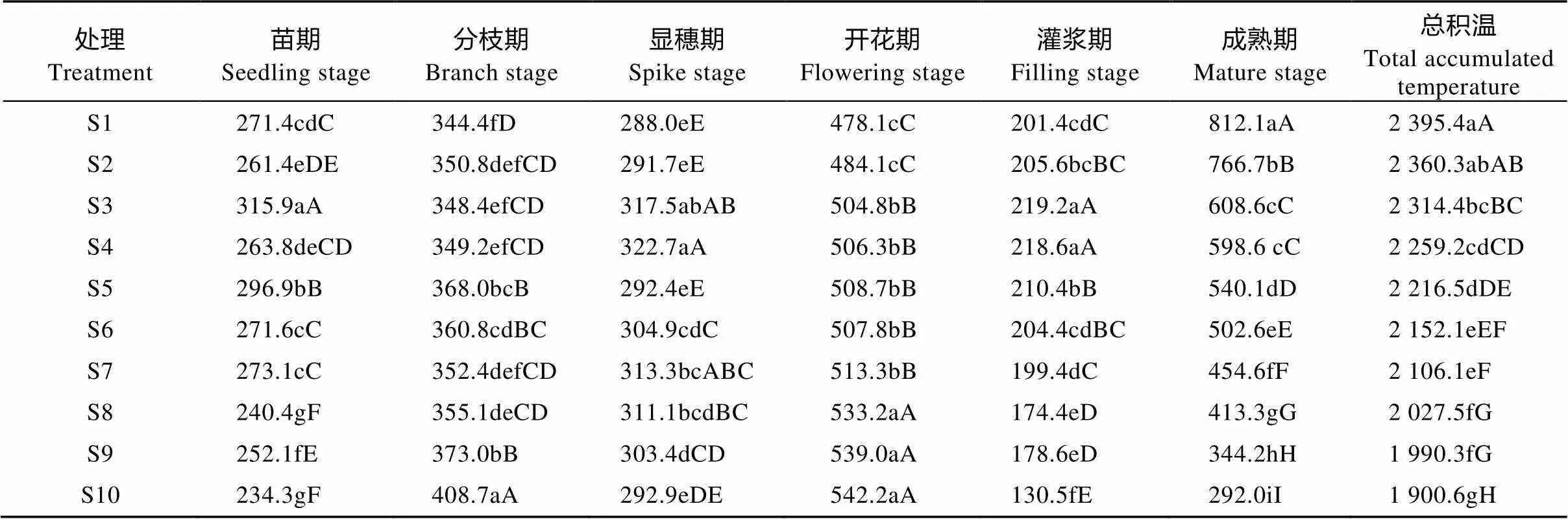
表4 播期对藜麦生育期积温的影响
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。同列不同小写和大写字母分别表示0.05和0.01水平差异显著。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively. In the same column, different lowercase and capital letters mean significant differences at 0.05 and 0.01 levels, respectively.
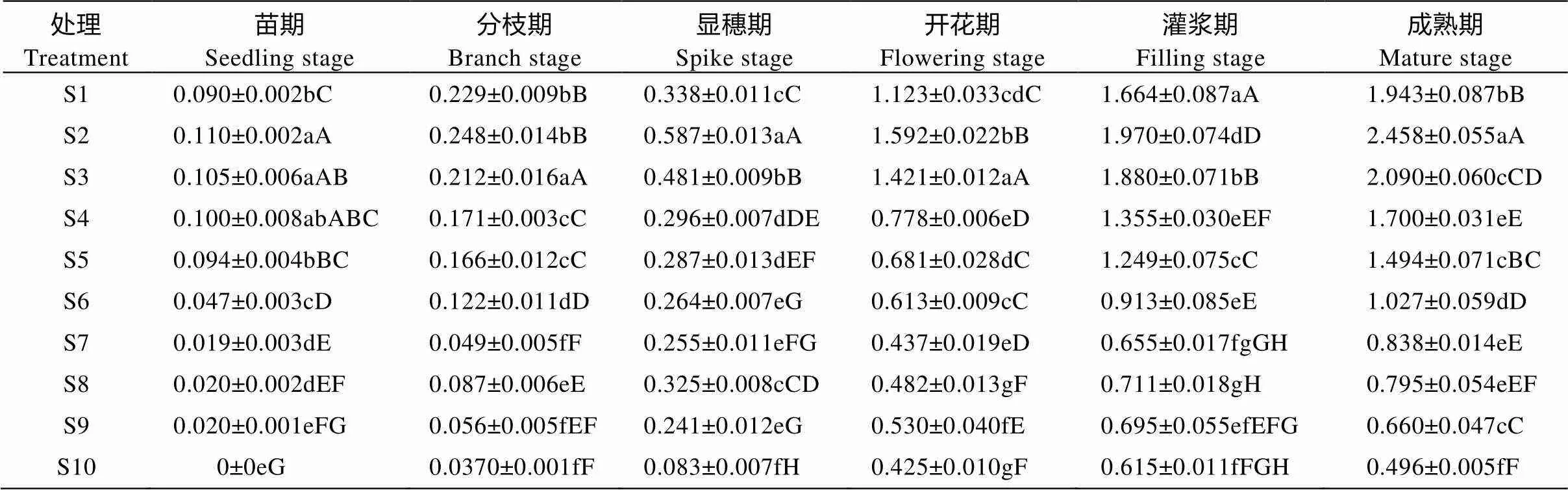
表5 播期对藜麦群体叶面积指数的影响
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。同列不同小写和大写字母分别表示0.05和0.01水平差异显著。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively. In the same column, different lowercase and capital letters mean significant differences at 0.05 and 0.01 levels, respectively.
2.3 不同播期下藜麦干物质量积累动态
由图2可知, 处理S1—S10中, 苗期至成熟期干物质积累量呈增加趋势, 且在开花期—灌浆期干物质量增加速率最大, 呈指数增加, 至成熟期达到峰值。同一测定时期下, 处理S1(4月18日)—S5(5月8日)干物质积累量较高, 其中S2干物质量表现为最高; 各生育期S2处理干物质量与其他处理间呈极显著差异, 其干物质量分别为191.1 kg·hm-2、536.3 kg·hm-2、1 097.3 kg·hm-2、2 404.5 kg·hm-2、6 985.1 kg·hm-2和8 811.3 kg·hm-2。从表6可知, 显穗—成熟期, S1和S3间干物质量无显著性差异, 表明在S2播期基础上推迟5 d播种对藜麦干物质量积累均无明显影响; 除开花期外, 其他时期S4与S5、S6、S7处理间干物质量呈极显著差异, 开花期无显著差异, 表明播期对花期干物质积累量影响不明显; S5与S6在苗期、灌浆期和成熟期呈极显著差异, 其他时期无明显差异; S8与S10在苗期—开花期干物质量呈极显著差异, 灌浆—成熟期无明显差异; S9与S10在苗期和分枝期干物质量无显著性差异, 显穗—成熟期呈极显著差异。
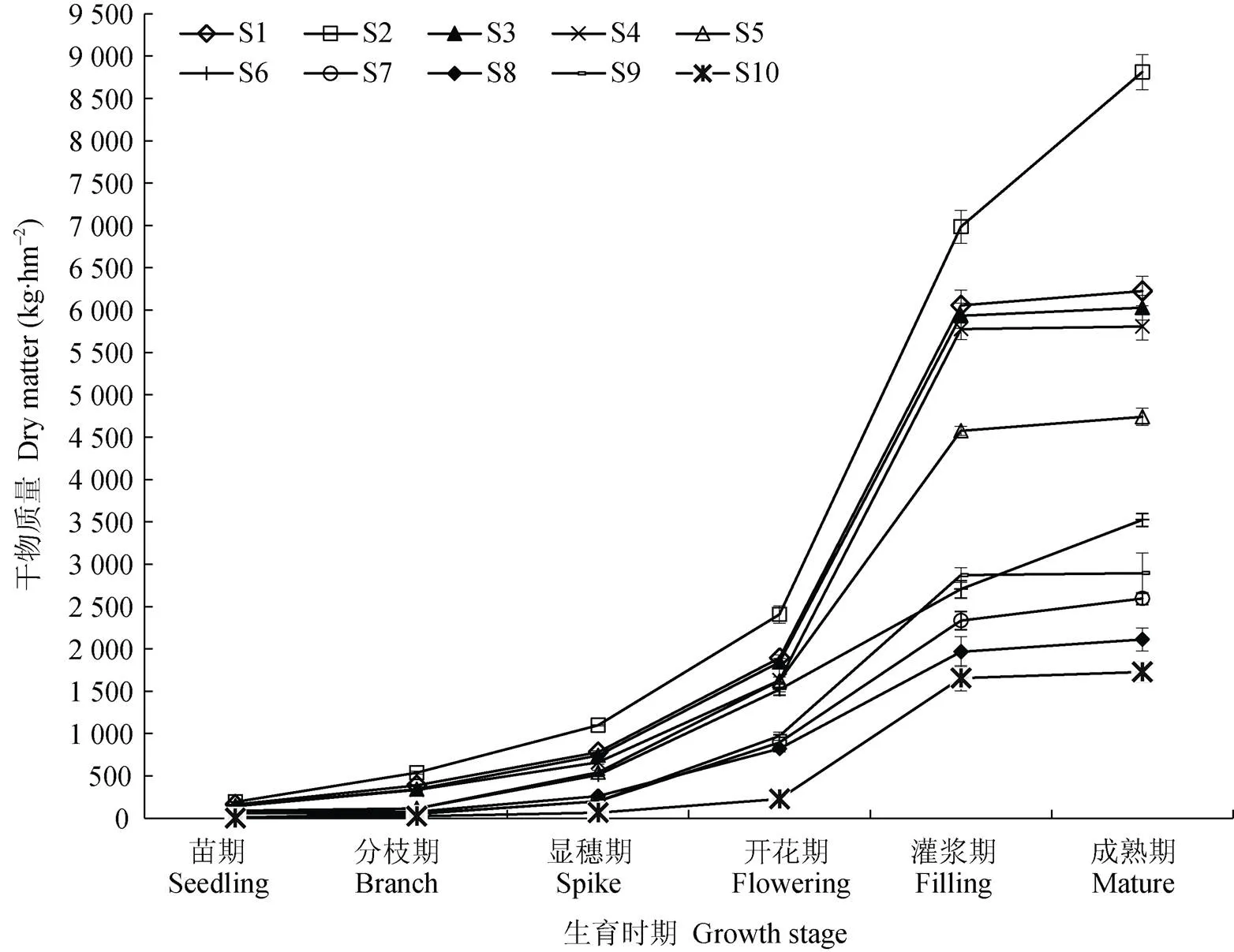
图2 不同播期处理下藜麦群体干物质积累动态
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively.
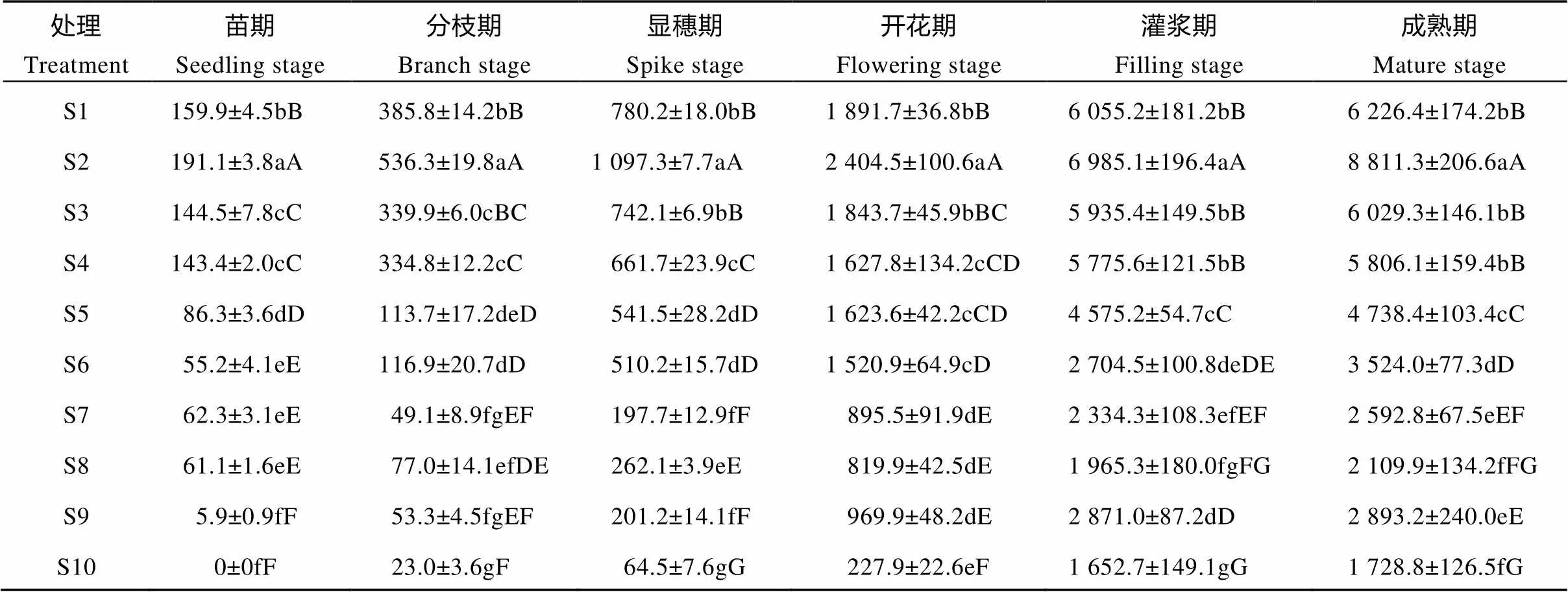
表6 播期对藜麦群体干物质积累量的影响
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。同列不同小写和大写字母分别表示0.05和0.01水平差显著异。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively. In the same column, different lowercase and capital letters mean significant differences at 0.05 and 0.01 levels, respectively.
藜麦生育期内干物质量与叶面积指数显著相关(=0.951,<0.01)。对S1—S10各处理全生育期干物质量与叶面积指数的回归分析可知, 藜麦干物质积累量与叶面积指数相关性较强(2=0.903 4)(图3)。藜麦从长叶至成熟期, 随着LAI的增加, 其叶片光合产物也随之增加, 干物质量增大。该试验条件下, 灌浆期叶面积指数最大处理为S2, LAI为2.46, 曲线仍处于上升趋势, 说明植株仍未达到最适LAI, 至成熟期叶片开始枯黄前, 叶面积的增加仍对干物质量的积累具有重要贡献。藜麦在生长后期生殖生长仍伴随着营养生长, 主要表现为穗的灌浆和近穗部叶片的增加, 叶面积增加主要贡献为近穗部叶片数量的增加。所以可以通过延长植株叶片持绿时间来提高叶片制造养分能力, 进而来提升藜麦植株产量潜力。
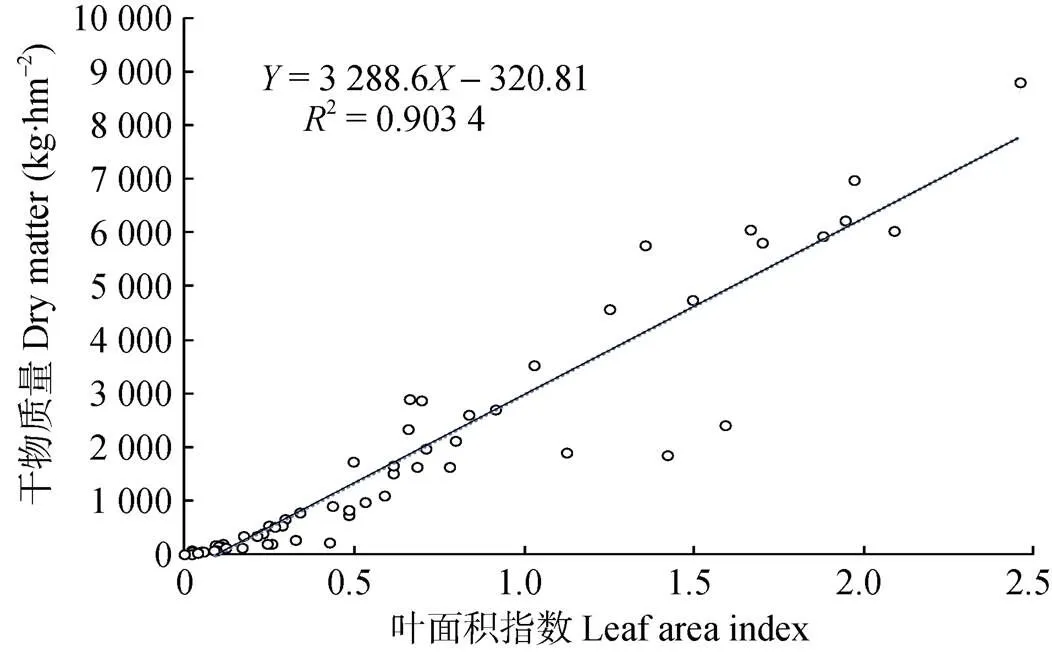
图3 藜麦叶面积指数与干物质量积累的关系
2.4 不同播期下藜麦花期光合性状的差异
作物叶片净光合速率、蒸腾速率、气孔导度、胞间CO2等是表征光能利用能力和效率的重要指标[27]。本试验于藜麦开花期测定标记植株的近顶穗叶片光合性能可知(图4), 不同播期下叶片净光合速率呈双峰曲线变化, 峰值分别出现在11:00和15:00, 13:00出现低谷, 此时为一天中气温最高的时候, 高温影响了藜麦叶片净光合速率。净光合速率表现为早播>常规播期>晚播, 其中早播处理中净光合速率最大为S2, 常规处理中最大为S4, 早播S2较常规播期S4处理高3.22~6.32 μmol(CO2)·m-2·s-1; S2与其他处理间呈显著性差异。
气孔导度与净光合速率变化趋势基本一致, 呈双峰曲线变化, 但其第2个峰值推迟到17:00, 主要由于气孔导度13:00后气温降低后逐渐增加。各处理中气孔导度表现为处理S2最高, 较常规播期S4高0.01~0.26 mol(H2O)·m-2·s-1, 除早晨9:00外, S2处理净光合速率与其他处理间呈显著性差异。
胞间CO2浓度日变化为单峰曲线, 峰值出现在13:00, 此时光呼吸作用最强, 不同处理下S10处理的胞间CO2浓度值在9:00—13:00较高, 与其他处理间呈显著性差异, 较常规播期S4处理高59.10~ 79.63 μmol(CO2)·mol-1, 随后明显降低。主要由于光合作用增强, CO2同化作用加强, 胞间CO2浓度降低。由光合作用的气孔限制因素s=1-i/a(a为大气CO2浓度,i为胞间CO2浓度)可知[28], 该试验条件下叶片在13:00C值升高,s值降低, 表明此时影响光合作用主要为非气孔因素, 可能由于中午气温较高, 使参与光合作用相关酶活性降低从而造成了叶片光合作用下降。
蒸腾速率表现为单峰曲线变化, 峰值出现在11:00, 该时间气温较高, 植株蒸腾速率最大, 处理S2表现为最高, 与其他处理间呈显著性差异, 较常规播期处理S4高1.52~2.51 mmol(H2O)·m-2·s-1。13:00由于气温已经达到最大值, 气孔大部分关闭, 水分和CO2等交换减弱, 蒸腾速率下降。至17:00, 蒸腾速率变化不明显, 由于此时气温下降, 气孔开度变化较小, 此时S2处理蒸腾速率仍表现为最高, 且与其他处理间差异显著。
2.5 不同播期下藜麦产量性状的差异
由表7可知, S1、S2、S3处理下藜麦的单株籽粒重和产量与其他处理间呈极显著差异, S1和S2间单株籽粒重无显著性差异, S1、S2与S3间呈极显著差异; S4和S5间单株籽粒重无显著性差异, S7与S8、S8与S9间单株籽粒重无显著性差异; 除S7和S8处理间产量差异不显著外, 其他处理间产量均呈极显著差异。单株籽粒重和产量均为S2处理最高, 分别为151.78 g·株-1和4 097.97 kg·hm-2; 其次为S1和S3, 最低处理为S9, S2处理实测产量较S9处理高287.38%。常规处理S4、S5和S6间产量均表现为极显著差异, 且S4—S6中处理S4的单株籽粒重和产量均为最高, 其次为S5处理和S6处理, 处理S4较S6高30.91%。因此, 早播处理较常规处理平均增产89.85%, 晚播处理较常规处理平均减产39.07%。
对单株干物质重()和单株籽粒重()进行分析, 回归方程为=0.416 6-13.152 (2=0.972 1) (图5)。式中0.416 6为藜麦经济系数, 当=0时(即单株籽粒重为0),=31.31 g, 此时31.31 g是藜麦植株能够生产籽粒的最小干物质重, 为藜麦的产谷阈值。因此, 在生产中提高单株干物质重是提高藜麦经济产量的基础, 且在保证一定干物质量的基础上提高单株籽粒产量, 能够显著提高藜麦经济系数, 有利于获得较高的籽粒产量。本试验中S2(4月23日)处理干物质量和单株籽粒产量均最高, 具备高产潜力。
2.6 藜麦产量与积温及降雨量相关性分析
由藜麦单株籽粒产量与生育期积温及降雨量进行多元回归分析(图6)可知, 全生育期积温与藜麦单株籽粒产量呈显著相关(2=0.84*), 而降雨量与藜麦单株籽粒产量间无直接相关关系。因此, 该试验条件下, 积温为主要影响因素, 且得出积温()与单株产量()线性回归方程为=0.23-411.59。进一步对藜麦单位面积产量与其各生育时期积温进行相关性(图7)分析可知, 藜麦单位面积产量(6)与灌浆—成熟期的阶段积温(6)相关性最大, 且呈极显著正相关关系, 回归方程为6=7.046-1 648.40 (2=0.96**), 即该时期随着积温缩短, 藜麦产量表现为降低趋势。结合播期与积温相关性(表3)分析结果, 随播期推迟, 藜麦产量水平总体表现为降低趋势, 灌浆—成熟期积温也呈缩短趋势。因此, 在藜麦生育期积温满足≥1 789 ℃且灌浆—成熟期积温大于344 ℃条件下(表4), 才开始形成籽粒产量, 即≥0, 也说明其播种—成熟需要生育期≥114 d籽粒才能够完全成熟。
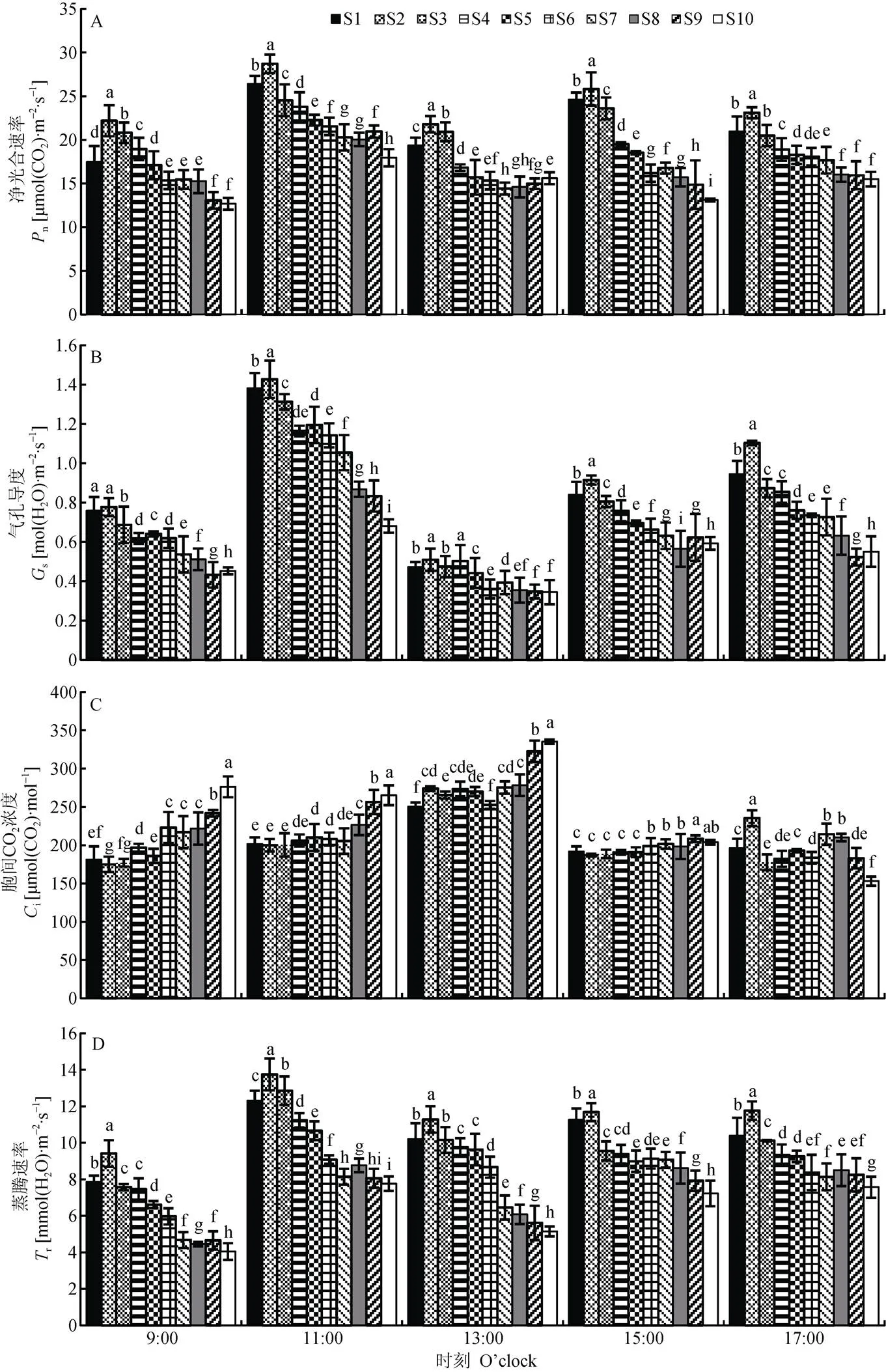
图4 播期对藜麦开花期叶片光合速率(A)、气孔导度(B)、胞间CO2浓度(C)和蒸腾速率(D)的影响
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。不同小写字母表示同一测定时间不同播期间在0.05水平差异显著。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively. Different lowercase letters mean significant differences at the same measuring time among sowing dates treatments at 0.05 level.
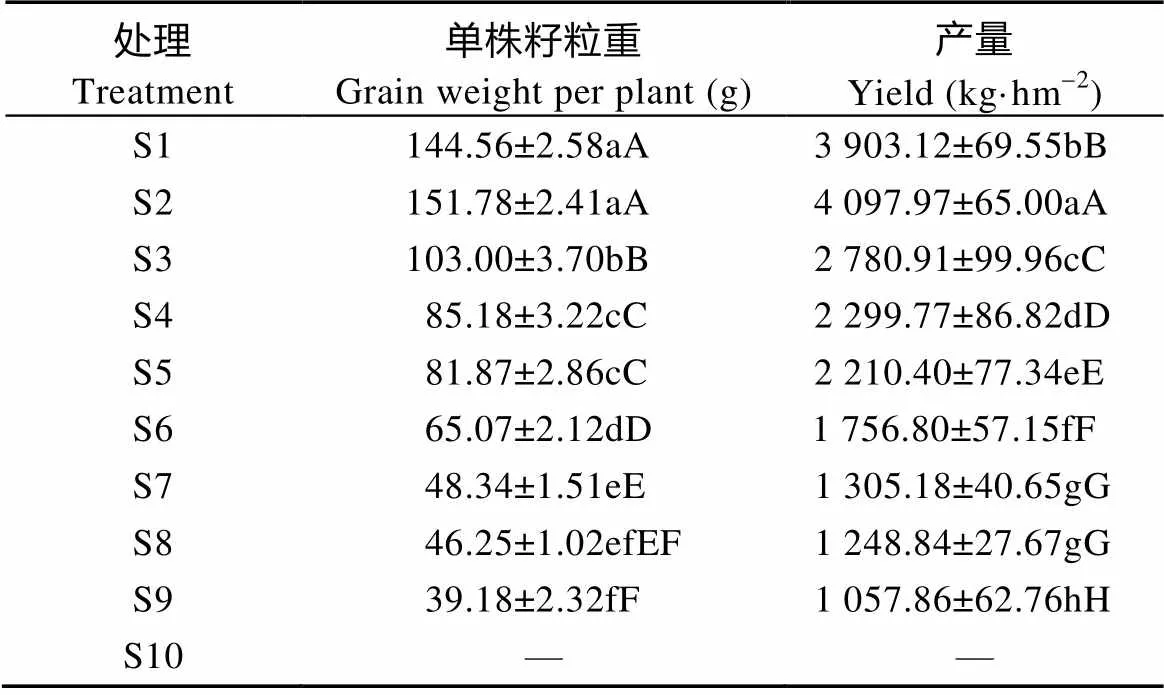
表7 播期对藜麦产量性状的影响
S1—S10表示播种日期, 分别为4月18日、4月23日、4月28日、5月3日、5月8日、5月13日、5月18日、5月23日、5月28日、6月2日。同列不同小写、大写字母分别表示0.05和0.01水平差异显著。S1-S10 indicate the sowing dates, which are 18 Apr., 23 Apr., 28 Apr., 3 May, 8 May, 13 May, 18 May, 23 May, 28 May, 2 Jun., respectively. In the same column, different lowercase and capital letters mean significant differences at 0.05 and 0.01 levels, respectively.
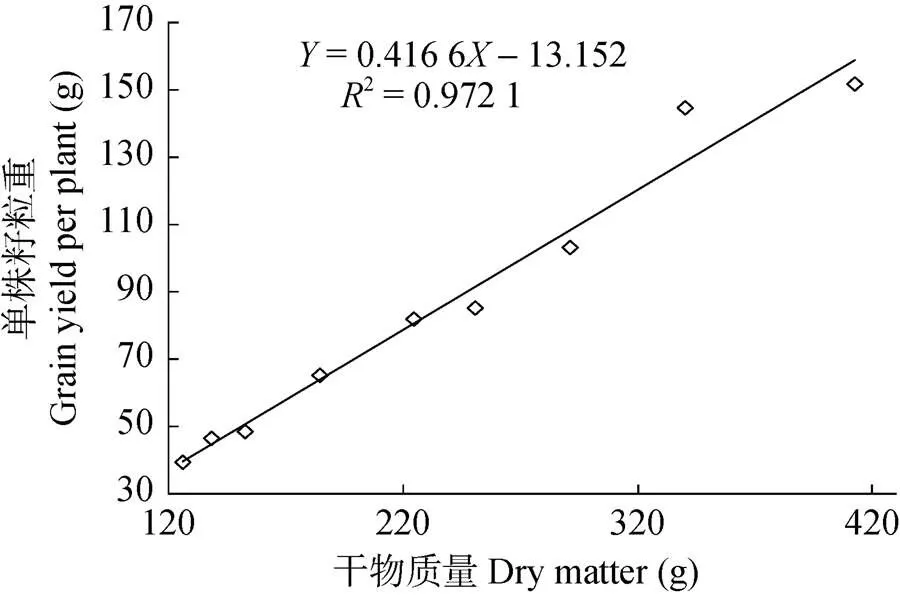
图5 藜麦单株籽粒重与干物质积累相关性分析
3 讨论
3.1 气候因子对藜麦生长发育的影响
藜麦对光周期、温度等环境因子较敏感[29]。前人研究表明, 高原作物品种对温度较敏感, 平原作物品种对光周期较敏感[30-31]。对藜麦低温适应性研究表明, 藜麦在2 ℃开始发芽, 低于该温度将延迟发芽, 其生长和开花适宜温度应该在8~28 ℃[32]; 薛庆禹等[33]、刘明等[34]认为玉米(L.)生育后期高温促进了生长。藜麦生长发育除受温度和光照影响外, 还受水分条件限制。De Santis等[35]研究表明, 干旱气候条件下藜麦营养生长阶段和整个生育期明显缩短, 生育期约108~135 d。以上研究与本试验研究结果一致, 不同播期中, 藜麦生长发育主要限制因子为积温, 早播积温明显高于常规和晚播, 播期与积温在成熟期和灌浆期呈显著负相关, 在分枝期和开花期呈显著正相关, 全生育期呈极显著负相关; 随着播期推迟, 灌浆—成熟期积温降低,晚播处理S10成熟期积温较低, 不能满足籽粒灌浆成熟需求, 且易遇早霜, 导致产量形成受阻。
3.2 藜麦生态表型划分标准
藜麦在不同海拔和纬度地区引种, 其生育期差异较大, 目前关于藜麦生育时期的划分尚未明确, Jacobsen[25]研究表明北欧地区藜麦生育期长约109~182 d, 且将其共分为21个阶段, 其中主要为种子发芽、显穗阶段、开花阶段和成熟阶段, 但缺少对分枝期植株形态变化的具体描述。Sosa-Zuniga等[26]采用BBCH系统代码将藜麦生育期划分为9个主要阶段, 同时配有图释, 进一步完善了藜麦生育期划分, 但缺乏根茎叶片同伸关系描述。本试验研究以时间为坐标, 结合藜麦各生长阶段形态特征及变化对其主要生育时期进行划分和描述, 将藜麦一生划分为7个主要生育时期, 并指出了各时期的主要特征, 进一步明确了本地区藜麦在不同播期下植株生长发育情况。
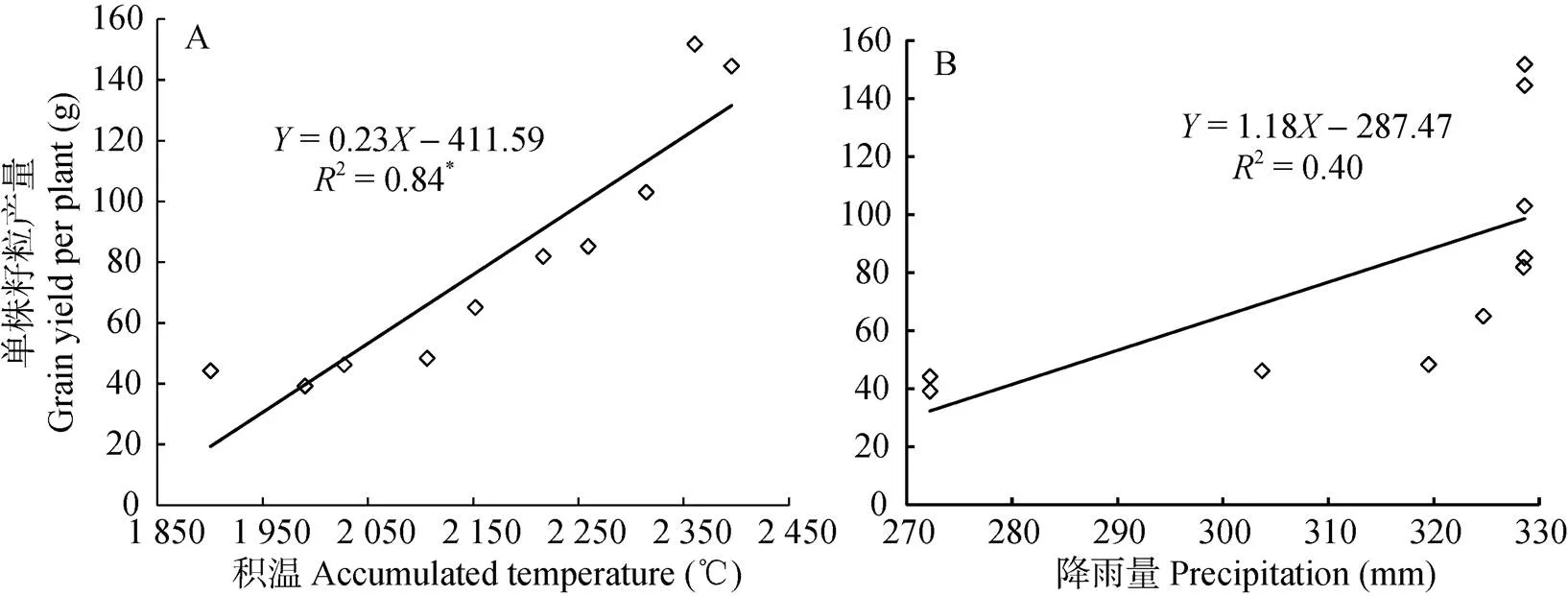
图6 藜麦单株籽粒产量与生育期积温(A)及降雨量(B)相关关系
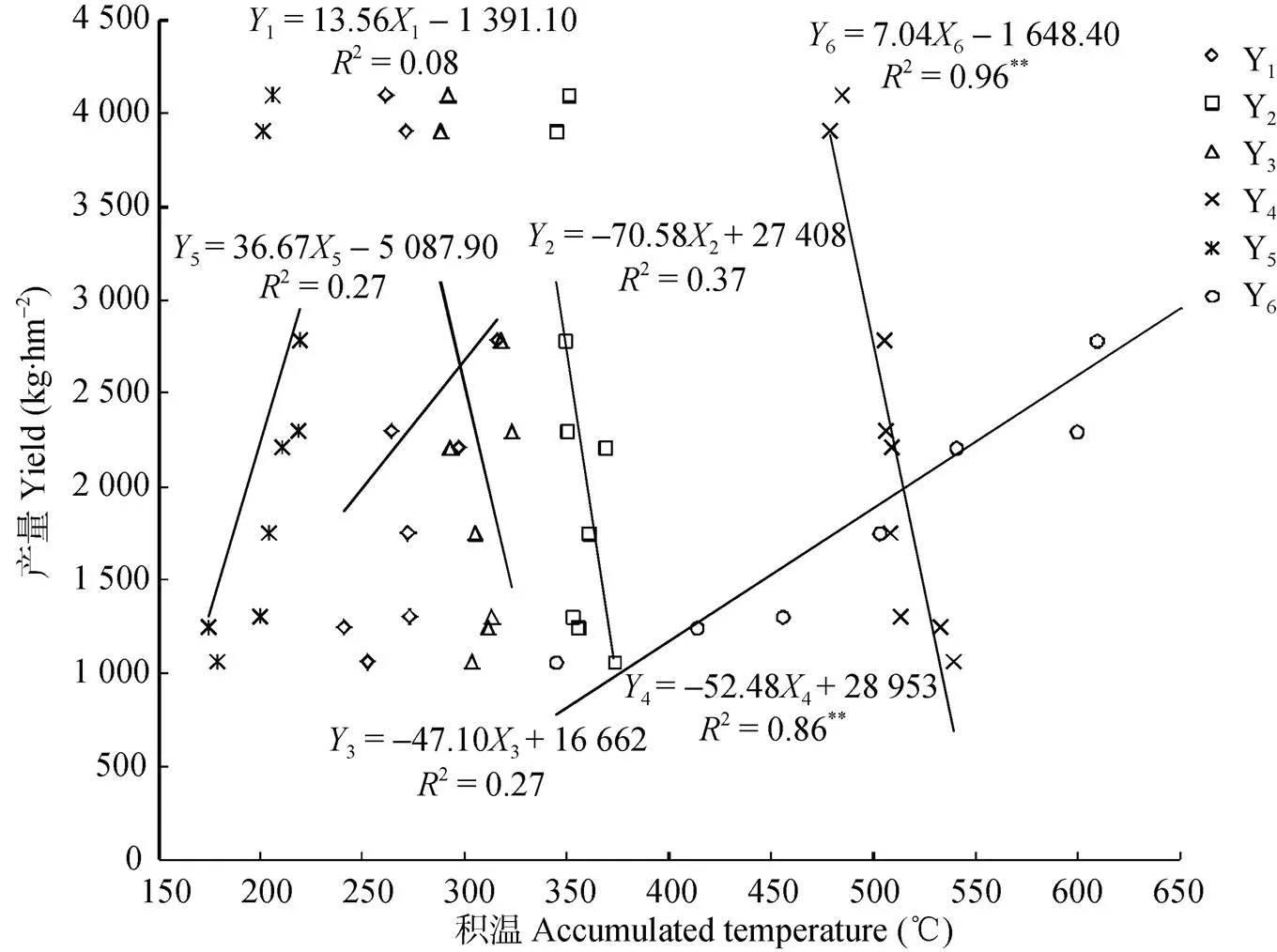
图7 藜麦产量与各生育时期积温相关关系
1、1, …,6、6分别为苗期、分枝期、显穗期、开花期、灌浆期和成熟期积温和成熟期产量; **表示极显著相关(≤0.01)。1and1, …,6and6respectively mean accumulated temperatures at seedling, branch, spike, flowering, filling and maturity stages and yield of quinoa. ** indicates significant correlation at 0.01 level.
3.3 不同播期对藜麦生育时期持续时间、叶面积指数及干物质量的影响
获得作物高产的必要条件之一是选择适宜播期[36], 不同播期直接影响其生育时期持续时间、叶面积指数和干物质量积累。相关研究表明, 随着播期的推迟, 作物各生育时期持续时间均呈缩短趋势[34,37], 温度变异是主要原因[38], 这与本试验研究结果一致。播期与生育时期持续时间呈极显著负相关, 播期与灌浆—成熟期积温呈显著负相关, 由于播期不同, 藜麦不同生育阶段的积温和降雨量有所差异, 随着播期推迟成熟期持续时间短, 积温减少明显, S10(6月2日)播期导致积温不足, 不能正常成熟。
研究表明, 同一生育时期内不同播期处理间LAI差异显著, 且在植株生长关键时期后差异表现较明显[39]。本试验结果表明以藜麦显穗期为界, 至成熟期, 藜麦不同播期间LAI差异变大, 且处理间呈极显著水平, 主要原因为显穗期前, 积温水平较低, 藜麦主要进行快速根系下扎和茎秆增高生长, 叶片生长相对缓慢; 显穗期后, 相对前期积温短时间内显著增加, 藜麦根系、茎秆开始增粗, 主枝、侧枝叶腋处叶片开始发生, LAI呈指数增加, 增加速率为整个生育期内最大, 处理间差异显著, 表现为早播高于常规和晚播。
不同播期叶面积指数动态与干物质量积累趋势一致, 均表现为早播[S1(4月18日)—S3(4月28日)]较常规和晚播高, 其中S2(4月23日)干物质量表现为最高, 且与其他处理间呈极显著差异。一方面是由于植株生长进程中前30~33 d内, 植株主要以生根为主, 根茎长度比约为2∶1, 处理S1—S3利用早播时间延长了植株根系的生长, 易形成壮苗, 有利于以后干物质的积累; 另一方面, S1—S3播期处理在苗期经过了抗寒锻炼, 白天温度高, 有利于根系和地上部生长, 光合作用强烈, 夜间气温降10 ℃以下, 呼吸作用弱, 有利于植株内糖分等碳水化合物养分积累, 干物质量增加明显。
3.4 不同播期对藜麦光合性能的影响
有关播期对藜麦光合性能影响的研究较少, 而关于播期对玉米、小麦、水稻(L.)等作物研究较多。肖尧等[40]研究表明, 早播能够促进春玉米开花期叶片获得较高的净光合速率、气孔导度、蒸腾速率, 而胞间CO2浓度变化趋势与之相反; 裴雪霞等[41]在播期对小麦旗叶光合特性的影响一文中指出, 随着播期推迟, 小麦旗叶光合速率呈先增加后减小的趋势; 霍中洋等[42]研究表明, 早播能够保证前期物质生产量适宜, 促进中后期干物质积累及合理分配, 增强干物质运转效率和抽穗后叶片光合生产能力。本试验结果表明早播能够提高开花期藜麦叶片净光合速率、气孔导度及蒸腾速率, 降低胞间CO2浓度。另外, 藜麦净光合速率和气孔导度在一天中均呈双峰曲线变化, 在中午13:00出现低谷, 叶片存在午休现象, 其原因可能是由于此时气温较高导致光合作用相关酶活性降低而引起的非气孔因素。因此, 在今后研究中将补充光合作用相关酶活性的测定, 进一步完善不同播期对藜麦光合性能影响的机理。
3.5 不同播期对藜麦产量的影响
藜麦产量构成因素为分枝数、小穗数、单穗重及侧枝成穗率[43], 分枝数及侧枝成穗率与其品种特性、施肥和灌水等措施密切相关, 而小穗数与单穗重是产量构成因素中最易受环境影响的因子。小穗数和单穗重形成过程中要经历小花分化、授粉受精、籽粒形成和发育等一系列过程, 期间都有可能受到外界不利环境的影响。播期推迟使得外界环境发生了较大变化, 作物的适应性也随之发生改变。Jacobsen等[32]研究结果表明藜麦花芽分化期对低温最为敏感, 在开花期遇低温2 h, 藜麦减产近66%; 王亚梁等[44]研究表明, 穗分化期间有效积温增加, 昼夜温差扩大, 光辐射增强, 有利于籼稻穗分化期干物质积累和颖花分化。本试验表明积温条件是决定藜麦籽粒产量的主要因子, 播期的推迟使得各生育时期积温产生了差异, 早播和常规播种处理下开花至灌浆期为7月下旬—8月上旬, 其小花分化时期,积温较晚播增加, 有利于其正常开花授粉; 延迟播种, 容易在花期或灌浆期遇低温等环境引起花粉失活导致籽实败育和后期灌浆不充分等现象, 最终造成藜麦产量低下。另外, 产谷阈值反映了藜麦植株产量形成所需的基础干物质量条件, 是否提前达到藜麦产谷阈值也是影响其产量的主要原因之一, 在满足藜麦生长所需一定积温条件下, 早播处理优于常规播种和晚播处理, 干物质积累量提早达到了其形成籽粒的产谷阈值水平, 在完成形态建成后, 利用较长时间灌浆—成熟期进行产量构建, 是其高产的主要原因。播种太早或太晚都不是最优播种时间选择, 一方面播种过早, 虽然满足了积温条件, 但是藜麦发芽和出苗易受0 ℃以下低温危害, 易造成缺苗断垄, 也可导致营养生长用时较长, 产量下降, 产量表现为S1(4月18日) 播期对藜麦各生育期持续时间和积温影响显著。随着播期的推迟生育期变短, 灌浆—成熟阶段差异最大, 早播较常规播种灌浆—成熟期长约9 d, 晚播较常规播种灌浆—成熟期短约6 d。不同播期间叶面积指数和干物质量均表现差异显著, 同一生育时期S2(4月23日)播期下干物质积累量和叶面积指数表现为最高, 播期推迟积温减少使植株生长延缓是导致该现象的主要原因, 且与灌浆—成熟期积温相关性最大。藜麦开花期存在光合午休现象, S2处理下光合性能表现较强, 光合速率、气孔导度和蒸腾速率与其他处理间呈显著差异。各处理中单株籽粒重和产量均为S2处理最高, 与常规和晚播处理间呈极显著差异, 其单株籽粒重和产量分别为151.78 g·株-1和4 097.97 kg·hm-2。因此, 在年降水量300~350 mm的阴山北麓区, 灌水受限条件下, 积温为限制藜麦产量性状的主要因子, 适宜早播能够促进藜麦高产, 但应注意倒春寒的危害。 [1] RISI J C, GALWEY N W. Chenopodium grains of the Andes: Inca crops for modern agriculture[J]. Advances in Applied Biology, 1984, 10: 145–216 [2] DILLEHAY T D, ROSSEN J, ANDRES T C, et al. Preceramic adoption of peanut, squash, and cotton in Northern Peru[J]. Science, 2007, 316(5833): 1890–1893 [3] REPO-CARRASCO R, ESPINOZA C, JACOBSEN S E. Nutritional value and use of the Andean crops quinoa () and Kañiwa ()[J]. Food Reviews International, 2003, 19(1/2): 179–189 [4] ABUGOCH JAMES L E. Quinoa (Willd.): Composition, chemistry, nutritional, and functional properties[J]. Advances in Food and Nutrition Research, 2009, 58: 1–31 [5] WANG S N, ZHU F. Formulation and quality attributes of quinoa food products[J]. Food and Bioprocess Technology, 2016, 9(1): 49–68 [6] MUNDIGLER N. Isolation and determination of starch from amaranth () and quinoa ()[J]. Starch-Stärke, 1998, 50(2/3): 67–69 [7] KOZIOŁ M J. Chemical composition and nutritional evaluation of quinoa (Willd.)[J]. Journal of Food Composition and Analysis, 1992, 5(1): 35–68 [8] FÖSTE M, ELGETI D, BRUNNER A K, et al. Isolation of quinoa protein by milling fractionation and solvent extraction[J]. Food and Bioproducts Processing, 2015, 96: 20–26 [9] WRIGHT K H, PIKE O A, FAIRBANKS D J, et al. Composition of, sweet and bitterseeds[J]. Journal of Food Science, 2002, 67(4): 1383–1385 [10] NAVRUZ-VARLI S, SANLIER N. Nutritional and health benefits of quinoa (Willd.)[J]. Journal of Cereal Science, 2016, 69: 371–376 [11] DINI I, TENORE G C, DINI A. Nutritional and antinutritional composition of Kancolla seeds: An interesting and underexploited andine food plant[J]. Food Chemistry, 2005, 92(1): 125–132 [12] VILCACUNDO R, HERNÁNDEZ-LEDESMA B. Nutritional and biological value of quinoa (Willd.)[J]. Current Opinion in Food Science, 2017, 14: 1–6 [13] VEGA-GÁLVEZ A, MIRANDA M, VERGARA J, et al. Nutrition facts and functional potential of quinoa (Willd.), an ancient Andean grain: A review[J]. Journal of the Science of Food and Agriculture, 2010, 90(15): 2541–2547 [14] GEISSLER N, HUSSIN S, EL-FAR M M M, et al. Elevated atmospheric CO2concentration leads to different salt resistance mechanisms in a C3() and a C4() halophyte[J]. Environmental and Experimental Botany, 2015, 118: 67–77 [15] KOYRO H W. Effect of salinity on growth, photosynthesis, water relations and solute composition of the potential cash crop halophyte(L.)[J]. Environmental and Experimental Botany, 2006, 56(2): 136–146 [16] HUCHZERMEYER B, KOYRO H W. Salt and drought stress effects on photosynthesis[M]//PESSARAKLI M. Handbook of Photosynthesis. 2nd ed. New York: CRC Press, 2005: 751–777 [17] SALAZAR-PARRA C, AGUIRREOLEA J, SÁNCHEZ-DÍAZ M, et al. Climate change (elevated CO2, elevated temperature and moderate drought) triggers the antioxidant enzymes’ response of grapevine cv. Tempranillo, avoiding oxidative damage[J]. Physiologia Plantarum, 2012, 144(2): 99–110 [18] BOSE J, RODRIGO-MORENO A, SHABALA S. ROS homeostasis in halophytes in the context of salinity stress tolerance[J]. Journal of Experimental Botany, 2014, 65(5): 1241–1257 [19] BOIS J F, WINKEL T, LHOMME J P, et al. Response of some Andean cultivars of quinoa (Willd.) to temperature: Effects on germination, phenology, growth and freezing[J]. European Journal of Agronomy, 2006, 25(4): 299–308 [20] SUN Y, LIU F, BENDEVIS M, et al. Sensitivity of Two Quinoa (Willd.) varieties to progressive drought stress[J]. Journal of Agronomy and Crop Science, 2014, 200(1): 12–23 [21] JENSEN C R, JACOBSEN S E, ANDERSEN M N, et al. Leaf gas exchange and water relation characteristics of field quinoa (Willd.) during soil drying[J]. European Journal of Agronomy, 2000, 13(1): 11–25 [22] BHARGAVA A, SHUKLA S, OHRI D. Genetic variability and interrelationship among various morphological and quality traits in quinoa (Willd.)[J]. Field Crops Research, 2007, 101(1): 104–116 [23] 黄杰, 杨发荣. 藜麦在甘肃的研发现状及前景[J]. 甘肃农业科技, 2015, (1): 49–52 HUANG J, YANG F R. Research and prospect of quinoa in Gansu Province[J]. Gansu Agricultural Science and Technology, 2015, (1): 49–52 [24] 任永峰, 王志敏, 赵沛义, 等. 内蒙古阴山北麓区藜麦生态适应性研究[J]. 作物杂志, 2016, (2): 79–82 REN Y F, WANG Z M, ZHAO P Y, et al. Ecological adaptability of quinoa in northern foot of Yinshan in Inner Mongolia[J]. Crops, 2016, (2): 79–82 [25] JACOBSEN S E. Adaptation of quinoa () to Northern European agriculture: Studies on developmental pattern[J]. Euphytica, 1997, 96(1): 41–48 [26] SOSA-ZUNIGA V, BRITO V, FUENTES F, et al. Phenological growth stages of quinoa () based on the BBCH scale[J]. Annals of Applied Biology, 2017, 171(1): 117–124 [27] 李西文, 陈士林. 遮荫下高原濒危药用植物川贝母()光合作用和叶绿素荧光特征[J]. 生态学报, 2008, 28(7): 3438–3446 LI X W, CHEN S L. Effect of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of[J]. Acta Ecologica Sinica, 2008, 28(7): 3438–3446 [28] 徐俊增, 彭世彰, 魏征, 等.节水灌溉水稻叶片胞间CO2浓度及气孔与非气孔限制[J]. 农业工程学报, 2010, 26(7): 76–80 XU J Z, PENG S Z, WEI Z, et al. Intercellular CO2concentration and stomatal or non-stomatal limitation of rice under water saving irrigation[J]. Transactions of the CSAE, 2010, 26(7): 76–80 [29] BERTERO H D. Response of developmental processes to temperature and photoperiod in quinoa (Willd.)[J]. Food Reviews International, 2003, 19(1/2): 87–97 [30] CURTI R N, DE LA VEGA A J, ANDRADE A J, et al. Adaptive responses of quinoa to diverse agro-ecological environments along an altitudinal gradient in North West Argentina[J]. Field Crops Research, 2016, 189: 10–18 [31] BERTERO H D, KING R W, HALL A J. Photoperiod and temperature effects on the rate of leaf appearance in quinoa ()[J]. Australian Journal of Plant Physiology, 2000, 27(4): 349–356 [32] JACOBSEN S E, MONTEROS C, CHRISTIANSEN J L, et al. Plant responses of quinoa (Willd.) to frost at various phenological stages[J]. European Journal of Agronomy, 2005, 22(2): 131–139 [33] 薛庆禹, 王靖, 曹秀萍, 等. 不同播期对华北平原夏玉米生长发育的影响[J]. 中国农业大学学报, 2012, 17(5): 30–38 XUE Q Y, WANG J, CAO X P, et al. Effect of sowing date and variety on growth and population characteristics of summer maize in North China Plain[J]. Journal of China Agricultural University, 2012, 17(5): 30–38 [34] 刘明, 陶洪斌, 王璞, 等. 播期对春玉米生长发育与产量形成的影响[J]. 中国生态农业学报, 2009, 17(1): 18–23 LIU M, TAO H B, WANG P, et al. Effect of sowing date on growth and yield of spring-maize[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 18−23 [35] DE SANTIS G, D’AMBROSIO T, RINALDI M, et al. Heritabilities of morphological and quality traits and interrelationships with yield in quinoa (Willd.) genotypes in the Mediterranean environment[J]. Journal of Cereal Science, 2016, 70: 177–185 [36] 邢志鹏, 曹伟伟, 钱海军, 等. 播期对不同类型机插稻产量及光合物质生产特性的影响[J]. 核农学报, 2015, 29(3): 528–537XING Z P, CAO W W, QIAN H J, et al. Effect of sowing date on yield and characteristics of photosynthesis and matter production of different types in mechanical transplanted rice[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(3): 528–537 [37] 李国瑜, 丛新军, 陈二影, 等. 积温和降水量对夏谷生长发育的影响[J]. 核农学报, 2018, 32(1): 165–176 LI G Y, CONG X J, CHEN E Y, et al. Effect of accumulated temperature and precipitation on growth of summer-sowing foxtail millet[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(1): 165–176 [38] 郑洪建, 董树亭, 王空军, 等. 生态因素对玉米品种生长发育影响及调控的研究[J]. 山东农业大学学报: 自然科学版, 2001, 32(2): 117–123 ZHENG H J, DONG S T, WANG K J, et al. Effects of ecological factors on maize (L.) growth of different varieties and corresponding regulative measure[J]. Journal of Shandong Agricultural University: Natural Science, 2001, 32(2): 117–123 [39] 张石宝, 李树云, 胡丽华, 等. 播种季节对玉米生长发育及干物质生产和分配的影响[J]. 云南植物研究, 2001, 23(2): 243–250 ZHANG S B, LI S Y, HU L H, et al. The effects of sowing season on growth, development, dry matter production and partition of maize ()[J]. Acta Botanica Yunnanica, 2001, 23(2): 243–250 [40] 肖尧, 熊敏, 丁成龙, 等. 播期对高产春玉米产量及光合特性的影响[J]. 扬州大学学报: 农业与生命科学版, 2014, 35(2): 65–71 XIAO Y, XIONG M, DING C L, et al. Effects of sowing date on yield and photosynthetic characteristics of spring maize under high yield conditions[J]. Journal of Yangzhou University: Agricultural and Life Science Edition, 2014, 35(2): 65–71 [41] 裴雪霞, 王姣爱, 党建友, 等. 播期对优质小麦籽粒灌浆特性及旗叶光合特性的影响[J]. 中国生态农业学报, 2008, 16(1): 121–128 PEI X X, WANG J A, DANG J Y, et al. Characteristics of grain filling and flag leaf photosynthesis of high quality wheat under different planting dates[J]. Chinese Journal of Eco-Agriculture, 2008, 16(1): 121–128 [42] 霍中洋, 姚义, 张洪程, 等. 播期对直播稻光合物质生产特征的影响[J]. 中国农业科学, 2012, 45(13): 2592–2606 HUO Z Y, YAO Y, ZHANG H C, et al. Effect of sowing date on characteristics of photosynthesis and matter production of direct seeding rice[J]. Scientia Agricultura Sinica, 2012, 45(13): 2592–2606 [43] 庞春花, 张紫薇, 张永清. 水磷耦合对藜麦根系生长、生物量积累及产量的影响[J]. 中国农业科学, 2017, 50(21): 4107–4117 PANG C H, ZHANG Z W, ZHANG Y Q. Effects of water and phosphorus coupling on root growth, biomass allocation and yield of quinoa[J]. Scientia Agricultura Sinica, 2017, 50(21): 4107–4117 [44] 王亚梁, 张玉屏, 向镜, 等. 籼稻颖花分化与退化对不同播期温光的响应[J]. 应用生态学报, 2017, 28(11): 3571–3580 WANG Y L, ZHANG Y P, XIANG J, et al. Response ofrice spikelet differentiation and degeneration to air temperature and solar radiation of different sowing dates[J]. Chinese Journal of Applied Ecology, 2017, 28(11): 3571–3580 Effects of sowing time on agronomic characteristics and yield of quinoa* REN Yongfeng1,2, MEI Li3,YANG Yadong1, WANG Zhimin1**, ZHAO Peiyi2, GAO Yu2 (1. College of Agronomy and Biotechnology, China Agricultural University, Beijing 100193, China; 2. Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031, China; 3. Beijing Station for Popularizing Agricultural Technique, Beijing 100029, China) Quinoa is rich in nutrient and has a wide range of adaptability to climatic conditions. In recent years, it was successfully introduced and planted in Inner Mongolia, and the planting area was increasing year after year. There is a little rainfall in the farming-pastoral zone, however, evaporation in the region is excessive and climatic conditions highly complicated in the northern foothills of Yinshan Mountains, which limit research on the introduction and biological characteristics of quinoa. To explore the effects of sowing time on the growth and climatic conditions of quinoa in the northern foothills of Yinshan Mountains, a field experiment was conducted for the period 2014–2016. On the base of the research results of 2014-2015, in 2016, 10 different sowing times were selected (S1–S10) and the treatments divided into three sowing stages — early sowing (S1–S3 for 18–28 April), conventional sowing (S4–S7 for 3–18May) and late sowing (S8–S10 for 23 May to 2 June). The growth, physiological and yield characteristics of quinoa were compared in all the 10 treatments. The results showed that: 1) accumulated temperature of ≥10 ℃ for the whole life cycle of quinoa was 2 112–2 214 ℃,and growth period of quinoa was 114–150 days. 2) Early sowing treatments (S1–S3) had a longer period of vegetative andreproductive growth stages than the conventional (greater by 7.8–14.4 d) and late sowing (greater by 9.0–17.8 d) treatments. 3) Dry matter accumulation and leaf area index in treatments S1–S5 were high, with those in treatment S2 significantly higher than in conventional and late sowing treatments. 4) There was midday depression in quinoa photosynthesis at flowering stage and treatment. S2 had a significantly higher ability in terms of photosynthetic performance. Photosynthetic rate, stomatal conductance and transpiration rate of treatment S2 were respectively 3.22–6.32 μmol(CO2)∙m-2∙s-1, 0.01–0.26 mol(H2O)∙m-2∙s-1and 1.52–2.51 mmol(H2O)∙m-2∙s-1higher than those of other treatments. 5) The highest spike grain weight (151.78 g per plant) and yield (4 097.97 kg·hm-2) were obtained in treatment S2, which were significantly higher than in the other treatments. Yield in treatment S2 was 2.87 times higher than in treatment S9. 6) In terms of quinoa growth and yield, accumulated temperature was a more critical factor than rainfall in the study area. Accumulated temperature affected yield mainly by regulating the number of spikes and single panicle weight from grain-filling stage to maturity stage of quinoa. Therefore, early sowing was beneficial for good biological morphologic development and it increased leaf area index. Accumulated temperature during grain-filling stage of quinoa was needed for high gain yield and economic coefficient. Our results suggested that the optimum sowing time of quinoa was from mid April to early May in the northern foothills of Yinshan Mountains. Sowing time was the most important factor in quinoa production. Accumulated temperature greatly affected growth and yield formation, which required a specific attention in order to avoid low temperature conditions at later growth stages of quinoa. Quinoa; Sowing date; Growth period; Dry matter accumulation; Leaf area index; Yield , E-mail: zhimin206@263.net Sep. 18, 2017; Dec. 26, 2017 10.13930/j.cnki.cjea.170852 S519 A 1671-3990(2018)05-0643-14 王志敏, 主要从事作物栽培及生理研究。E-mail: zhimin206@263.net任永峰, 主要从事旱作农业技术研究。E-mail: renyongfeng@cau.edu.cn 2017-09-18 2017-12-26 * This study was supported by the Science and Technology Project of Beijing Municipal Commission of Rural Affairs and the Young Creative Fund of Agriculture and Animal Husbandry of Inner Mongolia (2015QNJJN09). * 北京市农村工作委员会科技项目和内蒙古农牧业青年创新基金项目(2015QNJJN09)资助 任永峰, 梅丽, 杨亚东, 王志敏, 赵沛义, 高宇. 播期对藜麦农艺性状及产量的影响[J]. 中国生态农业学报, 2018, 26(5):643-656 REN Y F, MEI L, YANG Y D, WANG Z M, ZHAO P Y, GAO Y. Effects of sowing time on agronomic characteristics and yield of quinoa[J]. Chinese Journal of Eco-Agriculture, 2018, 26(5): 643-6564 结论
