无认知功能障碍的终末期肾病患者全脑皮质厚度变化研究
2018-05-10董健卫左卫吴筠凡华克磊虞康惠李国旻
董健卫 左卫 吴筠凡 华克磊 虞康惠 李国旻
终末期肾病(ESRD)通常发生于慢性肾功能衰竭进展至肾功能永久性降低10%的情况下[1]。终末期肾病可以显著增加认知功能障碍、神经功能障碍和精神行为异常等诸多问题的患病风险[2⁃5]。因此,对于尚未出现神经系统症状的终末期肾病患者,检测其脑结构改变,对疾病早期诊断、改善预后和降低病死率至关重要。神经影像学为上述目标的实现提供可能途径,并使得观察终末期肾病相关白质完整性[6⁃8]、灰质体积[9]和功能体系结构[10⁃11]成为可能,上述开创性研究在很大程度上促进临床医师对疾病的理解。然而,从灰质形态学角度看,终末期肾病的神经病理学基础尚不明确。基于体素的形态学分析(VBM)评价灰质形态学特征在脑科学研究中应用广泛,包括皮质厚度、皮质表面积和皮质折叠[12⁃15],值得注意的是,图像平滑程度、配准和标准化模板等因素可以降低VBM法的敏感性[12⁃13]。在本研究中,我们假设终末期肾病患者某些脑区大脑皮质厚度改变,特别是双侧眶额叶皮质、双侧背外侧前额叶皮质(DLPFC)和左侧颞中回[10,12],且肾毒性作用或血液透析时间与大脑皮质厚度改变有关,因此,我们采用Vertex⁃wise法计算终末期肾病患者大脑皮质厚度,以为此类患者灰质形态学改变提供直接证据。
资料与方法
一、临床资料
1.纳入标准 (1)终末期肾病患者的肾小球滤过率(GFR)<15 ml/(min·1.73 m2)或者慢性肾功能衰竭进展至肾功能持续低于自身容量的10%[16⁃17]。(2)受试者简易智能状态检查量表(MMSE)评分≥22分[18]。(3)本研究经广东省第二人民医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)合并精神病或中枢神经系统疾病,如重型颅脑创伤(sTBI)、脑卒中、癫或其他明确病变。(2)合并缺血性疾病,如急性缺血性脑血管病、急性外周动脉闭塞、晚期肝功能衰竭或心功能衰竭。(3)心电图诊断为无症状性冠状动脉缺血。(4)既往有糖尿病病史。(5)既往有物质滥用史,包括药物、酒精或尼古丁。
3.一般资料 (1)终末期肾病组(ESRD组):选择2011年8月-2013年7月在广东省第二人民医院器官移植科住院治疗的终末期肾病患者共38例,均为右利手,由同一位经验丰富的影像科医师双盲对所有患者MRI图像进行排查,剔除3例T2⁃FLAIR成像呈异常高信号的患者,最终纳入35例患者,男性28例,女性7例;年龄18~61岁,平均(37.50±11.30)岁;受教育程度为3~16年,平均为(11.80±3.20)年;病程5~20年,平均(12.50±4.80)年;血液透析时间6~30个月,平均(15.50±6.60)个月;收缩压(SBP)120 ~ 190 mm Hg(1 mm Hg=0.133 kPa),平均(159±19)mm Hg;舒张压(DBP)60~110 mm Hg,平均(90±11)mm Hg;血红蛋白为56~158 g/L,平均为(102.50±23.50)g/L;血清肌酐(Cr)为 80~2030 μmol/L,平均为(838.10±483.60)μmol/L;尿素氮(BUN)为 4.10~30.20 mmol/L,平均为(17.80±8.20)mmol/L;总胆固醇(TC)3.70~9.90 mmol/L,平均(5.10±1.40)mmol/L;血清钾2.90~6.30 mmol/L,平均(4.50±0.90)mmol/L;采用Payne公式[17]校正血清钙6.70~12.30 mmol/L,平均(9.30±1.30)mmol/L;MMSE评分22~30分,平均(26.90±1.90)分。(2)正常对照组:选择同期在我院进行体格检查的健康志愿者共40例,均为右利手,肾功能试验于正常值范围、腹部MRI未见明显异常,男性32例,女性8例;年龄22~58岁,平均为(41.50±10.60)岁;受教育程度6~18年,平均(10.80±2.80)年;MMSE评分26~30分,平均(29.50±0.90)分。两组性别(χ2=0.000,P=1.000)和年龄(t=1.581,P=0.119)比较差异无统计学意义,而终末期肾病患者MMSE评分低于正常对照者且差异有统计学意义(t=4.378,P=0.000)。
二、研究方法
1.头部MRI检查 采用荷兰Philips公司生产的Achieva 1.5T Nova Dual MRI扫描仪,16通道头颈神经血管线圈,梯度场强40 mT/m,扫描序列为三维T1WI(3D⁃T1WI),扫描参数:采用三维磁化准备快速梯度回波(3D⁃MPRAGE)序列,重复时间(TR)为1600 ms、回波时间(TE)2.13 ms、反转时间(TI)为1000 ms,翻转角(FA)9°,扫描视野(FOV)128 mm ×128 mm,矩阵256×224,平面分辨率1 mm2×1 mm2,扫描层厚1 mm、层间距为零,共扫描176层,范围覆盖颅底至颅顶全部脑组织。
2.图像处理 本研究采用基于表面形态学(SuBM)的顶点分析法,通过FreeSurfer软件包5.3.0版[19⁃21](http://surfer.nmr.mgh.harvard.edu/)重 建 大 脑皮质表面并测量大脑皮质厚度。(1)重建大脑皮质表面:①剥除头皮,采用FreeSurfer软件包5.3.0版中混合区域/表面变形程序提取大脑皮质。②自动分割获得脑脊液、白质和深部灰质结构。③横断面切割双侧大脑半球和皮质下结构,生成切割面。④修复分割内孔。⑤通过灰白质分界线的1个三角形网格和覆盖灰白质分界线的网格变形以形成灰白质分界线(白质表面)和灰质⁃脑脊液分界线(软脑膜表面)。⑥自动校正表面拓扑缺陷。⑦单个网格表面的膨胀。⑧采用球面配准法将每例受试者的大脑皮质表面配准至FreeSurfer软件包提供的Fsaverage模板。(2)测量大脑皮质厚度:估算每一顶点的两个距离,一个是软脑膜表面顶点与白质表面之间的最短距离,另一个是白质表面顶点与软脑膜表面之间的最短距离,以上述距离的平均值估算大脑皮质厚度;以1 mm×1 mm×1 mm大小体素将图像归一至加拿大蒙特利尔神经病学研究所(MNI)标准空间,再进行25 mm半高全宽(FWHM)的高斯平滑处理,以提高数据信噪比(SNR)和统计分析效果。

表1 终末期肾病患者大脑皮质厚度减少的脑区Table 1. Brain regions of decreased cerebral cortical thickness in ESRD patients
3.统计分析方法 采用SPSS 19.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈正态分布的计量资料以均数±标准差(x±s)表示,采用两独立样本的t检验,由此产生的统计t图采用多重比较进行校正[P<0.05,随机场理论(RFT)校正]。终末期肾病患者大脑皮质厚度与肾功能的相关性采用Pearson相关分析。以P≤0.05为差异具有统计学意义。
结 果
一、大脑皮质厚度的比较
与正常对照组相比,终末期肾病患者右侧前额叶皮质厚度减少且差异有统计学意义(P<0.05,RFT校正;表1,图1),包括4个局部峰值顶点,即外侧前额叶皮质(峰值1和2;均P<0.05,RFT校正)、内侧前额叶皮质(峰值3;P<0.05,RFT校正)和腹侧前额叶皮质(峰值4;P<0.05,RFT校正;表1,图2)。
二、终末期肾病患者大脑皮质厚度与肾功能的相关分析
Pearson相关分析显示,终末期肾病患者外侧前额叶皮质厚度(峰值1:r=⁃0.344,P=0.043;峰值2:r=⁃0.335,P=0.049)和内侧前额叶皮质厚度(峰值3:r= ⁃0.387,P=0.021)均与血清肌酐水平呈负相关;外侧前额叶皮质厚度(峰值1:r=⁃0.384,P=0.023;峰值 2:r= ⁃0.380,P=0.024)、内侧前额叶皮质厚度(峰值3:r=⁃0.470,P=0.004)和腹侧前额叶皮质厚度(峰值4:r=⁃0.440,P=0.009)均与血清尿素氮水平呈负相关;内侧前额叶皮质厚度(峰值3)与血红蛋白水平呈正相关(r=0.339,P=0.046),与血清钾水平呈负相关(r=⁃0.335,P=0.049);外侧前额叶皮质厚度(峰值2)与校正血清钙水平呈正相关(r=0.354,P=0.037)。
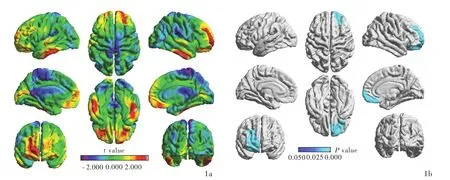
图1 终末期肾病患者与正常对照者大脑皮质厚度的比较:与正常对照者相比,终末期肾病患者右侧前额叶皮质厚度减少(蓝色区域所示) 1a 终末期肾病患者与正常对照者大脑皮质厚度比较的t值图 1b 终末期肾病患者与正常对照者大脑皮质厚度比较的P值图Figure 1 Comparison of cerebral cortical thickness between ESRD patients and normal controls:compared with normal controls,ESRD patients had decreased thickness of right prefrontal cortex(blue areas indicate) Comparison of cerebral cortical thickness between ESRD patients and normal controls(t value,Panel 1a). Comparison of cerebral cortical thickness between ESRD patients and normal controls(P value,Panel 1b).
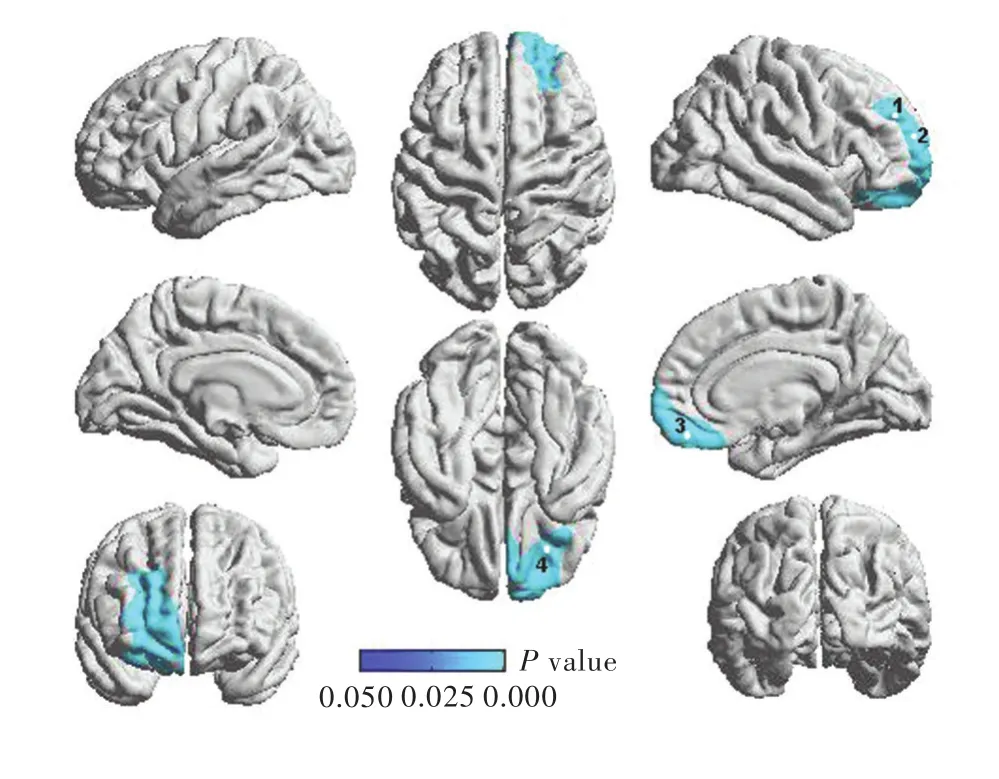
图2 终末期肾病患者与正常对照者前额叶皮质4个峰值顶点的比较:与正常对照者相比,终末期肾病患者右侧前额叶皮质(包括外侧前额叶皮质、内侧前额叶皮质和腹侧前额叶皮质)厚度减少(蓝色区域所示)Figure 2 Comparison of 4 local peak vertices in right prefrontal cortex between ESRD patients and normal controls:compared with normal controls,ESRD patients had decreased thickness ofrightprefrontalcortex,including lateral prefrontal cortex(Peak 1 and 2),medial prefrontal cortex(Peak 3)and ventral prefrontal cortex(Peak 4,blue areas indicate).
讨 论
本研究结果显示,与正常对照组相比,终末期肾病患者右侧前额叶皮质集群的皮质厚度减少,包括4个局部峰值顶点,即外侧前额叶皮质(峰值1和2)、内侧前额叶皮质(峰值3)和腹侧前额叶皮质(峰值4);Pearson相关分析显示,终末期肾病患者3个峰值顶点(外侧前额叶皮质和内侧前额叶皮质)皮质厚度与血清肌酐呈负相关,4个峰值顶点(外侧前额叶皮质、内侧前额叶皮质和腹侧前额叶皮质)皮质厚度均与血清尿素氮呈负相关,峰值3顶点(内侧前额叶皮质)皮质厚度与血红蛋白呈正相关、与血清钾呈负相关,峰值2顶点(外侧前额叶皮质)皮质厚度与校正血清钙呈正相关。
Frias等[22]的研究支持终末期肾病患者发生前额叶皮质形态学改变。脑源性神经营养因子(BDNF)表达下调与神经变性病的神经胶质细胞和神经元萎缩和凋亡具有相关性。PET研究也提示终末期肾病患者前额叶皮质异常:Song等[23]进行一项18F⁃脱氧葡萄糖(18F⁃FDG)PET研究,结果显示,慢性肾脏病(CKD)患者进行血液透析时可见脑组织数个像素集群葡萄糖代谢显著降低,主要包括左侧前额叶皮质(Brodmann 9区)、右侧前额叶皮质(Brodmann 10区)、左侧颞上回(Brodmann 42区)、右外侧前额叶皮质(Brodmann 46区)、右外侧前额叶皮质(Brodmann 44区)、右侧顶下小叶(Brodmann 39区)、左侧前扣带回(Brodmann 32区)、左侧运动前区皮质(Brodmann 6区)、左侧颞横回(Brodmann 41区)、左侧颞中回(Brodmann 19区)和左侧角回(Brodmann 39区)。既往研究大多集中于终末期肾病患者局 部大脑灰质 体积或密度 变化[10⁃11,24⁃25]:Ma等[10]的研究显示,终末期肾病患者双侧前额叶内侧回、前扣带回、颞上回、颞中回、舌回、海马旁回、壳核、尾状核、脑岛和右侧扣带回内侧灰质体积减少。Zhang等[25]发现,终末期肾病患者存在广泛灰质体积缩小,在伴明显认知功能障碍的情况下,灰质体积进一步缩小;他们还发现,上述脑区灰质体积缩小与血清尿素氮水平呈负相关。Qiu等[24]的研究显示,终末期肾病患者双侧眶额叶皮质内侧、腹外侧前额叶皮质和左侧颞中回皮质体积明显缩小;他们采用VBM法观察到终末期肾病患者双侧前额叶皮质体积明显缩小。Zhang等[25]的研究显示,终末期肾病患者额叶皮质体积弥漫性缩小;进一步研究发现,与双侧枕叶、舌回、距状裂,双侧颞上回、颞极、钩回、扣带回后部和(或)楔前叶、楔叶,右侧梭状回、海马旁回、杏仁核以及左侧海马、海马旁回体积变化与血清尿素氮呈负相关。然而,VBM法可能降低脑结构异常在脑病诊断中的敏感性,这是由于发生灰质体积和皮质厚度改变、灰质表面积改变、皮质折叠[14⁃15]。
在本研究中,我们在VBM法基础上采用SuBM的顶点分析法,为终末期肾病患者的脑形态学提供更加精确的信息,结果显示,右侧前额叶皮质集群皮质厚度减少。前额叶皮质有助于调节认知功能,人类大脑前额叶皮质参与运动行为和认知功能的调控过程[26⁃28]以及对行为和环境反馈的动机反应评价[27,29⁃30]。多项研究显示,终末期肾病患者进行性认知功能 障 碍 的 患 病 风 险 增 加[4,31⁃32]。 本 研 究 发 现的脑形态学改变可以作为终末期肾病患者发生认知功能障碍脑结构的基础性依据。fMRI研究亦有类似发现,终末期肾病患者前额叶皮质功能整合被破坏[10⁃11]。上述研究表明,前额叶皮质在终末期肾病患者认知功能障碍的进展中发挥重大作用,是终末期肾病患者认知功能障碍的潜在观察指标。
本研究亦发现,终末期肾病患者脑形态学改变与血液生化指标存在相关性,前额叶皮质的4个局部峰值顶点分别是外侧前额叶皮质(峰值1和2),内侧前额叶皮质(峰值3)和腹侧前额叶皮质(峰值4),3个峰值顶点(外侧前额叶皮质和内侧前额叶皮质)皮质厚度与血清肌酐呈负相关,4个峰值顶点(外侧前额叶皮质、内侧前额叶皮质和腹侧前额叶皮质)皮质厚度与血清尿素氮呈负相关,峰值3顶点(内侧前额叶皮质)皮质厚度与血红蛋白呈正相关、而与血清钾呈负相关,峰值2顶点(外侧前额叶皮质)皮质厚度与校正血清钙呈正相关。典型终末期肾病伴低血红蛋白血症可能进一步加重营养不良。既往研究显示,慢性营养不良可以导致大脑养分供应不足,从而引发如脑组织缺氧、血液黏滞度降低等问题,最终导致脑组织低灌注和(或)低代谢[33⁃34]。晚近研究证实脑组织正常代谢对建立和保持各脑区之间相互协调的重要性[35⁃36],这也是认知行为的基础[37]。由此可见,由于低血红蛋白血症可以导致脑组织能量代谢不足,故前额叶皮质形态学改变可能引起终末期肾病患者认知功能障碍[38⁃39]。Galons等[40]发现,血清尿素氮在透析失衡综合征导致脑水肿的发病机制中发挥重要作用。Zhang等[25]采用VBM法发现,血清尿素氮在终末期肾病相关肾性脑病中发挥重要作用,与我们的研究结果相一致。终末期肾病患者由于肾功能衰竭导致脑组织尿毒症毒素(如血清肌酐和尿素氮)沉积[41⁃42]。本研究结果可以提供肾毒性物质致神经元损害的客观证据。
本研究尚存在不足之处:首先,样本量相对较小,MRI参数未达到最佳标准。因此,对脑结构细微改变的检测受限,下一步研究我们将采用更大的样本量、更先进的技术和更优化的参数。其次,抑郁症可能使终末期肾病复杂化。晚近研究显示,抑郁症可以影响神经元的变化[43⁃44],下一步研究我们将采用更严格的试验以排除抑郁症的影响。
综上所述,本研究采用MRI和基于SuBM的顶点分析法证实终末期肾病患者右侧前额叶皮质(包括外侧前额叶皮质、内侧前额叶皮质和腹侧前额叶皮质)厚度减少,且与肾功能具有一定相关性,为终末期肾病患者大脑灰质形态学异常提供有力证据,也表明肾功能可能是预测脑结构改变的关键因素。
[1]Foley RN,Collins AJ.End⁃stage renal disease in the United States:an update from the United States Renal Data System[J].J Am Soc Nephrol,2007,18:2644⁃2648.
[2]De Deyn PP,Saxena VK,Abts H,Borggreve F,D'Hooge R,Marescau B,Crols R.Clinical and pathophysiological aspects of neurological complications in renal failure[J].Acta Neurol Belg,1992,92:191⁃206.
[3]Brouns R,De Deyn PP.Neurological complications in renal failure:a review[J].Clin Neurol Neurosurg,2004,107:1⁃16.
[4]Kurella Tamura M, Yaffe K. Dementia and cognitive impairment in ESRD:diagnostic and therapeutic strategies[J].Kidney Int,2011,79:14⁃22.
[5]Raphael KL,Wei G,Greene T,Baird BC,Beddhu S.Cognitive function and the risk of death in chronic kidney disease[J].Am J Nephrol,2012,35:49⁃57.
[6]Hsieh TJ,Chang JM,Chuang HY,Ko CH,Hsieh ML,Liu GC,Hsu JS.End⁃stage renal disease:in vivo diffusion⁃tensor imaging of silent white matter damage[J].Radiology,2009,252:518⁃525.
[7]Kim HS,Park JW,Bai DS,Jeong JY,Hong JH,Son SM,Jang SH. Diffusion tensor imaging findings in neurologically asymptomatic patients with end stage renal disease [J].NeuroRehabilitation,2011,29:111⁃116.
[8]Chou MC,Hsieh TJ,Lin YL,Hsieh YT,Li WZ,Chang JM,Ko CH,KaoEF,Jaw TS,Liu GC.Widespread whitematter alterations in patients with end⁃stage renal disease:a voxelwise diffusion tensor imaging study[J].AJNR Am J Neuroradiol,2013,34:1945⁃1951.
[9]Prohovnik I,Post J,Uribarri J,Lee H,Sandu O,Langhoff E.Cerebrovascular effects ofhemodialysis in chronic kidney disease[J].J Cereb Blood Flow Metab,2007,27:1861⁃1869.
[10]Ma X,Jiang G,Li S,Wang J,Zhan W,Zeng S,Tian J,Xu Y.Aberrant functional connectome in neurologically asymptomatic patients with end⁃stage renal disease[J].PLoS One,2015,10:E0121085.
[11]Ma X,Tian J,Wu Z,Zong X,Dong J,Zhan W,Xu Y,Li Z,Jiang G. Spatial disassociation of disrupted functional connectivity for the default mode network in patients with end⁃stage renal disease[J].PLoS One,2016,11:E0161392.
[12]Bookstein FL."Voxel⁃based morphometry"should not be used with imperfectly registered images[J].Neuroimage,2001,14:1454⁃1462.
[13]Jones DK,Symms MR,Cercignani M,Howard RJ.The effect of filter size on VBM analyses of DT ⁃MRI data[J].Neuroimage,2005,26:546⁃554.
[14]Hester R,Nestor L,Garavan H.Impaired error awareness and anterior cingulate cortex hypoactivity in chronic cannabis users[J].Neuropsychopharmacology,2009,34:2450⁃2458.
[15]Voets NL,Hough MG,Douaud G,Matthews PM,James A,Winmill L,Webster P,Smith S.Evidence for abnormalities of cortical development in adolescentonset schizophrenia[J].Neuroimage,2008,43:665⁃675.
[16]Harciarek M,Williamson JB,Biedunkiewicz B,Lichodziejewska⁃Niemierko M,Dębska⁃Slizień A,Rutkowski B.Risk factors for selective cognitive decline in dialyzed patients with end⁃stage renal disease:evidence from verbal fluency analysis[J].J Int Neuropsychol Soc,2012,18:162⁃167.
[17]Payne RB,Little AJ,Williams RB,Milner JR.Interpretation of serum calcium in patients with abnormal serum proteins[J].Br Med J,1973,4:643⁃646.
[18]Schultz⁃Larsen K,Lomholt RK,Kreiner S.Mini⁃Mental Status Examination:a short form of MMSE was as accurate as the original MMSE in predicting dementia[J].J Clin Epidemiol,2007,60:260⁃267.
[19]Dale AM,Fischl B,Sereno MI.Cortical surface⁃based analysis.Ⅰ:segmentation and surface reconstruction[J].Neuroimage,1999,9:179⁃194.
[20]Fischl B,Sereno MI,Dale AM.Cortical surface⁃based analysis.Ⅱ:inflation,flattening,and a surface⁃based coordinate system[J].Neuroimage,1999,9:195⁃207.
[21]Fischl B,Sereno MI,Tootell RB,Dale AM.High⁃resolution intersubject averaging and a coordinate system for the cortical surface[J].Hum Brain Mapp,1999,8:272⁃284.
[22]Frias B,Santos J,Morgado M,Sousa MM,Gray SM,McCloskey KD,Allen S,Cruz F,Cruz CD.The role of brain⁃derived neurotrophic factor(BDNF)in the development of neurogenic detrusor overactivity(NDO[)J].J Neurosci,2015,35:2146⁃2160.
[23]Song SH,Kim IJ,Kim SJ,Kwak IS,Kim YK.Cerebral glucose metabolism abnormalitiesin patientswith majordepressive symptoms in pre⁃dialytic chronic kidney disease:statistical parametric mapping analysis of F⁃18⁃FDG PET,a preliminary study[J].Psychiatry Clin Neurosci,2008,62:554⁃561.
[24]Qiu Y,Lv X,Su H,Jiang G,Li C,Tian J.Structural and functional brain alterations in end stage renal disease patients on routine hemodialysis:a voxel⁃based morphometry and resting state functional connectivity study[J].PLoS One,2014,9:E98346.
[25]Zhang LJ,Wen JQ,Ni L,Zhong JH,Liang X,Zheng G,Lu GM.Predominant gray matter volume loss in patients with end⁃stage renal disease:a voxel⁃based morphometry study[J].Metab Brain Dis,2013,28:647⁃654.
[26]RidderinkhofKR,van den WildenbergWP,SegalowitzSJ,Carter CS.Neurocognitive mechanisms of cognitive control:the role of prefrontal cortex in action selection,response inhibition,performance monitoring,and reward ⁃based learning[J].Brain Cogn,2004,56:129⁃140.
[27]Ridderinkhof KR,Ullsperger M,Crone EA,Nieuwenhuis S.The role ofthe medialfrontalcortex in cognitive control[J].Science,2004,306:443⁃447.
[28]Polli FE,Barton JJ,Cain MS,Thakkar KN,Rauch SL,Manoach DS. Rostral and dorsal anterior cingulate cortex make dissociable contributions during antisaccade error commission[J].Proc Natl Acad Sci USA,2005,102:15700⁃15705.
[29]SchniderA,BonvallatJ,Emond H,Leemann B.Reality confusion in spontaneous confabulation[J].Neurology,2005,65:1117⁃1119.
[30]Diekhof EK,Falkai P,Gruber O.The orbitofrontal cortex and itsrole in the assignmentofbehaviouralsignificance[J].Neuropsychologia,2011,49:984⁃991.
[31]Kurella M,Chertow GM,Luan J,Yaffe K.Cognitive impairment in chronic kidney disease[J].J Am Geriatr Soc,2004,52:1863⁃1869.
[32]Murray AM,Tupper DE,Knopman DS,Gilbertson DT,Pederson SL,Li S,Smith GE,Hochhalter AK,Collins AJ,Kane RL.Cognitive impairment in hemodialysis patients is common[J].Neurology,2006,67:216⁃223.
[33]Bornivelli C,Aperis G,Giannikouris I,Paliouras C,Alivanis P.Relationship between depression,clinicaland biochemical parameters in patients undergoing haemodialysis[J].J Ren Care,2012,38:93⁃97.
[34]Kuwabara Y,Sasaki M,Hirakata H,Koga H,Nakagawa M,Chen T,Kaneko K,Masuda K,Fujishima M.Cerebral blood flow and vasodilatory capacity in anemia secondary to chronic renal failure[J].Kidney Int,2002,61:564⁃569.
[35]LiangX,Zou Q,HeY,YangY.Couplingoffunctional connectivity and regional cerebral blood flow reveals a physiological basis for network hubs of the human brain[J].Proc Natl Acad Sci USA,2013,110:1929⁃1934.
[36]Tomasi D,Wang GJ,Volkow ND.Energetic cost of brain functional connectivity[J].Proc Natl Acad Sci USA,2013,110:13642⁃13647.
[37]Sporns O,Zwi JD.The small world of the cerebral cortex[J].Neuroinformatics,2004,2:145⁃162.
[38]Kalender B,Ozdemir AC,Koroglu G.Association of depression with markers of nutrition and inflammation in chronic kidney disease and end ⁃stage renal disease[J].Nephron Clin Pract,2006,102:C115⁃121.
[39]Teles F,de Azevedo VF,de Miranda CT,Miranda MP,Teixeira Mdo C,Elias RM.Depression in hemodialysis patients:the role of dialysis shif[tJ].Clinics,2014,69:198⁃202.
[40]Galons JP,Trouard T,Gmitro AF,LienYH.Hemodialysis increases apparentdiffusion coefficientofbrain water in nephrectomized rats measured by isotropic diffusion⁃weighted magnetic resonance imaging[J].J Clin Invest,1996,98:750⁃755.
[41]Owen WF Jr,Lew NL,Liu Y,Lowrie EG,Lazarus JM.The urea reduction ratio and serum albumin concentration as predictors of mortality in patients undergoing hemodialysis[J].N Engl J Med,1993,329:1001⁃1006.
[42]De Deyn PP,Vanholder R,Eloot S,Glorieux G.Guanidino compounds as uremic(neuro)toxins[J].Semin Dial,2009,22:340⁃345.
[43]Murphy ML,Frodl T.Meta⁃analysis of diffusion tensor imaging studies shows altered fractional anisotropy occurring in distinct brain areasin association with depression[J].BiolMood Anxiety Disord,2011,1:3.
[44]Kimmel PL,Cukor D,Cohen SD,Peterson RA.Depression in end ⁃stage renal disease patients:a critical review[J].Adv Chronic Kidney Dis,2007,14:328⁃334.
