青岛海泊河污水处理厂缺氧池中微生物群落动态变化❋
2018-05-10韩岳桐徐巧燕李志伟万一平董俊伟马丙瑞高孟春
韩岳桐, 赵 堃, 王 森, 徐巧燕, 李志伟, 万一平, 董俊伟, 马丙瑞, 高孟春❋❋
(1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100; 2. 中国海洋大学环境科学与工程学院,山东 青岛266100)
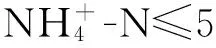
众所周知,废水生物处理系统中大多数微生物是不可培养的,可分离培养的微生物只占1%左右[5]。近年来,高通量测序技术以边合成边测序技术为基础,通过可逆终止试剂方法对数百万个片段同时进行大规模平行测序,具有分析结果准确、高速等特点,被广泛应用于污水处理过程中微生物群落结构和多样性研究[6]。闫媛等[7]采用高通量测序分析了了全程自养脱氮系统不同脱氮效能下的微生物群落结构的变化。Ma 等[8]和Wang等[9]通过高通量测序技术分别评价了Fe3O4纳米颗粒和ZnO纳米颗粒浓度变化对序批式生物反应器内微生物丰度和多样性的影响。Gao等[10]通过高通量测序解析了单室微生物燃料电池在厌氧污泥或好氧污泥接种情况下阳极生物膜中微生物群落的富集。Liu等[11]利用高通量测序分析了在低温下厌氧氨氧化反应器处理低浓度废水的微生物特征。Ma等[12]通过Illumina MiSeq高通量测序平台考察了钢铁厂炼焦废水处理厂中微生物群落组成。鉴于以往的研究成果,高通量测序技术应用于解析青岛海泊河污水处理厂缺氧池的微生物群落结构变化是可行的。因此,本论文基于Illumina MiSeq高通量测序平台,系统地研究了不同月份缺氧池内微生物丰度和多样性变化,评价了不同月份缺氧池内微生物群落的相似性和差异性,从门、纲和属等水平上解析了缺氧池内微生物群落的变化,为进一步阐明环境条件变化下缺氧池中微生物群落结构与其功能的关系提供一定基础数据。
1 实验材料与方法
1.1 缺氧池污泥样品的来源
本研究污泥样品取自青岛市海泊河污水处理厂的缺氧池,取样时间分别为1、4、6、8、10和12月,在冰箱中冷冻保存。不同月份污水处理厂进水水质变化情况如表1所示。
1.2 污泥样品DNA提取和PCR
利用DNA提取试剂盒(MoBio Laboratories,Carlsbad,CA,USA)按照说明书所列步骤对缺氧池污泥样提取DNA,并对提取的基因组DNA其进行琼脂糖电泳检测,核对基因组DNA的纯度与浓度。采用16S rDNA的通用引物515F (5′-GTGCCAGCAGCCGCGGTAA-3′) 和806R (5′-GGACTACCAGGGTATCTAAT-3′) 扩增16S rDNA基因。
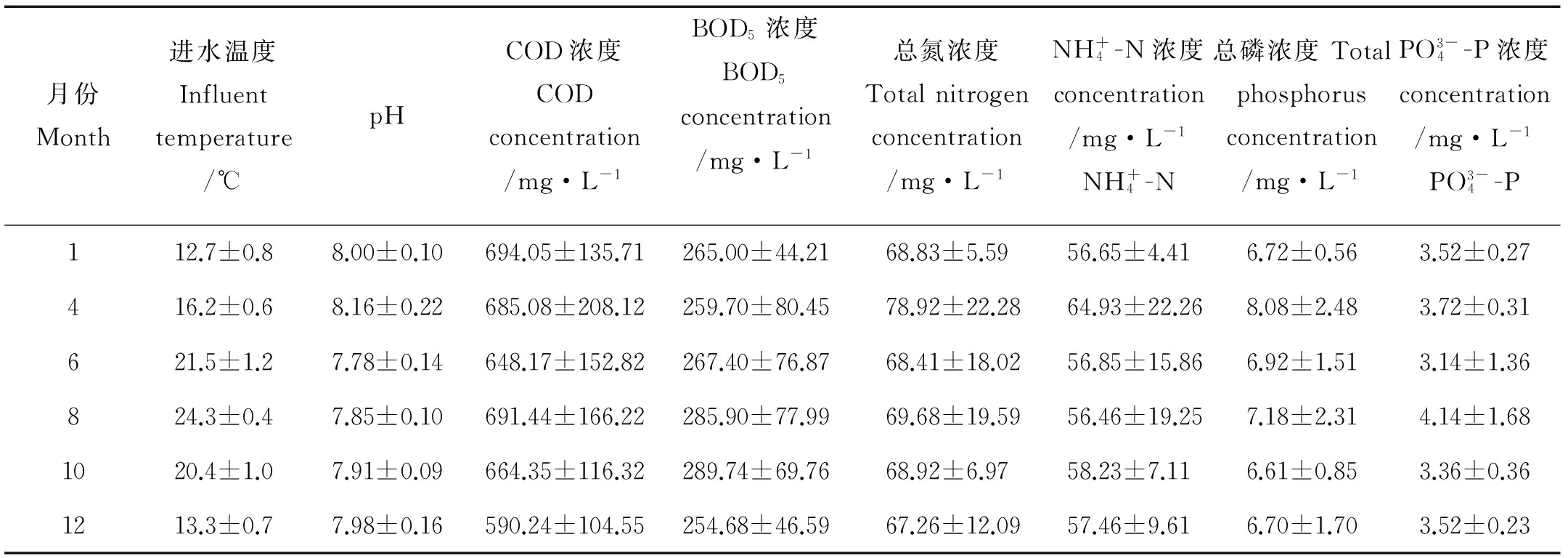
表1 不同月份污水处理厂进水组成
1.3 基于Illumina MiSeq平台的16S rDNA高通量测序
基于Illumina MiSeq测序平台,利用双末端配对测序(Paired-End)的方法对获得的DNA样品构建小片段文库进行双末端测序。为了使分析结果更加科学可靠,首先采用QIIME软件对上机得到的原始数据进行拼接过滤,得到有效数据。具体步骤如下:(1)去除各样本中的barcode;(2)去除小于50 bp短片序列;(3)去除低复杂度序列;(4)提取高质量的测定序列。基于有效数据,设置97%相似性进行OTUs(Operational taxonomic units,简称OTUs)聚类和物种分类分析,并将OTU和物种注释结合,得到每个样品的OTUs和分类谱系。选取相似度为97%的OTU生成稀释曲线,并利用MOTHUR软件计算Good’s coverage、Shannon、Chao 1、ACE和Simpson指数。通过聚类分析、主坐标分析(Principal coordinates ordination,简称PCoA)等统计比较分析,对比样品之间的共同性与差异性。本实验的样品测序均由北京诺禾致源生物信息科技有限公司完成。
2 结果与讨论
2.1 不同月份缺氧池内微生物丰度和多样性的变化


表2 不同月份缺氧池中微生物群落的丰富度和多样性指数Table 2 Richness and diversity indices of microbial community in the anoxic tank at different months
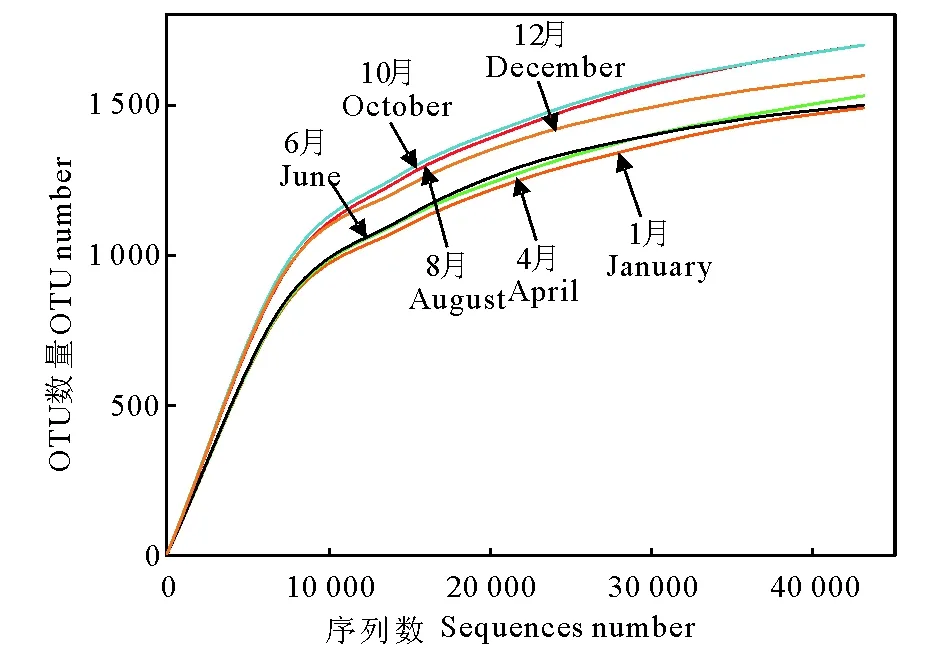
图1 不同月份缺氧池中污泥样品的稀释曲线Fig.1 Rarefaction curve of the activated sludge samples in anoxic tank at different months
2.2 不同月份缺氧池内微生物的相似性和差异性
本文通过Venn图考察不同月份污泥样品中共有OTU和特有OTU数量分析了缺氧池内微生物的相似性和差异性(见图2)。1、4、6、8、10和12月在缺氧池所取的6个污泥样品中总OTU数是1 022个,其中719个为共有OTU,约占总OTU数的70.4%。从门水平上分析可知,共有OTU中占优势地位的门包括Proteobacteria(42.3%)、Bacteroidetes(21.0%)、Chloroflexi(6.5%)、Firmicutes(6.3%)、Actinobacteria(4.0%)和Planctomycetes(3.8%)。在1、4、6、8、10和12月在缺氧池所取污泥样品中特有OUT数量分别为62、35、39、61、63和43个,约占总OTU数的29.6%。Venn图分析结果表明,大部分微生物随着运行时间的变化一直存在于缺氧池,在不同运行阶段只有少数微生物属于特有的微生物。
为了更准确地分析不同月份缺氧池污泥中微生物群落的差异性,本文通过利用统计学方法对污泥样品进行了主成分分析(Principal Component Analysis,简称PCA)和主坐标分析(Principal coordinates ordination,简称PCoA)。在PCA和PCoA分析图中样品距离越接近,表明样品的群落结构越相似,微生物群落相近的污泥样品倾向于聚集在一起,而微生物群落差异大的污泥样品相距很远。由图3(a)可知,8和10月缺氧池的两个污泥样品在PCA图中的距离最近,说明它们的微生物群落组成最为相似; 4与8和10月的污泥样品之间距离较近,6和12月的污泥样品之间距离较近,然而1月与其它月的污泥样品都存在明显的距离。由图3(b)可知,主成分1和2是造成6个样品的两个最大差异特征,贡献率分别为30.62%和22.17%。4、8和10月缺氧池污泥样品在PCoA图中的距离最近。6和12月的样品距离比较接近,但是它们与1月的样品都有较远的距离,说明它们之间群落结构组成的差异性很大。结合表1给出进水水质变化情况,缺氧池内污泥中微生物群落结构和多样性变化不仅与环境温度有关也与进水水质存在着一定的必然联系,从而出现12和6月的微生物群落具有较高相似性的情况。综上所述,PCA和PCOA的分析结果基本一致,即环境温度较高的8和10月缺氧池中污泥样品的微生物群落比较相似,但与环境温度较低的1月污泥样品中的微生物群落之间存在着明显的差异。

图2 不同月份缺氧池中污泥的Venn图Fig.2 Venn diagram of the activated sludge in the anoxic tank at different months

图3 不同月份缺氧池中污泥的PCA(a)和PCoA(b)分析Fig.3 PCA (a) and PCoA (b) analysis of activated sludge samples in the anoxic tank
图4为不同月份缺氧池中微生物群落的未加权聚类分析。缺氧池中微生物群落主要分成三组:1月份为1组;4、8和10月为1组;6和12月为1组。由图4可知,环境温度较低月份缺氧池中微生物群落与环境温度较高月份的微生物群落存在明显差异,这与PCoA主要成分分析结果是一致的。
2.3 在门水平上缺氧池内微生物群落在不同月份的动态变化
图5表示在门水平上缺氧池内微生物群落在不同月份的动态变化。在所取的污泥样品中占优势的门包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、绿菌门(Chlorobi)、浮霉菌门(Planctomycetes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、放线菌(Actinobacteria) 和酸杆菌门 (Acidobacteria),这些门1、4、6、8、10和12月占总序列的比例依次为97.6%、97.3%、97.6%、96.8%、96.7%和96.9%。1月的污泥样品中主要门有Bacteroidetes(44.3%)、Proteobacteria(44.0%)、Chlorobi(2.4%)、Firmicutes(1.7%)、Planctomycetes(1.4%)和Acidobacteria(1.0%)。随着环境温度的上升,在6和8月的缺氧池污泥样品中,Proteobacteria的相对丰度分别增长到44.8%和46.8%,而Bacteroidetes的相对丰度分别下降到30.7%和26.4%。10月的污泥样品中Proteobacteria的相对丰度增至48.0%,Bacteroidetes的相对丰度轻微增长到32.4%。在环境温度较低的12月缺氧池污泥样品中,Proteobacteria的相对丰度继续增大到49.7%,而Bacteroidetes的相对丰度微降至30.1%。由此可见,低温条件下Proteobacteria的相对丰度明显降低,而Bacteroidetes的相对丰度则显著增大。在生物处理过程中,Proteobacteria对有机物、氮和磷的去除发挥着非常重要的作用。

图4 不同月份缺氧池中微生物群落的未加权聚类分析Fig.4 Unweighted clustering analysis of microbial community in the anoxic tank
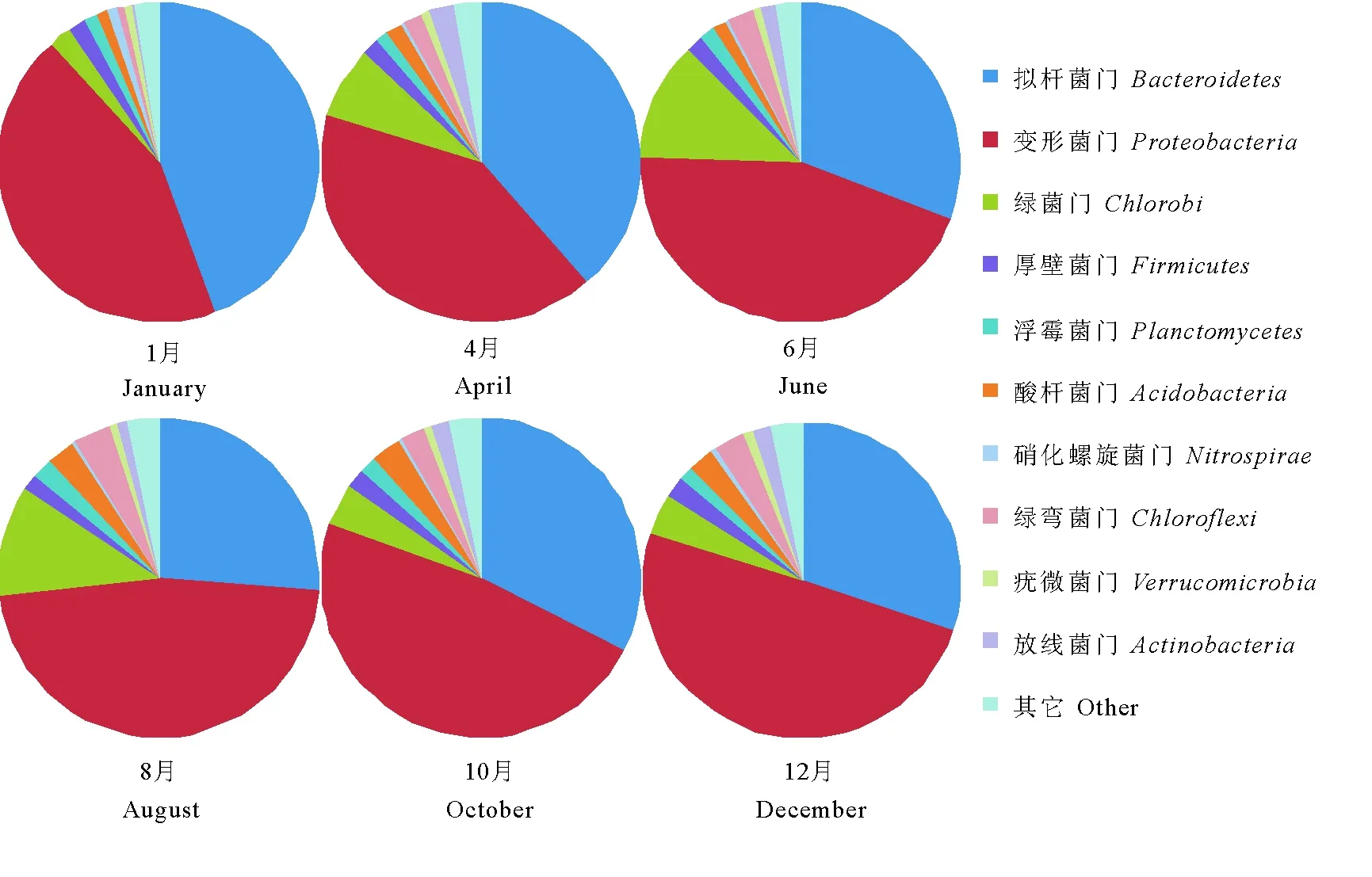
图5 不同月份缺氧池中微生物在门水平上的分类Fig.5 Taxonomic compositions of microbial communities in the anoxic tank at the phylum level
2.4 在纲水平上缺氧池中微生物群落在不同月份的动态变化
图6表示在纲水平上缺氧池内微生物群落在不同月份的动态变化。1月所取污泥样品中占优势的纲包括Saprospirae(25.5%)、Betaproteobacteria(21.0%)、Gammaproteobacteria(9.6%)、Flavobacteriia(5.4%)、Deltaproteobacteria(5.4%)、Sphingobacteriia(3.9%)、Alphaproteobacteria(3.0%)、Cytophagia(2.8%)、Epsilonproteobacteria(2.1%)、Ignavibacteria(2.1%)、Bacteroidia(1.9%)、Clostridia(1.4%)、Chloracidobacteria(0.8%)和Anaerolineae(0.7%)。与1月相比,在4、6、8、10和12月所取缺氧池污泥中不同纲的相对丰度或增大或降低,表明了不同季节(或者进水水质)变化直接影响了缺氧池内微生物群落。Saprospirae的相对丰度从1月25.5%减低到6月14.8%,随后在8、10和12月稳定在(19.7±1.3)%。Betaproteobacteria、Flavobacteriia的相对丰度在不同月份分别稳定在(18.5±3.0)%和(5.0±0.8)%,这表明不同月份对Betaproteobacteria和Flavobacteriia的丰度没有明显的影响。在环境温度较低的1和12月Deltaproteobacteria的相对丰度较高,但是在环境温度较高的4、6、8和10月Deltaproteobacteria的相对丰度在2.4%~2.6%之间变化。Gammaproteobacteria、Cytophagia、Sphingobacteriia、Anaerolineae、Clostridia和Bacteroidia的相对丰度变化范围分别为9.6%~22.5%、0.1%~2.8%、3.9%~13.8%、0.7%~3.2%、0.3%~1.4%和0.6%~2.6%,这说明它们的相对丰度在不同月份受外界环境(如环境温度和进水水质)的影响较大。
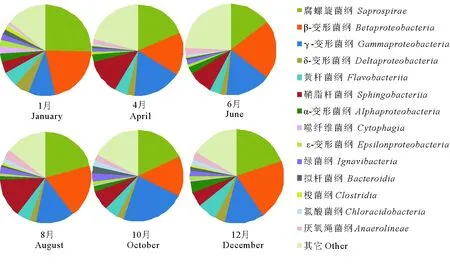
图6 不同月份缺氧池中微生物在纲水平上的分类
2.5 在属水平上缺氧池内微生物群落在不同月份的动态变化
图7为在属水平上缺氧池内微生物群落在不同月份的动态变化。在1月的污泥样品中主要属有Haliscomenobacter(22.9%)、Chitinophaga(6.5%)、Dechloromonas(6.1%)、Acidovorax(4.4%)、Niabella(3.8%)、Haliangium(3.4%)、Bergeyella(3.1%)、Agitococcus(2.8%)、Arcobacter(2.6%)、Arcobacter(2.6%)、Arcicella(2.1%)、Ignavibacterium(1.9%)、CandidatusAccumulibacter(1.6%)、Sulfuritalea(1.3%)、Dokdonella(1.2%)和Nitrospira(0.9%)。与1月的微生物群落相比,不同属在4、6、8、10和12月缺氧池污泥中相对丰度或增大或减少,表明缺氧池内不同属的微生物丰度随着外界环境的改变呈现不同程度的动态变化。Haliscomenobacter的相对丰度在1、4、6、8、10和12月的污泥样品中分别为22.9%、14.6%、8.3%、10.5%、13.0%和10.2%,属于缺氧池内不同月份污泥样品的优势菌属。作为丝状菌的Haliscomenobacter使缺氧池污泥保持稳定的絮体结构并形成较大聚合体[14]。 根据以前的文献报道[15-18],Thauera、Dechloromonas和Sulfuritalea在缺氧或厌氧条件下具有反硝化的能力。由图7可知,Thauera的相对丰度在1和4月在缺氧池内是相近的而在6、8、10和12月稳定在(3.3±0.3)%,Dechloromonas的相对丰度在1、4、6和8月有明显的波动而在10和12月稳定在4.0%左右,Sulfuritalea的相对丰度在环境温度相对较低的1和12月稳定1.3%左右而在6、8、10和12月在0.4%和0.8%之间变化。Nitrospira作为一种具有亚硝酸盐氧化能力的菌属[19],在1、4、6、8、10和12月所取的污泥样品中相对丰度分别为0.9%、0.4%、0.4%、0.5%、0.3%和0.6%。CandidatusAccumulibacter是一种具有同步反硝化除磷功能的菌属[20]。在1、4、6、8、10和12月所取的污泥样品中Candidatusaccumulibacter的相对丰度在0.3%~1.6%之间变动。不同菌属的相对丰度变化结果表明,缺氧池内的微生物丰度随着环境温度或进水组分的变化而呈现动态变化。

图7 在属水平上缺氧池不同月份微生物群落的动态变化Fig.7 Dynamic variations of microbial community in the anoxic tank under different months at the genus level
3 结论
(1)在8和10月缺氧池中微生物群落丰度较高,1月缺氧池污泥中微生物群落丰度较小。缺氧池微生物群落多样性在12月较高,在6月微生物群落多样性较小。
(2)不同月份缺氧池中共有分类操作单元(OTU)中占优势地位的门包括Proteobacteria(42.3%)、Bacteroidetes(21.0%)、Chloroflexi(6.5%)、Firmicutes(6.3%)、Actinobacteria(4.0%)和Planctomycetes(3.8%),表明大部分微生物在一直存在于缺氧池。
(3)污泥样品中微生物群落的主成分分析和主坐标分析表明,8和10月缺氧池中微生物群落比较相似,但与1月污泥样品中的微生物群落之间存在明显的差异。
(4)在门、纲和属水平上缺氧池内微生物的种类和相对丰度在不同月份呈现明显变化。
参考文献:
[1] Chen Y W, Lan S H, Wang L H, et al. A review: Driving factors and regulation strategies of microbial community structure and dynamics in wastewater treatment systems[J]. Chemosphere, 2017, 174: 173-182.
[2] Shu D T, He Y L, Yue H, et al. Metagenomic and quantitative insights into microbial communities and functional genes of nitrogen and iron cycling in twelve wastewater treatment systems[J]. Chemical Engineering Journal, 2016, 290: 21-30.
[3] 方芳, 秦宇, 郭劲松, 等. 单级自养脱氮反应器效能与微生物群落结构的相关性[J]. 土木建筑与环境工程, 2010, 32(3): 113-117.
Fang F, Qin Y, Guo J S, et al. Relationship between performance and microbial community structure of the SBBR autotrophic nitrogen removal process[J]. Journal of Civil, Architecture and Environmental Engineering, 2010, 32(3): 113-117.
[4] 徐少娟, 蒋涛, 殷峻, 等. 进水氨氮浓度对强化生物除磷(EBPR)系统除磷特性及微生物群落结构的影响[J]. 环境科学学报, 2011, 31(4): 745-751.
Xu S J, Jiang T, Yin J, et al. Effects of influent ammonia concentration on phosphorus removal and the microbial community in an EBPR system[J]. Acta Science Circumstantiae, 2011, 31(4): 745-751.
[5] Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiology Review, 1995, 59: 143-169.
[6] 王浩. 高通量测序等分子生物学技术研究填埋场生物反应器脱氮微生物群落变化[D]. 上海: 华东师范大学, 2014.
Wang Hao. Study on Microbial Community Structure of Nitrogen Removal Process in Land Fill Bioreactor by Using High-Throughput Sequencing and Other Molecular Biological Techniques[D]. Shanghai: East China Normal University, 2014.
[7] 闫媛,黎力,王亚宜,等. 采用高通量测序分析全程自养脱氮(CANON)系统不同脱氮效能下的微生物群落结构[J]. 北京工业大学学报, 2015, 41(10): 1485-1492.
Yan Y, Li K, Wang Y Y, et al. Microbial community characteristics of a completely autotrophic nitrogen removal over nitrite(CANON) system based on high-throughput sequencing technology[J]. Journal of Beijing University of Technology, 2015, 41(10): 1485-1492.
[8] Ma B R, Wang S, Li Z W, et al. Magnetic Fe3O4nanoparticles induced effects on performance and microbial community of activated sludge from a sequencing batch reactor under long-term exposure[J]. Bioresource Technology, 2016, 225: 377-385.
[9] Wang S, Gao M C, She Z L, et al. Long-term effects of ZnO nanoparticles on nitrogen and phosphorus removal, microbial activity and microbial community of a sequencing batch reactor[J]. Bioresource Technology, 2016, 216: 428-436.
[10] Gao C Y, Wang A J, Wu W M, et al. Enrichment of anodic biofilm inoculated with anaerobic or aerobic sludge in single chambered air-cathode microbial fuel cells[J]. Bioresource Technology, 2014, 167: 124-132.
[11] Liu W R, Yang D H, Chen W J, et al. High-throughput sequencing-based microbial characterization of size fractionated biomass in an anoxic anammox reactor for low-strength wastewater at low temperatures[J]. Bioresource Technology, 2017, 231: 45-52.
[12] Ma Q, Qu Y Y, Shen W L, et al. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J]. Bioresource Technology, 2015, 179: 436-443.
[13] Liu Z, Zhang C, Wang L, et al. Effects of furan derivatives on biohydrogen fermentation from wet stream-exploded cornstalk and its microbial community[J]. Bioresource Technology, 2015, 175: 152-159.
[14] Li C, Zhang Z, Cao J S, et al. Study on poultry manure wastewater treatment by two-stage aerobic coupled process and its microbial community analysis[J]. Biochemical Engineering Journal, 2016, 110: 101-111.
[15] Yoshifumi S, Yasuyoshi S, Hiroshi U, et al. Aerobic and anaerobic toluene degradation by a newly isolated denitrifying bacterium,Thauerasp. strain DNT-1[J]. Applied and Environmental Microbiology, 2004, 70(3): 1385-1392.
[16] Scholten E, Auling G R M, Rainey F A, et al.Thaueramechernichensissp. nov., an aerobic denitrifier from a leachate treatment plant[J]. International Journal of Systematic Bacteriology, 1999, 49(3): 1045-1051.
[17] Horn M A, Julian I, Carola M, et al. Dechloromonas denitrificans sp. nov., Flavobacterium denitrificans sp. nov.,Paenibacillusanaericanussp. nov. and Paenibacillus terrae strain MH72, N2O-producing bacteria isolated from the gut of the earthwormAporrectodeacaliginosa[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(3): 1255-1265
[18] Watanabe T, Kojima H, Fukui M, et al. Complete genomes of freshwater sulfur oxidizersSulfuricelladenitrificansskB26 andSulfuritaleahydrogenivoranssk43H: Genetic insights into the sulfur oxidation pathway of betaproteo bacteria[J]. Systematic and Applied Microbiology, 2014, 37(6): 387-395
[19] Christiane G D, Michael P, Katharina K, et al. Functionally relevant diversity of closely related Nitrospira in activated sludge[J]. Journal of Microbial Ecology, 2015, 9(3): 643-655
[20] Kim J M, Lee H J, Lee D S, et al. Characterization of the denitrification-associated phosphorus uptake properties “Candidatus Accumulibacter phosphatis” clades in sludge subjected to enhanced biological phosphorus removal[J]. Applied Environmental Microbiology, 2013, 79(6): 1969-1979.
