手持技术探究酚酞的配制
2018-05-09李双王敬文霍爱新
◆李双 王敬文 霍爱新
1 问题提出
目前,在初中、高中化学教学中使用的指示剂主要有酚酞、紫色石蕊和甲基橙。尤其是在酸碱滴定实验中,酚酞指示剂是最常用的。指示剂都有一定的变色范围,高中化学教材中,酚酞指示剂的pH 变色范围是8.2 ~10.0,但是教材中并没有说明酚酞指示剂的配制方法。查阅资料,发现酚酞指示剂的配制方法有多种。
第一种,国标配制方法:称取0.5g 酚酞,用95%乙醇溶解,并稀释至100 mL,无须加水[1]。
第二种,采用60%的酒精水溶液作为溶剂,称取0.1 g酚酞,溶于100 mL60%的酒精水溶液中。
第三种,称取0.1 g 酚酞,加60 mL 95%的乙醇,然后用去离子水定容至100 mL[2]。
第四种,化学实验员速查手册法:每升90%的乙醇中溶解1 g 酚酞[3]。
那么不同的酚酞配制方法,对滴定终点是否有影响呢?本实验借助手持技术对资料中四种不同浓度酚酞指示剂的变色终点的pH 进行准确记录,以探究较好的配制方法。
2 手持技术简介
手持技术是一种现代化、高科技的实验工具,又称掌上实验,是一种常用的传感器技术,是由数据采集器、(温度、pH、溶解氧、电导率、CO2浓度等)传感器和配套软件组成的定量采集数据(包括物理、化学和生物数据等)并能与计算机连接的数字化实验系统。与传统的常规实验相比,数字实验解决了传统实验中只能定性不能定量,定量却无法体现过程的现状;并实现实验研究的多样化,同时成为传统实验的一个很好的补充,给学生科学运用探究性学习方法提供了一个强有力的工具。手持技术最突出的特点有以下几点。
1)携带便捷:数据采集器和传感器都比较小,在掌上就能进行操作,便于教师和学生随时进行实验探究活动,打破了空间的限制。
2)实时监控:实验过程与数据变化过程是同步进行的,数据可以实时传输,而且可以回放、保存。
3)数据准确:可以计算机自动收集实验数据,也可以手动收集研究者想要得到阶段的实验数据,大大降低人为的不可控误差。
4)综合实验:数据采集器的数据输出口不止一个,因此,研究者可以在同一时间进行同一反应不同数据的收集,可以同时进行不同角度的探索,增大研究的范围。
5)动态直观:数据的表征形式既可以通过表格、曲线、图像、数字多种表现形式动态地观察实验的全过程,也可以以视频的形式将过程直观地呈现在学生面前。
将手持技术应用于中学化学实验教学与研究性学习,能转变学生的学习方式,培养学生的科学探究能力和创新精神,体现新一轮基础教育改革的思想和理念。
3 实验目的
选择不同的酚酞配制方法,使滴定终点(变色)尽量接近pH 为7,尽量减小滴定终点的系统误差。
4 实验原理
酸碱中和滴定实验的选择具体的酸碱反应和酸碱的浓度对滴定终点的变色会有一定的影响。高中化学酸碱滴定一般采用的酸碱浓度为0.1 mol/L。本实验采用0.1 mol/L 稀盐酸滴定0.1 mol/L NaOH 溶液。
酚酞变色范围的影响因素由于酚酞为有机物,水中溶解度很小,小于0.1 g/100 mL,但易溶于乙醇,因此,酚酞一般用乙醇配制,而乙醇的浓度直接影响酚酞的溶解度。由于酚酞为有机物弱酸,酚酞的浓度也会影响滴定终点的观察,最终配制的酚酞溶液的浓度会影响滴定终点颜色的变化。
手持技术的选择利用pH 传感器和PASCO 数据采集器及DataStudio 分析软件,实时采集混合溶液的pH并同步转化为图像输出。在实验过程中准确记录指示剂变色时的pH,找到最接近7 的配制。
根据以上实验原理所需实验试剂包括0.1mol/L 浓盐酸、0.1mol/L 氢氧化钠、95%的乙醇、蒸馏水、酚酞固体;仪器包括PASCO 数据采集器、高精度滴定计、pH传感器、计算机及DataStudio 软件。
5 实验步骤
第一步:向四组0.1 mol/L NaOH 溶液中分别滴加一滴不同配制方法配制的酚酞作为指示剂,溶液显红色。
第二步:将实验装置与电脑连接并打开软件Data-Studio →将“图表1”拖拽到“pH”上,出现“pH”图像窗口。
第三步:将0.1 mol/L 稀盐酸倒入滴定计,打开滴定计下端旋塞,同时点击电脑中的“启动”按钮,记录滴定过程。
第四步:仔细观察溶液颜色,当溶液开始变无色时,立即关闭滴定计下端旋塞,停止滴加稀盐酸,待pH 稳定即两物质充分反应时,记录混合溶液的pH,以备分析。
6 实验指标的确立
学生在初中阶段学习酸碱中和滴定实验时以定性为主,而高中阶段则在此基础上增加了定量的要求。虽然实验的精确度要求不高,但是指示剂的灵敏度越高,精确度会越好,实验值与理论计算值就会越接近,如滴定曲线的绘制、中和热的测定、食醋中乙酸含量的测定等实验,都需要定量。指示剂的灵敏度和精确度对实验有直接影响,因此,探究较佳的酚酞指示剂的配制方法,使其能更敏锐地显示酸碱中和滴定的终点,滴定结果正好在滴定曲线突跃范围之内就显得尤为重要了。故本实验选取反应结束后溶液的pH 偏离7 的百分比作为实验指标:
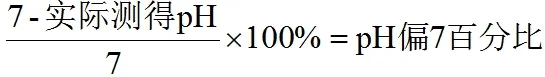
7 实验数据记录与实验结果
实验一:称取0.5 g 酚酞,用95%乙醇溶解,并稀释至100mL,无须加水。pH在5.29的时候,指示剂变色,如图1所示。
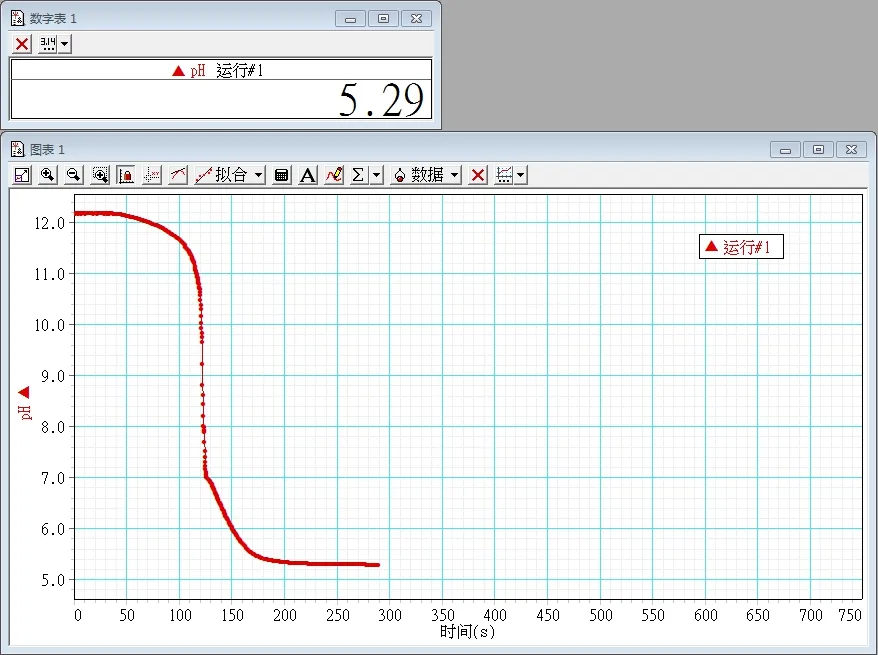
图1 0.5 g 酚酞95%乙醇溶液指示剂

图2 0.1 g 酚酞60%乙醇溶液指示剂

图3 0.1 g 酚酞95%乙醇溶液指示剂
实验二:采用60%的酒精水溶液作为溶剂,称取0.1 g酚酞,溶于100 mL 60%的酒精水溶液中。pH 在6.03 的时候,指示剂变色,如图2 所示。

图4 0.1 g 酚酞90%乙醇溶液指示剂
实验三:0.1 g 酚酞加60 mL 95%的乙醇,然后用去离子水定容至100 mL。pH 在6.95 的时候,指示剂变色,如图3 所示。
实验四:称取0.1 g 酚酞,用90%乙醇溶解,并稀释至100 mL,无须加水。pH 在6.37 的时候,指示剂变色,如图4 所示。
最佳配比:将四组实验数据用表格进行对比,并计算pH偏离7百分比,数据如表1所示。可见,基于本实验的探究,第三种酚酞指示剂配制方法较佳,即准确称取0.1g 酚酞,并用95%乙醇溶解,在中学化学盐酸和氢氧化钠的滴定实验中可以最大限度减小误差。

表1 实验数据处理
8 研究反思
首先,酚酞溶液的浓度越小,pH 偏离7 的百分比越小,即指示剂配制过程中所造成的系统误差对酸碱中和滴定终点指示的影响越小,对滴定终点的显示也就越精确,指示剂的灵敏度越高;其次,配制酚酞的试剂,相比较是95%的乙醇效果较好,这与酚酞属于有机物相统一;最后,本实验局限于高中典型的酸碱中和滴定——盐酸和氢氧化钠的反应,对不同酸碱的中和滴定也许会有不同的结果,并没有进行尝试,有待进一步探究。■
