一种对mcr-1阳性大肠杆菌具有裂解作用的噬菌体生物学特性
2018-05-08钟希娜葛展霞
钟希娜, 何 涛, 葛展霞, 王 冉
(1.江苏省农业科学院农业部食品质量安全监控重点开放实验室/江苏省禽产品安全性研究重点实验室,江苏 南京 210014; 2.南京农业大学动物科技学院,江苏 南京 210095)
大肠埃希氏菌(Escherichiacoli,E.coli)俗称大肠杆菌,属于革兰氏阴性细菌肠杆菌科埃希氏菌属。部分致病性的大肠杆菌能同时感染人畜[1],给人类健康和财产造成巨大损失。黏菌素(Colistin)又称为多黏菌素E(PolymyxinsE),能破坏革兰氏阴性细菌的细胞膜结构[2-3],中和细菌内毒素[4],被称为抵抗革兰氏阴性菌的最后一道防线[5-7]。长期以来,黏菌素在国内动物养殖上应用广泛,导致动物源大肠杆菌对黏菌素的耐药性逐年增加。最近报道的大肠杆菌上携带的mcr-1基因,可以介导大肠杆菌对黏菌素的低水平耐药。值得注意的是,该耐药基因可以通过质粒在同一细菌种属甚至不同细菌种属间进行水平传播,同时mcr-1基因可与其他耐药基因共存于同一细菌菌株中[8],从而形成危害更大的多重耐药甚至泛耐药超级细菌。携带mcr-1基因大肠杆菌的出现,对于公共卫生安全和人类健康而言是一个极大的威胁,而传统的抗生素对多重耐药细菌引起的疾病疗效甚微,因此寻求新型的抗菌制剂已迫在眉睫。
噬菌体(Bacteriophage)能特异性感染宿主细菌,被称为最重要的天然杀菌物质[9-10]。相比于抗生素,噬菌体能高效杀灭特定细菌,且不影响正常菌群生长,而且噬菌体能有效规避因使用抗生素而造成的细菌耐药性问题。研究结果表明,寄生在大肠杆菌中的噬菌体能有效杀死耐药菌株,可作为新型的杀菌制剂,市场应用前景广阔。本试验以来源于猪养殖场的mcr-1阳性大肠杆菌为宿主菌,分离对其具有杀灭作用的裂解性噬菌体,研究该噬菌体的生物学特性,以期为mcr-1阳性大肠杆菌的防控提供新思路和有效的技术手段。
1 材料和方法
1.1 主要试剂和仪器
LB培养基参照Sambrook等[10]配制,PEG8000和蛋白酶K购于美国Amresco公司,DNase I和RNaseA购于Sigma-Aldrich公司,Hind III购于日本TOYOBO公司。
1.2 菌株和污水
mcr-1阳性大肠杆菌SQ-P -E32分离自江苏宿迁某猪养殖场的猪粪便样本,污水取自该养殖场的粪水。mcr-1阳性大肠杆菌及mcr-1阴性大肠杆菌临床株为本实验室分离保藏菌株,宿主来源为猪。
1.3 噬菌体的分离和纯化
参照Sambrook等[11]的方法取猪场污水。将样品在4 ℃温度下以4 000g离心15 min后取上清液,经0.22 μm滤膜除去杂质和细菌。取10 ml上述滤液加入10 ml 2×LB、1 ml对数生长期mcr-1阳性大肠杆菌SQ-P-E32菌悬液和适量CaCl2液体,并最终将CaCl2浓度调为1 mmoL/ml。静置15 min后转至37 ℃摇床(160 r/min)振荡培养12 h。将所得培养物于4 ℃温度下以10 000g离心10 min后取上清液,经0.22 μm滤膜后即得SQ-P-E32菌对应的噬菌体原液。
采用双层平板法[12]检测和筛选裂解性噬菌体。取上述原液0.1 ml,适当稀释后加入宿主菌悬液0.1 ml。静置数分钟后加入3.5 ml 50 ℃左右的0.6% LB半固体培养基,混匀平铺至LB固体培养基上。37 ℃培养6~8 h后观察噬菌斑生长情况。若有噬菌斑,挑取单个形态均匀、清晰无晕环的菌斑,溶于含有0.9 ml 缓冲液的无菌EP管中,加氯仿,放置1 h,4 ℃过夜。次日取0.1 ml上述溶液适当稀释,与宿主菌做双层平板。如此重复7~8次,即可获得纯种噬菌体。
1.4 噬菌体的透射电镜分析
参照文献[11]的方法,将经聚乙二醇沉淀法纯化后的噬菌体滴在铜网上, 10 min后用滤纸从侧面吸干铜网上的多余液体。加一滴2%磷钨酸(PTA,pH=7.0)于铜网,染色10 min后将铜网放于干燥滤纸上,自然干燥后电镜观察。
1.5 噬菌体的基因组分析
参照文献[11]的方法,向经聚乙二醇沉淀法纯化后的噬菌体悬液中加入DNase Ⅰ和RNase A至终浓度均为1 μg/ml,37 ℃温育30 min。加蛋白酶K(终浓度为50 μg/ml)及SDS(终浓度为0.5%,质量体积比),混匀后56 ℃水浴过夜。次日,向消化液中加等体积的苯酚∶氯仿∶异戊醇(25∶24∶1),反复抽提2次,收集亲水相,再用氯仿抽提1次后,用无水乙醇沉淀核酸。所得核酸沉淀用70%乙醇洗涤后溶于超纯水中待用。
将提取的核酸用DNase I、RNase A和Mung Bean Nuclease进行处理,同时使用DNA限制性内切酶EcoR I和Hind Ⅲ 酶切,对产物做琼脂糖凝胶电泳分析。根据酶消化处理结果确定噬菌体基因组核酸类型,根据酶切结果初步估算其核酸大小。
1.6 噬菌体最佳感染复数的测定
感染复数(Multiplicity of infection,MOI)为感染初期加入噬菌体的数量与宿主菌数量的比值。具体操作参照Lu等[13]的方法。首先选取分离出的宿主菌的单菌落,将其接种在新鲜的LB液体培养液中培养至对数生长期。将细菌的浓度调整为1.0×108CFU/ml。按照MOI分别为0.01,0.10,1.00,10.00, 100.00和1 000.00将相应数量的噬菌体液加入到已准备好的宿主菌液中并充分混匀。之后将所得混合菌液置于37 ℃摇床160 r/min震荡培养5 h。用双层琼脂平板法测定裂解液中噬菌体的效价,产生最高效价的感染复数即为最佳MOI。同样条件下试验重复3次,每组2个重复。
1.7 噬菌体一步生长曲线的测定
一步生长曲线(One step growth curve)的测定参照Weiss等[14]的方法,略有改动。取对数生长期的大肠杆菌SQ-P-E32的悬液,调整浓度至1×108CFU/ml。向宿主菌菌液中以MOI=100加入噬菌体,37 ℃孵育15 min后12 000 r/min离心1 min,弃掉上清液,用新鲜的LB液体洗涤1次后再弃上清液。等体积加入37 ℃预热的LB液体培养基,重悬沉淀后充分混匀,迅速置于37 ℃摇床160 r/min振荡培养。同时开始计时,在0时刻取样1次,以后每隔10 min取样1次,共取9次。采用双层琼脂平板法测定噬菌体的效价(滴度)。以感染时间为横坐标,噬菌体效价为纵坐标,绘制噬菌体的一步生长曲线,估算出噬菌体的潜伏期、爆发期、爆发量。分别设置无噬菌体宿主菌培养液和无宿主菌噬菌体培养液作为对照。同样条件下试验重复3次,每组2个重复。
1.8 噬菌体热稳定性测定
取效价为6×108PFU/ml的mcr-1噬菌体悬液分别于30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的水浴锅中分别作用30 min和60 min后,利用双层琼脂平板法测定处理后的噬菌体效价。同样条件下试验重复3次,每组2个重复。
1.9 噬菌体pH稳定性测定
取10份体积为100 μl效价为6×108PFU/ml噬菌体悬液分别放于pH值分别为2、3、4、5、6、8、9、10、11和12的胰蛋白胨水(900 μl)中,37 ℃作用2 h。利用双层平板试验测定处理后的噬菌体,37 ℃培养过夜。同样条件下试验重复3次,每组2个重复。
1.10 噬菌体裂菌效力测定
1.10.1 噬菌体体外裂解动力学 将宿主菌培养至对数生长期(OD600值为0.45,约2.0×108CFU/ml)分别按MOI为0,0.01,0.10,1.00,10.00,100.00加入噬菌体并于37 ℃摇床(160 r/min)中培养,每组设置3个重复。以未加噬菌体的细菌培养液为对照,每30 min测定各组OD600值,测定总时长为5 h。以此观察噬菌体在不同时刻对细菌的裂解效力。
1.10.2 噬菌体裂解效力评定 取对数生长期宿主菌,分别按MOI为0,0.01,0.10,1.00,10.00,100.00加入噬菌体并于37 ℃摇床(160 r/min)中培养,每组设置3个重复。分别于0 h和5 h时利用平板涂布法测定各组样品中宿主菌的浓度,以观察噬菌体的杀菌效力。
1.11 噬菌体宿主谱分析
采用点样法,测定噬菌体对大肠杆菌的裂解活性。将31株来自江苏地区3个不同猪养殖场的大肠杆菌菌株过夜培养,其中包括26株mcr-1阳性菌株,5株mcr-1阴性菌株,分别取100 μl菌液加入到1.2%固体培养基中,涂布棒涂布均匀,待菌液干后,取10 μl噬菌体悬液滴加到不同的平板上,37 ℃培养过夜,观察有无透亮斑出现。
2 结果与分析
2.1 噬菌体的分离纯化及透射电镜观察
本试验以mcr-1阳性大肠杆菌SQ-P-E32为宿主菌,经过双层平板法反复纯化噬菌斑4~5次后便能得到纯化的噬菌体,命名为vB-EcoP-32。其噬菌斑形态如图1所示,噬菌体对宿主菌可形成圆形(直径1~2 mm)、边缘整齐无晕环的噬菌斑,属于典型的裂解性噬菌体特征。

图1 噬菌体vB-EcoP-32噬菌斑Fig.1 Plaques of bacteriophage vB-EcoP-32
2.2 噬菌体的透射电镜形态
从透射电镜图(图2)可见,噬菌体vB-EcoP-32头部呈圆柱状,长约100 nm,直径约40 nm;其尾部较短,长约15 nm,直径约10 nm。根据国际病毒分类学组织(International committee on taxonomy of viruses,ICTV)病毒分类第8次报告,可初步将vB-EcoP-32噬菌体归类为短尾噬菌体科。

图2 噬菌体vB-EcoP-32透射电镜形态 (Bar=100 nm)Fig.2 Transmission electron microscope of bacteriophage vB-EcoP-32 (Bar=100 nm)
2.3 噬菌体的基因组酶切分析
噬菌体vB-EcoP-32基因组仅能够被DNase I消化,而不能够被RNase A和Mung Bean Nuclease消化,说明该噬菌体基因组为双链DNA。通过限制性核酸内切酶EcoR I 和Hind Ⅲ对噬菌体基因组进行酶切(图3),根据酶切条带与DNA marker的关系,初步估算该噬菌体基因组的分子量约为50 kb,其确切的分子量大小还需要通过全基因组测序才能确定。
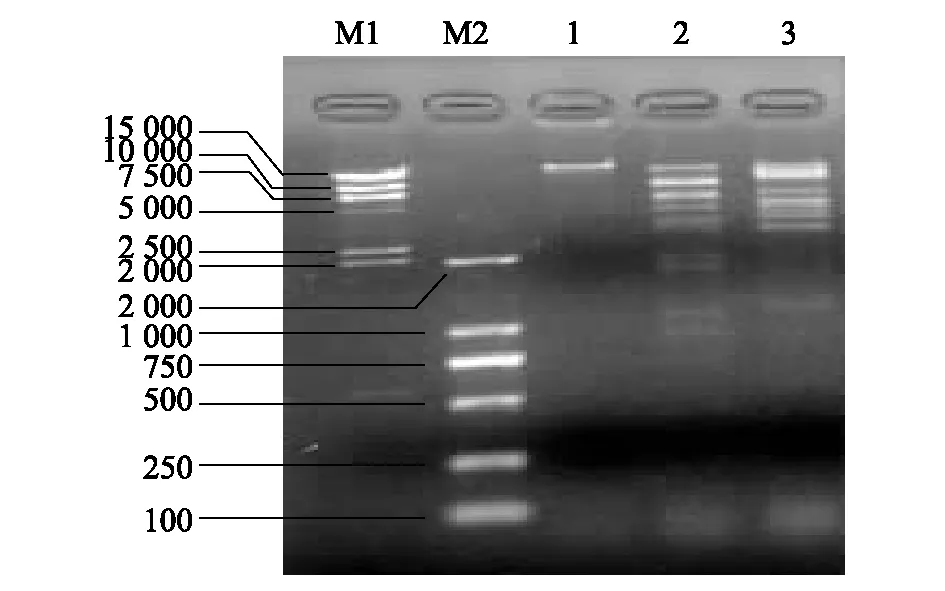
泳道M1和M2分别为15 kb 和 2 kb Marker,泳道1为噬菌体vB-EcoP-32基因组,泳道2和3分别为噬菌体vB-EcoP-32基因组被EcoR I 和 Hind Ⅲ消化后的产物。图3 噬菌体vB-EcoP-32基因组限制性内切酶酶切图谱Fig.3 Electrophoresis of bacteriophage vB-EcoP-32 genome digested with EcoR I and Hind Ⅲ
2.4 噬菌体最佳感染复数
3次重复试验取平均值,由表1可知,当MOI=100.00时,噬菌体感染宿主后产生的子代噬菌体滴度为 1.2×1012PFU/ml,是所测的6个感染复数中最高的。因此,该噬菌体最佳感染复数为100.00。
表1噬菌体最佳感染复数的测定
Table1Determinationofoptionalmultiplicityofinfection

感染复数(PFU/CFU)子代噬菌体滴度(PFU/ml)1000.009.0×1011100.001.2×101210.008.4×10111.005.2×10110.104.0×10110.012.1×1011
2.5 噬菌体一步生长曲线的测定
由图4可知,vB-EcoP-32噬菌体感染宿主菌的潜伏期约为5 min,爆发期约为55 min。在爆发期噬菌体的效价为 1.8×107,细菌的浓度为 5.5×105,噬菌体的裂解量约为32。

图4 噬菌体一步生长曲线Fig.4 One-step growth curve
2.6 噬菌体热稳性
由图5可知,噬菌体vB-EcoP-32经30 ℃、40 ℃、50 ℃处理30 min和60 min后其效价基本较稳定,能保持原活性。在60 ℃温度下分别作用30 min和60 min后,其效价有所下降,但均能保持在106PFU/ml以上。经70 ℃处理后噬菌体的效价明显下降。经80 ℃处理30 min后,噬菌体完全失活,说明高温会严重影响噬菌体的活性。综上,噬菌体在 30~60 ℃活性较稳定。
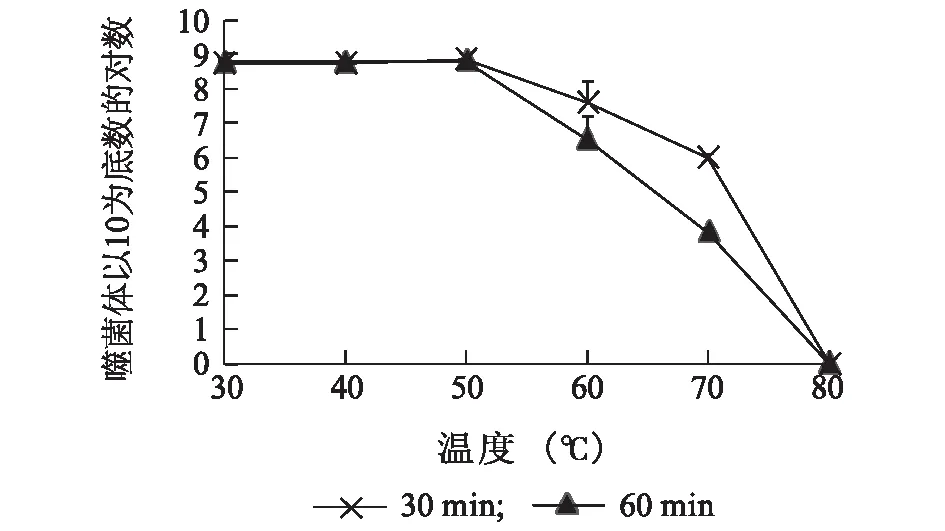
图5 温度耐受能力Fig.5 Tolerance to temperatures
2.7 噬菌体pH值稳定性
由图6可知,当培养液pH值在5~10时,噬菌体效价较稳定,基本上能保持原活性。当培养液的pH值小于5或pH值大于10时,噬菌体的活力会随着酸性或碱性的增强而逐渐降低。当pH值小于3或者大于11时噬菌体完全失活。这说明过酸和过碱都会造成噬菌体活性降低,甚至使噬菌体完全失活。

图6 酸碱的耐受能力Fig.6 Tolerance to acidity and alkalinity
2.8 噬菌体裂解效力
2.8.1 不同MOI值时细菌数量的动态曲线 由图7可知,当MOI=0时,宿主菌培养液中不含噬菌体,该组样品OD600随着时间变化呈现明显的指数型上升趋势,最后趋于稳定。表明该组细菌在无噬菌体存在的情况下呈指数型扩增,最后受环境限制而趋于稳定。而当MOI为0.01、0.10、1.00、10.00、100.00时,各组OD600均呈先上升后下降最后趋于稳定的趋势。感染初期噬菌体对细菌生长影响较小,但随着噬菌体的不断复制,裂解细菌后,细菌的增殖逐渐受到抑制,最终各处理组细菌均逐渐趋于消亡。另外,当MOI值越大时,OD600下降到最低所需的时间越短,说明噬菌体对细菌的杀菌效果越明显。本试验中,MOI为100.00时,裂解效果最佳。

图7 噬菌体裂解细菌的动态曲线Fig.7 Lytic kinetics of bacteriophage vB-EcoP-32
2.8.2 不同MOI值时噬菌体的杀菌效果 由图8可得,对照组中细菌以MOI为0、0.01、0.10、1.00、10.00、100.00加入噬菌体并培养5 h后,各组培养液中细菌的数量较0 h均有所下降。处理5 h后,MOI值为0.01处理组中的细菌数量较对0 h下降了约0.80lg,MOI值为0.10处理组中的细菌数量较对0 h下降了约1.88lg,MOI值为1.00处理组中的细菌数量较对0 h下降了约3.33lg,MOI值为10.00处理组中的细菌数量较对0 h下降了约4.05lg,MOI值为100.00处理组中细菌数量较0 h下降了约5.60lg。随着MOI值的增加,5 h时的细菌数量较0 h下降幅度逐渐增大,表明高浓度的噬菌体杀菌效果要优于低浓度噬菌体。

不同小写字母表示差异显著(P<0.05)。图8 不同MOI值时噬菌体杀菌效果评价Fig.8 Value of sterilization ability of bacteriophage in different MOI
2.8.3 噬菌体的裂解谱 通过点样试验,发现噬菌体vB-EcoP-32能有效杀灭31株猪源大肠杆菌中的19株,杀菌率为61.3%,这19株猪源大肠杆菌有16株为mcr-1阳性大肠杆菌,其余3株为mcr-1阴性大肠杆菌,分别来源于猪场I(7株)、猪场II(5株)和猪场III(7株)3个养殖场,说明噬菌体vB-EcoP-32为宽宿主谱的大肠杆菌裂解性噬菌体,对猪源大肠杆菌(包括mcr-1阳性菌株)具有较好的杀灭作用。
3 讨 论
3.1 噬菌体的分离与鉴定
噬菌体广泛存在于自然界的土壤、废水中,寄生于其对应的宿主菌中。因为噬菌体只能利用宿主菌中的营养物质进行生命活动,离开宿主菌后就不能生长和复制。在本研究中,分离纯化初期的噬菌斑呈蚕噬状、大小不一,表明此时培养基中还含有其他噬菌体[15],但经过数次纯化后噬菌斑形态大小才变得较为一致。透射电镜图显示该噬菌体尾长仅为15 nm,较张培东等[16]报道的尾长为100 nm的大肠杆菌噬菌体Bp6不同,其圆柱状的头部较代保英等[17]报道的多面体头部的大肠杆菌噬菌体BpD也不同,说明不同地区分离的大肠杆菌噬菌体形态有所差异。通过透射电镜图显示的噬菌体的外形特征,可初步判断该噬菌体属于短尾噬菌体科,并且其噬菌斑透亮、边缘整齐,说明该噬菌体为裂解性噬菌体。根据该噬菌体基因组被DNase I、RNase A和Mung Bean Nuclease消化的情况,可判定该噬菌体为双股DNA噬菌体。
3.2 噬菌体的生物学特性与裂解效力评价
不同的噬菌体,其生物学特性也不尽相同[18],掌握特定噬菌体的生物学特性对于其相关的研究及应用具有重要的指导意义。最佳感染复数对于经济高效地获得噬菌体产量具有重要指导意义。本研究中,噬菌体vB-EcoP-32对于其宿主菌的最高感染复数为100,与杜崇涛[19]报道的大肠杆菌0157的噬菌体DLS48(最佳MOI=0.1)和王礼伟等[20]报道的大肠杆菌噬菌体EcP10(最佳MOI=1.0)的结果相差较大。这可能是因为本研究中噬菌体属于裂解性噬菌体中较为温和的一类,其感染和复制的进程都较慢。Abedon等[21]提出,每一个细菌对噬菌体敏感度不一样,每个噬菌体感染细菌的能力也不一样,因此在噬菌体疗法试验中,不宜把MOI作为确定噬菌体最佳给药剂量的唯一指标。
动物养殖上大量使用抗生素导致的耐药细菌出现与流行对动物的健康养殖造成巨大威胁,而携带多黏菌素耐药基因mcr-1的大肠杆菌的出现更是对公共卫生和人类健康提出了严峻挑战。相比于抗生素,噬菌体能高效杀灭特定细菌,且不影响正常菌群生长,而且噬菌体能有效规避因使用抗生素而造成的细菌耐药性问题。基于此,本研究分离了对mcr-1阳性大肠杆菌具有裂解性的噬菌体,通过研究其生物学特性,以期为mcr-1阳性大肠杆菌的防控提供新思路和有效的技术手段。本研究中噬菌体裂解细菌动态图显示,在加入噬菌体后,各处理组细菌数量下降明显,而对照组居高不下,噬菌体添加浓度越大,其灭菌效率越高。研究发现大肠杆菌K88对应噬菌体K88-4[22]的MOI值为0.0 001时5 h内细菌浓度下降4lg,MOI值为1时杀菌效果为100%。本研究中,当MOI值为100时相同时间内细菌浓度下降了约5lg,并且细菌数量逐渐趋于稳定。本研究中噬菌体对来自3个养殖场的31株猪源大肠杆菌杀菌率高达61.3%。该噬菌体的杀菌效果如此显著,其对于开发耐药细菌的噬菌体疗法的意义不言而喻。但有学者[23]发现,自然界还存在着耐噬菌体的菌株,这也意味者噬菌体疗法并不能一劳永逸。人类与致病菌的斗争还将继续,噬菌体疗法还有待于进一步的研究与改进。
参考文献:
[1] KARCH H, TARR P, BLELASZEWSKA M, et al. EnterohaemorrhagicEscherichiacoliin human medicine [J]. International Journal of Medical Microbiology Ijmm, 2005, 295(7): 405-418.
[2] STOJANOSKI V, SANKARAN B, PRASAD B V V, et al. Structure of the catalytic domain of the colistin resistance enzyme MCR-1 [J]. Bmc Biology, 2016, 14(1): 81-91
[3] BIALVAEI A Z, SAMADI K H. Colistin, mechanisms and prevalence of resistance [J]. Current Medical Research and Opinion, 2015, 31(4): 707-721.
[4] LANDMAN D, GEORGESCU C, MARTIN D A, et al. Polymyxins revisited [J]. Clinical Microbiology Reviews, 2008, 21(3): 449-465.
[5] LI J, RAYNER C R, NATION R L, et al. Heteroresistance to colistin in multidrug-resistantAcinetobacterbaumannii[J]. Antimicrobial Agents & Chemotherapy, 2006, 50(9): 2946-2950.
[6] KEMPF I, FLEURY M A, DRIDER D, et al. What do we know about resistance to colistin in Enterobacteriaceae in avian and pig production in Europe? [J]. International Journal of Antimicrobial Agents, 2013, 42(5): 379-383.
[7] LIU Y Y, WANG Y, WALSH T R, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study [J]. The Lancet Infectious Diseases, 2016, 16(2): 161-168.
[8] HU Y, LIU F, LIN I Y, et al. Dissemination of themcr-1 colistin resistance gene [J]. Lancet Infectious Diseases, 2015, 16(2): 146-147.
[9] H B. Phage therapy: theEscherichiacoliexperience [J]. Microbiology, 2005, 151(7): 2133-2140.
[10] 韩 晗,李雪敏,王 爽,等.噬菌体作抗菌剂使用的安全性评价研究进展[J].江苏农业科学,2017,45(22):18-23.
[11] SAMBROOK J, RUSSELL D W.分子克隆实验指南[M].3版. 黄培堂,王恒梁,周晓巍译.北京:科学出版社,2002.
[12] SUMMERS W C. Bacteriophage therapy [J]. Annual Review of Microbiology, 2001, 55(2): 437-451.
[13] LU Z, BREIDT F, FLEMING H, et al. Isolation and characterization of aLactobacillusplantarumbacteriophage, ΦJL-1, from a cucumber fermentation [J]. International Journal of Food Microbiology, 2003, 84(2): 225-235.
[14] WEISS B D, KESSEL M, BENSON S. Isolation and characterization of a generalized transducing phage forXanthomonascampestrispv. campestris [J]. Journal of Bacteriology, 1994, 176(11): 3354-3359.
[15] ADIBI M, MOBASHER N, GHASEMI Y, et al. Isolation, purification and identification ofE.coliO157 phage for medical purposes [J]. Trends in Pharmaceutical Sciences, 2017, 3(1): 43-48.
[16] 张培东,孙 岩,任慧英. 大肠杆菌的分离及其生物学特性 [J]. 中国兽医杂志, 2008, 44(4): 10-12.
[17] 代保英. 大肠杆菌K88噬菌体的分离、分类初步鉴定和生物学特性的测定[D].扬州:扬州大学, 2009.
[18] 王 冉,韩 晗,张 辉. 大肠杆菌K88噬菌体的分离鉴定及其生物学特性 [J]. 华北农学报, 2012, 27(4): 163-167.
[19] 杜崇涛. 大肠杆菌O157噬菌体的分离鉴定及其初步应用[D].吉林: 吉林大学,2008
[20] 王礼伟,梁 晏,屈勇刚. 一株鸡源致病性大肠杆菌噬菌体的分离及其生物学特性 [J]. 江苏农业学报, 2014, 30(2): 455-457.
[21] ABEDON S T. Phage therapy pharmacology: calculating phage dosing[M].Elsevier Science & Technology, 2011,77(77):1-40.
[22] 韩 晗. 产肠毒素性大肠杆菌噬菌体PK88-4的分离及其抗菌效果与安全性的研究[D].南京: 南京农业大学,2011.
[23] PARK S C, SHIMAMURA I, FUKUNAGA M, et al. Isolation of bacteriophages specific to a fish pathogen,Pseudomonasplecoglossicida, as a candidate for disease control [J]. Applied & Environmental Microbiology, 2000, 66(4): 1416-1422.
