氧化胁迫对粉红螺旋聚孢霉生长和产厚垣孢子的影响
2018-05-07王琦冯静红孙占斌姜维治李世东孙漫红马桂珍
王琦 冯静红 孙占斌 姜维治 李世东 孙漫红 马桂珍
(1. 淮海工学院,连云港 222005;2. 中国农业科学院植物保护研究所,北京 100193)
在某些特定条件下,一些真菌的原生质体浓缩、细胞壁加厚,形成一种特殊的抗性结构——厚垣孢子。目前,有关厚垣孢子的形成机制尚不明确。有研究证明,通过改变环境条件,如温度和通气量等,能够诱导真菌厚垣孢子的产生[1-2]。当环境不利于真菌生长时,营养菌丝转化成厚垣孢子使菌体存活,待条件适宜时,厚垣孢子萌发,真菌继续生长。因此,这种结构能抵御外界不良环境,对真菌的生长和存活具有十分重要的意义[3-4]。
环境中氧气水平改变时会引起细胞内活性氧(Reactive oxygen,ROS)的变化。活性氧是生物体内一类具有强氧化、还原能力的氧自由基和含氧衍生物,主要包括过氧化氢(H2O2)、超氧阴离子自由基(O2-·)和羟基自由基(OH·)。低浓度下,活性氧作为信号分子在促进真核细胞生长、诱导细胞凋亡以及细胞抗氧化胁迫中发挥着积极作用[5-6]。但是当活性氧浓度超出机体抗氧化防御能力时,就会产生氧化胁迫(oxidative stress),损伤细胞活性,破坏细胞的生长与代谢[7-8]。氧化胁迫的大小与活性氧类型密切相关,Watts等[9]发现H2O2对E. coli细胞毒性最强,OH· 毒性最弱。不同作用时间作用效果也不相同,燕国梁等[10]发现接种前添加H2O2能刺激芽孢杆菌生长,而对数期添加则抑制细菌生长。微生物在适应氧化胁迫的过程中,会表现出不同的生理应答反应,如促使细胞分化、合成抗氧化物酶等[11-13]。Alonso-Monge等[14]发现,严重缺氧条件下白色念珠菌(Candida albicans)可以产生厚垣孢子。但迄今,有关氧化胁迫对丝状真菌厚垣孢子形成的影响还未见报道。
粉红螺旋聚孢霉(Clonostachys rosea,异名:粉红黏帚霉,Gliocladium roseum)是一类重要的生防真菌,可以防治多种植物真菌病害[15-17]。前期研究发现,一定条件下粉红螺旋聚孢霉可以产生厚垣孢子。与分生孢子相比,厚垣孢子抗逆性增强,并且在土壤中萌发率显著提高[18],对提高粉红螺旋聚孢霉生防制剂货架期和防效稳定性具有重要意义。本实验以粉红螺旋聚孢霉高效菌株67-1为材料,通过改变液体培养通气条件以及添加不同种类的活性氧,研究氧化胁迫对67-1菌丝生长和产厚垣孢子的影响,旨在探讨活性氧水平与厚垣孢子形成之间的关系,为生防真菌厚垣孢子制剂研发和今后厚垣孢子形成机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 粉红螺旋聚孢霉67-1,中国农业科学院植物保护研究所土传病害生防实验室保存。
1.1.2 液体培养基 葡萄糖25 g,酵母粉7.2 g,K2HPO41 g,MgSO40.5 g,FeSO40.05 g,ZnSO4·7 H2O 0.05 g,蒸馏水1 L。装液量为100/500 mL。
1.2 方法
1.2.1 液体培养 将67-1菌株在PDA 平板上28℃培养7 d,加入5 mL 无菌水,洗脱孢子,制备浓度为107/mL 的孢子悬液。吸取2 mL 孢子悬液接种于种子培养基中,28℃、180 r/min 振荡培养48 h,按2%接种量接种进行扩大培养。28℃、180 r/min 恒温振荡培养72 h。
1.2.2 装液量对67-1 菌丝生长及产厚垣孢子的影响 三角瓶中液体培养基装量分别设定为20%、70%、80%、90%和100%,28℃、180 r/min 培养。48 h 观察不同装液量中67-1菌丝生长状态,72 h血球计数板测定厚垣孢子和分生孢子的数量。每个装液量3个重复。
1.2.3 H2O2对67-1菌丝生长及产厚垣孢子的影响 分别在菌株接种前和培养16 h后向液体培养基中添加H2O2,接种前添加浓度分别为5、6、7、8和9 mmol/L,培养16 h 添加浓度分别为62、64、66和68 mmol/L,28℃下180 r/min 培养,观察菌丝生长状况,测定产孢数量。每个处理3个重复。
1.2.4 甲萘醌对67-1菌丝生长及产厚垣孢子的影响 称取一定量的甲萘醌溶于1 mL 丙酮溶液,然后加到100 mL 的液体培养基中。分别在接种前和培养16 h 后添加甲萘醌,接种前添加浓度分别为210、220、230、240和250 μmol/L,培养过程中添加浓度分别为 200、350 和 500 μmol/L。28℃、180 r/min 培养,测定67-1生长和产孢情况。培养基中添加1 mL丙酮溶液作为对照,每个处理3个重复。
1.2.5 OH· 对67-1菌丝生长及产厚垣孢子的影响 液体培养基中加入0.278 g/L FeSO4· 7 H2O,以及不同浓度的H2O2,建立Fe2+-H2O2体系,通过Fenton 和Harber-weiss 反应生成羟基自由基。H2O2添加时间和添加量分别选取接种前5个浓度,1、2、3、4和5 mmol/L,培养16 h 后添加浓度为43、49、55和58 mmol/L。以只添加FeSO4· 7 H2O为对照,28℃、180 r/min 培养72 h。每个处理3个重复。
1.2.6 统计分析 利用SPSS 13.0 统计软件对实验数据进行差异显著性分析。
2 结果
2.1 通气量对67-1菌丝生长及产厚垣孢子的影响
减少通气量能够抑制67-1菌丝生长和厚垣孢子形成。当摇瓶中发酵液装量≤80% 时,菌丝生长正常。当装液量达到90% 时,菌丝成束,极少产生分枝,厚垣孢子数量显著降低,但占总孢子数的比例提高。当瓶中没有多余空间时,菌丝生长受到严重抑制,仅形成极短的菌丝段,无孢子产生(图1,表 1,图 2)。

图1 不同装液量对67-1菌丝生长的影响

表1 不同装液量对67-1生长的影响

图2 不同装液量对67-1产厚垣孢子的影响
2.2 H2O2对67-1菌丝生长及产厚垣孢子的影响
培养过程中添加H2O2对67-1生长和产孢均有显著影响。随着添加浓度的增加,67-1生物量迅速下降。接种前添加5-6 mmol/L H2O2,其厚垣孢子数量较对照(3 × 106/mL)显著增加(P< 0.05)。当浓度达到7 mmol/L 时,厚垣孢子数量显著下降,但其比例增加(P< 0.05)。浓度达到 9 mmol/L 时,67-1生长和产孢完全受到抑制。真菌孢子萌发后(16 h)对H2O2的耐受力增强,浓度超过60 mmol/L 时,开始出现明显的抑制,但在60-64 mmol/L 范围内厚垣孢子比例显著上升(P< 0.05,表2,图3,图6)。

表2 不同浓度H2O2 对67-1生长的影响
2.3 甲萘醌对67-1菌丝生长及产厚垣孢子的影响
当甲萘醌浓度大于210 μmol/L 时,67-1菌丝生长和产孢受到明显抑制,但在一定范围内厚垣孢子的比例随甲萘醌浓度的增加而增大。67-1培养过程中(16 h)菌丝对超氧阴离子自由基的耐受浓度较接种体(孢子)增加1倍,此时加入350 μmol/L 的甲萘醌,对厚垣孢子生成表现出明显的促进作用,并且厚垣孢子比例最高(P< 0.05,表3,图4,图6)。

图3 发酵液中添加H2O2对67-1产厚垣孢子的影响

表3 不同浓度甲萘醌对67-1生长的影响
2.4 羟基自由基对67-1菌丝生长及产厚垣孢子的影响
一定浓度的OH·能显著提高67-1产厚垣孢子能力。在Fe2+-H2O2体系中,接种前添加1-5 mmol/L H2O2,67-1菌丝生长旺盛,厚垣孢子显著增加,浓度为3 mmol/L 时产孢水平提高6倍以上。培养16 h后添加43-55 mmol/L H2O2厚垣孢子产量和比例显著提高(P< 0.05,表 4,图 5,图 6)。

图4 不同时期添加不同浓度甲萘醌对67-1产厚垣孢子的影响

表4 Fe2+-H2O2体系中添加不同浓度的H2O2对67-1生长的影响
3 讨论

图5 不同时期添加不同浓度羟基自由基对67-1产厚垣孢子的影响
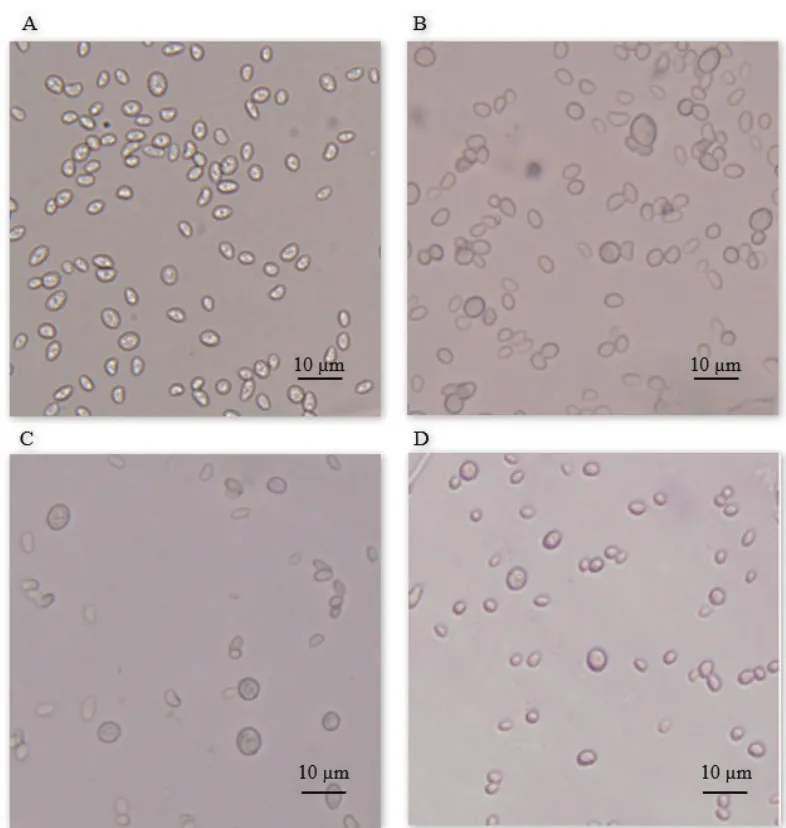
图6 不同种类活性氧对67-1厚垣孢子形成与形态的影响
通过改变装液量调节液体培养基中氧气含量,研究低氧胁迫下粉红螺旋聚孢霉67-1生长和产厚垣孢子的变化。装液量越大,氧含量越低,低氧胁迫越高。结果表明,菌丝和孢子都可以耐受一定程度的低氧胁迫,菌丝生长和产孢能力变化不大,但是当低氧胁迫超过某一阈值时,菌丝生长状态改变,厚垣孢子产量显著降低。赵文婧[19]研究发现,处于低氧胁迫环境下汤姆青霉(Penicillium thomii)菌丝分化形成大量的菌核,在67-1培养过程中发现,氧气缺乏会造成菌丝分枝明显减少,形成大量的菌丝束。这可能是由于不同微生物应对低氧胁迫表现的生理性应答不同。在低氧状态下,菌体细胞代谢途径可能发生改变,能量供应不足,有毒物质大量积累[20],使菌株正常生长发育受到干扰。
添加一定浓度的H2O2、甲萘醌和羟基自由基,可以促进粉红螺旋聚孢霉厚垣孢子的形成,但是会一定程度抑制菌丝的生长,推测在不同类型活性氧的刺激下真菌菌丝大量转化成厚垣孢子来度过不良环境。厚垣孢子是真菌的一种休眠体结构,通常在逆境条件下产生,具有较强的适应和抗逆能力。粉红螺旋聚孢霉受到氧化胁迫刺激后,通过产生厚垣孢子,维持自身的存活。
厚垣孢子的抗逆性可能与其细胞壁结构密切有关。厚垣孢子细胞壁由内外两层壁组成,燕玮婷[21]认为,水稻稻曲病菌的休眠特性与细胞壁中多糖含量较高有关。闫越[22]发现,随着培养时间的延长黄孢原毛平革菌(Phanerochaete chrysosporium)厚垣孢子的内层细胞壁不断增厚,其中含有较高浓度的多糖和蛋白,因而具有较强的抗压能力。我们推测67-1厚垣孢子的抗逆性也与其细胞壁结构相关,但尚需进一步证明。目前,关于粉红螺旋聚孢霉厚垣孢子形成机制还不明确,利用优化的条件为下一步深入研究厚垣孢子形成机制奠定了基础。
4 结论
氧化胁迫能够影响粉红螺旋聚孢霉菌丝生长状态和产厚垣孢子能力。氧环境下,菌丝分枝减少,厚垣孢子数量降低。发酵过程中添加一定浓度的活性氧可以促进粉红螺旋聚孢霉厚垣孢子的形成。
[1] Sancak B, Colakoglu S, Acikgoz ZC, et al. Incubation at room temperature may be an independent factor that induces chlamydospore production inCandida dubliniensis[J]. Diagnostic Microbiology & Infectious Disease, 2005, 52(4):305-309.
[2] 顾金刚, 律雪燕, 胡丹丹, 等. 长柄木霉ACCC30150与哈茨木霉ACCC30371产厚垣孢子的液体培养条件[J]. 中国生物防治学报, 2008, 24(3):253-256.
[3] Darmono TW, Parke JL. Chlamydospores ofPhytophthora cactorum:their production, structure, and infectivity[J]. Canadian Journal of Botany, 1990, 68(3):640-645.
[4] Armengol J, Sales R, Garciajimenez J. Effects of soil moisture and water on survival ofAcremonium cucurbitacearum[J]. Journal of Phytopathology, 1999, 147(12):737-741.
[5] Aguirre J, Ríosmomberg M, Hewitt D, et al. Reactive oxygen species and development in microbial eukaryotes[J]. Trends in Microbiology, 2005, 13(3):111-118.
[6] Abid MD, Chen J, Xiang M, et al. Khat(Catha edulis)generates reactive oxygen species and promotes hepatic cell apoptosis via MAPK activation[J]. International Journal of Molecular Medicine,2013, 32(2):389-395.
[7] 张文玲, 魏丽勤, 王林嵩, 等. ROS对生物大分子的氧化性损伤[J]. 河南师范大学学报:自然科学版, 2000, 28(4):69-71.
[8] 赵建云, 马会勤, 肖满, 等. 氧气胁迫对长双歧杆菌葡萄糖代谢关键酶基因表达的影响[J]. 食品工业科技, 2011, 32(10):220-224.
[9] Watts RJ, Washington D, Howsawkeng J, et al. Comparative toxicity of hydrogen peroxide, hydroxyl radicals, and superoxide anion toEscherichia coli[J]. Advances in Environmental Research, 2003,7(4):961-968.
[10] 燕国梁. ROS胁迫下Bacillussp. F26以过氧化氢酶合成为特征的应激响应[D]. 无锡:江南大学, 2006.
[11] Georgiou CD, Petropoulou KP. Effect of the antioxidant ascorbic acid on sclerotial differentiation inRhizoctonia solani[J]. Plant Pathology, 2010, 50(5):594-600.
[12] Xu N, Cheng X, Yu Q, et al. Aft2, a novel transcription regulator, is required for iron metabolism, oxidative stress, surface adhesion and hyphal development inCandida albicans[J]. PLoS One, 2013, 8(4):e62367.
[13] Zhao W, An C, Long D, et al. Effect of copper-induced oxidative stress on sclerotial differentiation and antioxidants contents ofPenicillium thomiiQ1[J]. Journal of Basic Microbiology, 2014,54(12):1395-1402.
[14] Alonso-Monge R, Navarro-García F, Román E, et al. The Hog1 mitogen-activated protein kinase is essential in the oxidative stress response and chlamydospore formation inCandida albicans[J].Eukaryotic Cell, 2003, 2(2):351-361.
[15] 张拥华, 李世东, 王桂琴, 等. 粘帚霉可湿性粉剂防治大豆菌核病试验[J]. 植物保护, 2007, 33(5):141-142.
[16] 潘玮. 绿色木霉厚垣孢子与分生孢子生物学特性及生防效果的比较研究[D]. 北京:中国农业科学院, 2006.
[17] 马桂珍, 王淑芳, 暴增海, 等. 粉红粘帚霉67-1菌株对水稻纹枯病的抑菌防病作用研究[J]. 作物杂志, 2011, 145(6):77-80.
[18] 董佩佩, 孙漫红, 李世东, 等. 粉红螺旋聚孢霉67-1厚垣孢子生物学特性的研究[J]. 菌物学报, 2014, 33(6):1242-1252.
[19] 赵文婧. 汤姆青霉PT95和Q1菌株对氧胁迫的细胞响应研究[D]. 太原:山西大学, 2014.
[20] 周灵芝. 低氧胁迫对厚皮甜瓜生长和产量的影响[D]. 南宁:广西大学, 2007.
[21] 燕玮婷. 水稻稻曲球及稻曲病菌厚垣孢子休眠特性研究[D].长沙:湖南农业大学, 2010.
[22] 闫越.Phanerochaete chrysosporium厚垣孢子的产生条件及其分化机制研究[D]. 新乡:河南师范大学, 2017.
