神经干细胞外泌体对低氧所致神经元凋亡的抑制作用*
2018-05-07魏红艳尹美娴胡春林卢远征孙占朋廖晓星
黎 博, 魏红艳, 杨 焰, 尹美娴, 胡春林, 卢远征, 孙占朋, 廖晓星△
(中山大学附属第一医院 1急诊科, 2卫生部辅助循环重点实验室, 广东 广州 510080)
神经干细胞(neural stem cells,NSCs)具有自我更新和多能分化潜能,在治疗缺血缺氧性脑病上有很大的前景[1]。外泌体(exosomes,Exo)是一种被细胞释放出细胞外的生物囊泡,介导细胞间的信息传递。几乎所有的哺乳动物干细胞都会释放外泌体,并具有其来源母细胞的某些特征。有大量文献报道干细胞释放的外泌体能作用于受损靶细胞产生治疗作用[2],而神经干细胞的外泌体是否能改善低氧状态下神经元的损伤尚未见相关报道。本文拟初步探讨神经干细胞分泌的外泌体是否能减少氯化钴(cobalt chloride,CoCl2)诱导的缺氧模型中神经元的凋亡,并促进神经元的存活。
材 料 和 方 法
1 动物
SPF级雌性SD大鼠(孕13.5 d)和SPF级SD大鼠新生鼠(0~1 d)均由中山大学中山医学院动物中心提供,许可证号为SCXK(粤)2011-0029。
2 主要试剂
DMEM/F12(1∶1)培养基、Neurobasal-A培养基、DMEM basic (1×) 高糖培养基、谷氨酰胺、胎牛血清、B27、表皮生长因子(epidermal growthfactor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、Accutase细胞消化液、胰蛋白酶和青、链霉素双抗购自Gibco;多聚L-赖氨酸、阿糖胞苷和CoCl2购自Sigma;免疫细胞化学染色用小鼠抗大鼠nestin和微管相关蛋白2(microtube-associated protein 2, MAP2)单克隆抗体,ALG-2相互作用蛋白X(ALG-2-interacting protein X, Alix)和肿瘤易感基因101(tumor susceptibility gene 101,TSG101)兔抗大鼠Western blot抗体购自Abcam;Hoechst 33342和TUNEL凋亡试剂盒购自Roche;CCK-8试剂盒购自Dojindo;BCA蛋白浓度测定试剂盒购自Thermo。
3 主要方法
3.1NSCs的提取、培养和鉴定 取孕13.5 d的SD大鼠胚胎,在冰PBS中机械分离海马组织,离心法收集细胞,并将其重悬于DMEM/F12(1∶1)培养基中,添加20 mg/L EGF、20 mg/L bFGF、1% B27、2 mmol/L谷氨酰胺、5×103U/L 青霉素和5 mg/L链霉素。细胞以2×108/L的密度种植在25 cm2培养瓶中,每2~3 d半量换液,根据细胞的生长情况5~7 d传代1次,传至第3代细胞用于实验。第3代NSCs培养7 d后在同样的培养基中种植在多聚赖氨酸包被的玻片上,约4 h细胞贴壁后,吸出培养基,用4%的多聚甲醛固定,用0.3%的Triton X-100通透细胞,并用10%的BSA封闭,用小鼠抗大鼠nestin抗体4 ℃作用16 h,用于标记NSCs的中间丝蛋白,再用荧光Ⅱ抗Alexa Fluor 594室温下作用2 h,用Hoechst 33342染核后,封片固定,用荧光显微镜检测。
3.2神经元的提取、培养和鉴定 取0~1 d的SD大鼠新生鼠,在冰PBS中机械分离大脑皮层组织,剪碎,0.125%胰蛋白酶消化后,离心法收集细胞,并将其重悬于DMEM basic (1×)高糖培养基中,添加试剂有10%胎牛血清和0.1%双抗。细胞以5×108/L种植在预先用多聚赖氨酸包被的6孔板中入细胞培养箱。4 h后,若细胞贴壁良好,可换为Neurobasal-A培养基,添加2% B27、1%的谷氨酰胺和标准半量的双抗。培养7 d后吸出培养基,用4%的多聚甲醛固定,用0.3%的Triton X-100通透细胞,并用10%的BSA封闭,用小鼠抗大鼠MAP2抗体4 ℃作用16 h,再用荧光Ⅱ抗Alexa Fluor 594室温下作用2 h,用Hoechst 33342染核后,封片固定,用荧光显微镜检测。
3.3外泌体的提取 神经干细胞培养至第3代后开始收集细胞上清液。将收集的上清液用0.22 μm过滤器过滤后,使用第1次超高速离心[使用70Ti定角转子,贝克曼超高速离心机(型号Optima L-100XP),离心参数设置为100 000×g,4 ℃,70 min],离心结束后移除上清液,底部留0.5 cm左右液体(第1次超高速离心可能看不到沉淀),用1 mL PBS清洗离心管侧壁,收取清洗离心管后的PBS,使用第2次超高速离心[换用SW40水平转子,贝克曼超高速离心机(型号Optima L-100XP),离心参数设置为100 000×g,4 ℃,70 min],离心结束后移除上清液,用100 μL的PBS重悬离心管底部沉淀,置于-80 ℃冰箱保存[3]。
3.4透射电镜制样 取10 μL外泌体样本加在200目铜网上待外泌体自行沉淀,30 min后用吸水纸吸去多余液体,滴加钨磷酸负染,3 min后用吸水纸吸去多余钨磷酸,即可以80 kV电压上机观察。
3.5实验分组 为探讨CoCl2对神经元存活率的影响,使用200、400和600 μmol/L 3种不同浓度的CoCl2干预24 h,诱导神经元缺氧损伤,探讨最佳致缺氧损伤浓度,建立神经元缺氧损伤模型。为探讨外泌体是否能促进损伤组神经元的存活并减少凋亡,将实验分为3组,分别为正常对照(control)组、400 μmol/L CoCl2+外泌体(CoCl2+Exo)组和400 μmol/L CoCl2+与外泌体等体积的PBS(CoCl2+PBS)组,后2组中的外泌体(35 mg/L)和PBS均在CoCl2造模24 h后替换培养基时加入,再干预24 h后换正常培养基并测神经元存活率和凋亡率。将提取的原代神经元以每孔1×107/L接种于96孔板,置于37 ℃、5% CO2条件下培养5 d,采用200、400和600 μmol/L不同浓度的CoCl2处理神经元24 h后与CCK-8共孵育4 h,用酶联免疫检测仪测定450 nm处吸光度(A),按公式计算神经元相对活力:相对活力(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
3.6qNano测外泌体粒径分布 安装纳米孔板,调试仪器至纳米孔板内无任何气泡。取1 μL标准颗粒,加专用Buffer 1 mL以稀释1 000倍,用0.22 μm滤器过滤后备用;取5 μL外泌体,加PBS 45 μL以稀释10倍,0.22 μm滤器过滤,即可加样上机测试,每次上样量为30 μL,测试粒子数量400个左右(本实验实际测试的粒子数量为370个)即可点击停止按钮,待仪器自动处理数据并生成粒径分布图。
3.7TUNEL法检测神经元凋亡 神经元接种于多聚赖氨酸包被的玻片上,加上述不同浓度的CoCl2处理24 h,4%多聚甲醛固定20 min,0.1% Triton X-100透膜,0.1%柠檬酸钠孵育后,用TUNEL混合液染色,再用Hoechst 33342染核,封片固定, 荧光显微镜检测凋亡。凋亡指数(%)=TUNEL阳性细胞数/总细胞数×100%。
3.8Western blot检测蛋白表水平 取外泌体20 μL进行SDS-PAGE分离蛋白,电转至PVDF膜上,5%脱脂奶粉封闭液封闭非特异性抗原结合位点后,加入Alix、TSG101抗体以及相应HRP标记的Ⅱ抗,ECL进行显色,暗室X胶片显影,拍照后进行条带灰度分析。
3.9BCA法测定蛋白浓度 BCA工作液根据待测孔数按A液∶B液=50∶1的比例配制;将蛋白标准品浓度稀释到 0.5 g/L,按 0、1、2、4、8、12、16和20 μL的量将标准品加入对应的孔中,加标准品稀释液到20 μL;每孔加 2 μL待测样品,加标准品稀释液到 20 μL;每孔加 200 μL BCA工作液,37 ℃孵育 30 min;用酶标仪测出各孔的A562,绘制标准曲线,计算蛋白量。
4 统计学处理
数据用SPSS 22.0软件分析。计量资料表示方法为均数±标准差(mean±SD),两组间比较采用Student’st检验,多组间计量资料比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 大鼠胚胎海马组织来源的NSCs培养和鉴定
大鼠胚胎海马组织来源的NSCs在DMEM/F12(1∶1)完全培养基中可迅速增殖,培养3~5 d后可形成神经球。免疫荧光染色示我们提取的细胞可表达nestin,这表明我们提取的细胞具有NSCs特性,见图1。
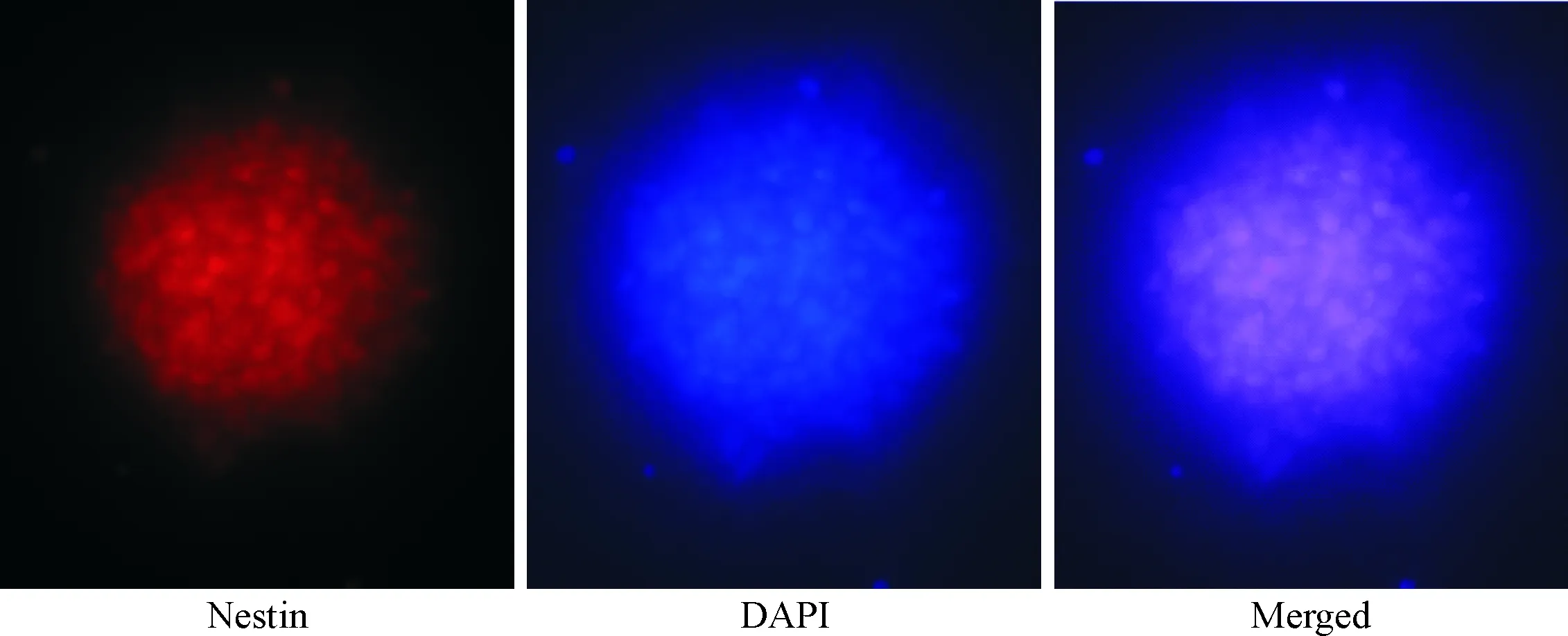
Figure 1. Identification of the cultured NSCs by observing the immunofluorescence of nestin (×400).
图1神经干细胞的nestin免疫荧光鉴定图
2 SD大鼠新生鼠的神经元培养和鉴定
新生鼠原代神经元接种 4 h 后贴壁良好,在倒置显微镜下可观察到贴壁细胞呈圆形,折光性好,表面光滑;之后神经元逐渐长出轴突与树突;4~5 d 时细胞间的轴突、树突相互交织形成神经网络。免疫荧光染色示我们提取的细胞可表达MAP2,这表明我们提取的细胞具有神经元特性,见图2。
3 NSCs来源外泌体的特征鉴定和蛋白浓度测定
NSCs传至第3代以后开始收集细胞培养基的上清液,按上述方法提取外泌体。在透射电镜下观察外泌体的形态呈“杯口”状,见图3A,直径约100 nm;Western blot显示外泌体表面可表达Alix和TSG101这2种表面分子标志物,见图3B;qNano测外泌体的粒径分布,粒径为(95.0±23.5) nm (n=370),见图4。经BCA法蛋白浓度测定得知90 mL的神经干细胞上清液可提取出的外泌体平均蛋白浓度为(699.4±40.2) mg/L (n=3)。

Figure 2. Identification of the cultured neurons by observing the immunofluorescence of MAP2 (×400).
图2神经元的MAP2免疫荧光鉴定图

Figure 3. The characterization of NSCs-derived exosomes. A: transmission electron microscopy observation of whole-mounted exosomed; B: Western blot analysis identified the exosome marker Alix and TSG101 in the exosome. Mean±SD.n=3.
图3神经干细胞外泌体的电镜图和表面蛋白标志物
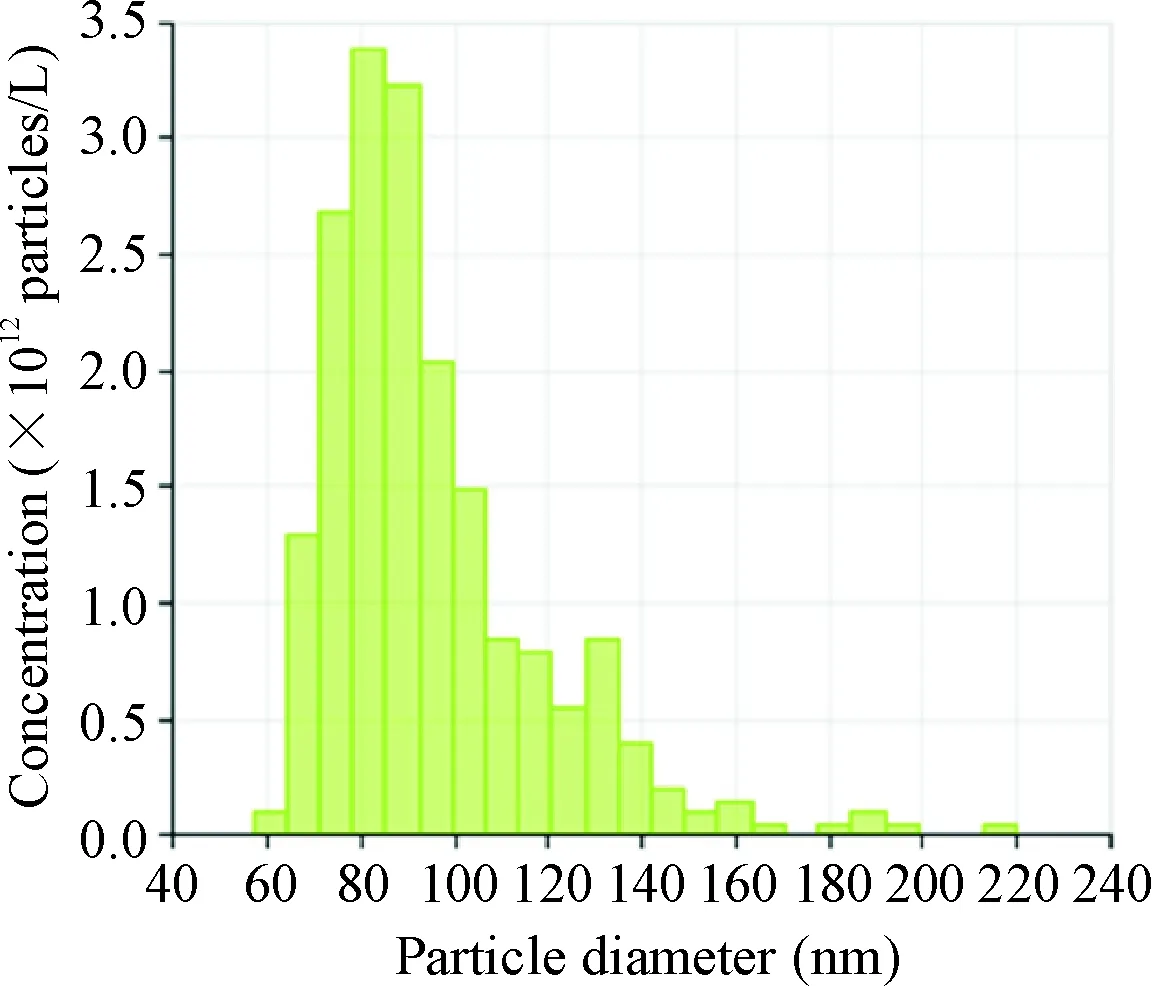
Figure 4. The size distribution of exosomes from the NSC-conditioned medium by nanoparticle analysis (qNano).
图4神经干细胞外泌体的粒径分布图
4 CoCl2对神经元活力的影响
CCK-8结果显示,随CoCl2浓度的增加,神经元活力逐渐下降(P<0.05),200、400和600 μmol/L CoCl2作用24 h,神经元的相对活力分别是78.7%±3.9%、48.1%±2.7%和34.6%±3.4%; 400 μmol/L CoCl2处理神经元,随作用时间的延长,神经元的活力逐渐下降(P<0.05), 400 μmol/L CoCl2作用12 h、24 h和48 h,神经元的相对活力分别是62.9%±3.9%、52.3%±3.2%和24.1%±2.1%,见图5。故我们选取400 μmol/L CoCl2作用于神经元24 h作为损伤组用于后续研究。
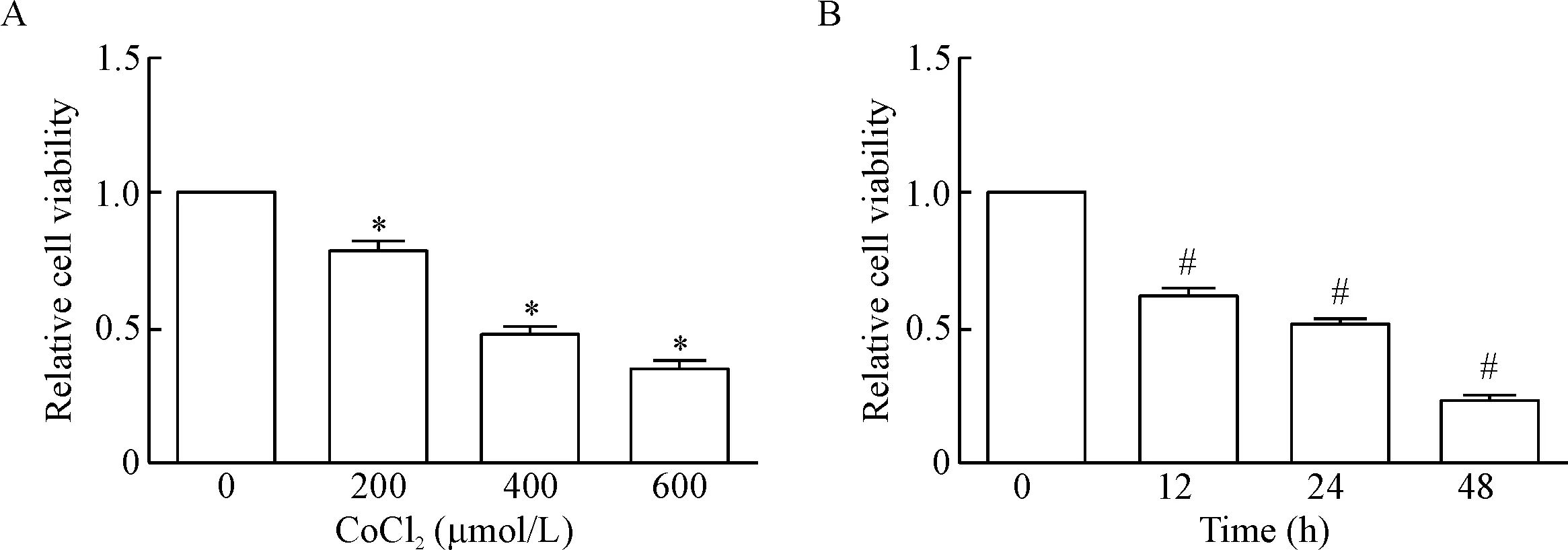
Figure 5. The viability of neurons exposed to different concentrations of CoCl2for 24 h (A) or 400 μmol/L CoCl2for different time (B) detected by CCK-8 assay. Mean±SD.n=5.*P<0.05vs 0 μmol/L group;#P<0.05vs0 h group.
图5CoCl2对神经元活力的影响
5 外泌体对神经元凋亡和存活的影响
TUNEL法检测神经元凋亡结果显示,CoCl2+外泌体组的凋亡率较CoCl2+PBS组明显降低(P<0.05),见图6A、B。CCK-8结果显示,CoCl2+外泌体组神经元活力较CoCl2+PBS组显著升高(P<0.05),见图6C。
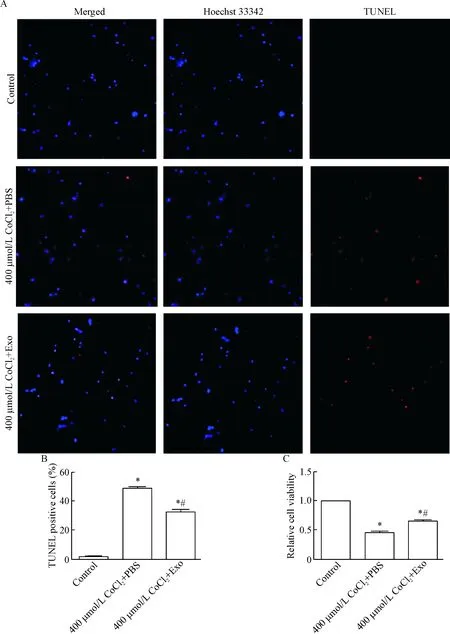
Figure 6. The effects of exosomes on the apoptosis and viability of the neurons exposed to CoCl2. A: the images of TUNEL staining (×200); B: the quantitative analysis of A; C: the cell viability measured by CCK-8 assay. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vs400 μmol/L CoCl2+PBS group.
图6外泌体抑制损伤组神经元的凋亡并促进存活
讨 论
CoCl2可诱导多种细胞缺氧损伤,本研究结果显示CoCl2对神经元的半抑制浓度是400 μmol/L。综合其它研究报道可知,CoCl2对不同细胞的致损伤浓度不一定相同。用100 μmol/L CoCl2作用7 d可使少突胶质细胞前体细胞发生慢性缺氧性损伤;200 μmol/L CoCl2可用于建立肝癌细胞缺氧模型[4];400 μmol/L CoCl2可用于诱导神经干细胞的缺氧模型[5]。以上结果表明,400 μmol/L CoCl2可诱导神经元损伤,并用于建立神经元低氧损伤模型。
本研究结果显示神经干细胞分泌的外泌体可表达外泌体标志物Alix和TSG101。有文献报道,TSG101会在外泌体表面表达而在小囊泡(microparticles)表面不表达[6]。目前大多数文献报道认为外泌体的的直径大约为(100±20) nm,这与本研究的结果一致。另有报道认为,外泌体的形态在冷冻蚀刻电镜上观察为更符合生理现象的“圆球”状,而在透射电镜上则呈现“杯口”状,原因是透射电镜样本的制作过程中会使外泌体发生脱水皱缩现象,故使得外泌体的“圆球”状变成了“杯口”状[7]。综合以上特征,可确定我们提取出来的物质为外泌体。
外泌体作为细胞分泌出细胞外的囊泡,参与细胞与细胞之间信息的传递,其可携带脂质蛋白质、miRNA、lncRNA和mRNA等物质在血液、体液和培养液中自由扩散,并被受体细胞摄取,发挥生物学效应。大量文献报道了干细胞分泌的外泌体对其受体细胞具有保护作用[8-9],如心肌球样细胞分泌的外泌体可以改善猪在急性心肌梗塞下的心肌存活数量,并抑制心肌的凋亡[10]。外泌体用于药物治疗作用和药物载体的功能越发得到重视[11-12]。神经元作为永久细胞,在受到损伤后往往很难修复,神经干细胞的自我更新和分化为神经元的能力虽为神经元的再生提供了希望,但受损部位恶劣的微环境为干细胞的中远期生存提出较大的挑战。双层脂质膜结构为外泌体的稳定性提供了一定的保障,使其能在恶劣的微环境中稳定存在,发挥其母细胞的某些生理作用并改善微环境以改善实质细胞的功能。有研究表明,在大鼠的脑创伤疾病中,通过静脉注射间充质干细胞(mesenchymal stem cells,MSCs)来源的外泌体可穿过血脑屏障进入脑组织,通过改善大脑微环境发挥免疫调节和神经再生作用,并明显促进神经血管的重塑以改善神经功能[13]。体外培养的少突胶质细胞释放的外泌体可减少氧糖剥夺模型中神经元的凋亡,其机制可能与外泌体中包裹的超氧化物歧化酶、过氧化氢酶和其它的抗氧化酶激活神经元内的相关信号通路有关[14]。本研究结果发现,神经干细胞的外泌体可促进低氧状态下神经元的存活并减少凋亡,这与多数文献报道的外泌体保护作用趋势一致。目前尚未有关于神经干细胞分泌的外泌体在神经元急性缺氧损伤中的应用及治疗效果的文献报道,此为本研究的意义所在。
外泌体在被发现之初的十余年间都因被认为是细胞的“排泄物”而不受重视,伴随全世界研究的进展逐步发现外泌体的生物相容性、稳定性、载体作用等特征使其在疾病的诊断和治疗上有独特的优势。神经干细胞外泌体相关的研究尚属缺乏,相信随着对神经干细胞及其外泌体研究的逐步深入,也会开发出干细胞相关外泌体在神经缺氧损伤上的新型治疗手段。
[参考文献]
[2] Riazifar M, Pone EJ, Lötvall J, et al. Stem cell extracellular vesicles: extended messages of regeneration[J]. Annu Rev Pharmacol Toxicol, 2017, 57:125-154.
[3] Théry C, Amigorena S, Raposo G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006, 30(1):3.22.1-3.22.29.
[4] 吴裕丹, 倪嘉延, 陈耀庭, 等. 沉默HIF-1α基因表达对大鼠肝癌细胞增殖的影响[J]. 中国病理生理杂志, 2013, 29(7):1207-1212.
[5] 李 芳,魏红艳,邓宇斌,等. 低氧诱导神经干细胞凋亡和miR-26a低表达[J]. 中国病理生理杂志, 2015, 31(1):81-86.
[7] Théry C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8):569-579.
[8] Zhang B, Yeo RW, Tan KH, et al. Focus on extracellular vesicles: therapeutic potential of stem cell-derived extracellular vesicles[J]. Int J Mol Sci, 2016, 17(2):174.
[9] Phinney DG, Pittenger MF. Concise review: MSC-derived exosomes for cell-free therapy[J]. Stem Cells, 2017, 35(4):851-858.
[10] Gallet R, Dawkins J, Valle J, et al. Exosomes secreted by cardiosphere-derived cells reduce scarring, attenuate adverse remodelling, and improve function in acute and chronic porcine myocardial infarction[J]. Eur Heart J, 2017, 38(3):201-211.
[11] Ha D, Yang N, Nadithe V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6(4):287-296.
[12] Conlan RS, Pisano S, Oliveria MI, et al. Exosomes as reconfigurable therapeutic systems[J]. Trends Mol Med, 2017, 23(7): 636-650.
[13] Zheng GZ, Chopp M. Exosomes in stroke pathogenesis and therapy[J].J Clin Invest, 2016, 126(4):1190-1197.
[14] Fröhlich D, Kuo WP, Frühbeis C, et al. Multifaceted effects of oligodendroglial exosomes on neurons: impact on neuronal firing rate, signal transduction and gene regulation[J]. Philos Trans R Soc Lond B Biol Sci, 2014, 369(1652):2013510.
