右美托咪定减轻失血性休克/复苏大鼠急性肾损伤*
2018-05-07姜远旭夏明珠戴中亮李亚丽张中军
姜远旭, 夏明珠, 黄 强, 戴中亮, 李亚丽, 张中军△
(1暨南大学第二临床医学院深圳市人民医院麻醉科, 深圳市麻醉医学工程研究中心, 2深圳市罗湖医院集团湖贝社区健康服务中心, 广东 深圳 518020)
出血性休克及其复苏(hemorrhagic shock/resuscitation,HS/R)容易引起炎症反应和氧化应激反应,导致多器官损伤[1]。肾脏是失血性休克后主要受损的器官之一。研究表明,右美托咪定(dexmedetomidine,DEX)具有抗炎及抗氧化作用[2-3],并对内毒素血症及缺血再灌注诱导的肾损伤具有保护作用[2, 4],但右美托咪定是否能通过抗炎及抗氧化作用对HS/R诱导的急性肾损伤(acute kidney injury,AKI)具有保护作用尚不清楚。本研究旨在观察右美托咪定对出血性休克/复苏大鼠诱导的AKI的影响,为临床治疗出血性休克合并AKI病人提供理论依据。
材 料 和 方 法
1 药物和试剂
右美托咪定(批号12071234,江苏恒瑞医药公司);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β, IL-1β)ELISA试剂盒(武汉博士德生物工程有限公司);丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(南京建成生物工程研究所);抗血红素加氧酶1(heme oxygenase-1,HO-1)和核因子κB (nuclear factor-κB,NF-κB)抗体(Abcam);抗β-actin抗体(Santa Cruz)。
2 方法
2.1模型制备和分组 SPF级雄性Wistar大鼠32只,体重180~220 g,由南方医科大学实验动物中心提供,动物合格证编号为44007200047364。实验前禁食12 h,自由饮水。腹腔注射3℅戊巴比妥钠(50 mg/kg)麻醉大鼠,股静脉置入24#套管供实验中补液和给药。颈部备皮后用碘伏消毒,分离右颈总动脉,插管作动脉压监测、放血和采集血标本。大鼠随机分为4组:(1) 生理盐水正常对照组(NS组,n=8):股静脉注射 NS 5 mL/kg。 (2)右美托咪定组(D组,n=8): 股静脉持续输注右美托咪定5 μg·kg-1·h-1。(3) 失血性休克/复苏模型组(HS/R组,n=8):通过颈总动脉放血(0.025 mL/kg, 超过10 min),将血压降至40~50 mmHg,并将放出的血液保存于干燥的肝素抗凝试管中,记录放出的血液容积。维持休克状态期间若MAP超过50 mmHg,则放出部分血液,若MAP低于40 mmHg时,则回输部分失血。维持休克状态60 min后,回输采集的剩余血液及2倍的生理盐水(超过10 min)进行复苏。(4)右美托咪定治疗组(HS/R+D组,n=8): 容量复苏后60 min,股静脉持续输注DEX 5 μg·kg-1·h-1。DEX持续输注6 h后,腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉大鼠,麻醉后开腹,暴露下腔静脉,采集血标本,室温静置30 min,4 ℃,2 500×g离心10 min,取上清备用,随即放血处死动物,完整取出肾脏,在冰面上取部分肾脏液氮中速冻后放入-70 ℃低温冰箱保存;取部分肾脏用10%中性多聚甲醛固定24 h后,用于病理学检查。
2.2平均动脉压(mean arterial pressure,MAP)的监测 颈总动脉插入套管针后,连接监护仪,稳定20 min 后,记录基础MAP,休克期间每15 min 记录 1 次MAP,复苏后每隔1 h 记录 1 次,直到实验结束。
2.3血尿素氮(blood urine nitrogen,BUN)和血清肌酐(creatinine,Cr)浓度的检测 取上述血清,血生化分析仪检测BUN和Cr的浓度。
2.4肾组织TNF-α和IL-1β含量的检测 取冰冻肾组织解冻,采用酶联免疫吸附法测定肾组织 TNF-α和IL-1β含量,严格按照说明书进行操作。
2.5肾组织MDA含量及SOD活性检测 取肾组织100 mg解冻,制备肾组织匀浆用试剂盒测定肾组织中MDA含量和SOD活性。
2.6Western blot检测肾组织HO-1和NF-κB的表达 分别取适量的肾组织,加入蛋白裂解液冰上匀浆,离心收取上清液,蛋白定量并煮沸15 min。应用10% SDS-PAGE分离后,电转移至PVDF膜上。室温下用含5%脱脂奶粉的TBS + 20% Tween 20(TBST)溶液对膜封闭1.5 h;封闭完毕后用TBST室温下脱色摇床上洗膜3次,每次10 min,洗膜后加入HO-1或NF-κB 的I抗(1∶500),4 ℃孵育过夜;TBST室温下脱色摇床上洗膜3次,每次10 min,加入 II 抗(辣根过氧化物酶标记的羊抗兔IgG),室温下孵育2 h,TBST室温下脱色摇床上洗膜3次,每次10 min,最后加入化学发光增强剂,自显影。采用图像分析处理系统对蛋白条带扫描分析,根据各组蛋白吸光度与β-actin吸光度的比值表示HO-1或NF-κB 蛋白的相对表达量。
2.7肾组织病理学检查 取部分肾组织用10%中性甲醛固定24 h后,给予脱水、透明、浸蜡、石蜡包埋、切片(厚度4 μm),苏木精-伊红(hematoxylin and eosin,HE)染色。Nikon Eclipse Ti-S显微镜200倍镜下观察。
3 统计学处理
采用SPSS 13.0 统计软件进行数据处理和统计分析。计量资料以均数±标准差(mean±SD)表示,多组间比较行单因素方差分析(one-way ANOVA)和SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 MAP的变化
与NS组相比,HS/R组在2~6 h时点的MAP降低(P<0.05);与HS/R组比较,HS/R+D组在2~6 h时点的MAP升高(P<0.05);而D组的变化与NS组相比差异无统计学意义,见图1。
Figure 1. The effects of dexmedetomidine (D) on MAP of rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图1右美托咪定对各组大鼠MAP的影响
2 血清Cr和BUN 浓度的变化
与NS组相比,HS/R组的BUN和Cr浓度升高(P<0.05);与HS/R组比较, HS/R+D组的BUN和Cr浓度降低(P<0.05);D组的变化和NS组类似,见图2、3。
3 肾组织TNF-α和IL-1β含量的变化
与NS组相比,HS/R组的TNF-α和IL-1β含量升高(P<0.05);与HS/R组比较, HS/R+D组的TNF-α和IL-1β含量降低(P<0.05);而D组的变化和NS组类似,见图4、5。
4 肾组织MDA含量及SOD活性的变化
与NS组比较,HS/R组的MDA含量升高,SOD活性降低(P<0.05);与HS/R组比较,HS/R+D组的MDA含量降低,SOD活性升高(P<0.05);而D组的变化和NS组类似,见图6、7。
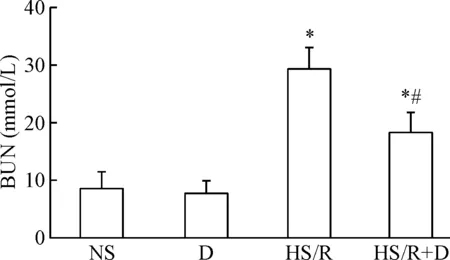
Figure 2. The effects of dexmedetomidine (D) on BUN in the rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图2右美托咪定对各组大鼠BUN的影响
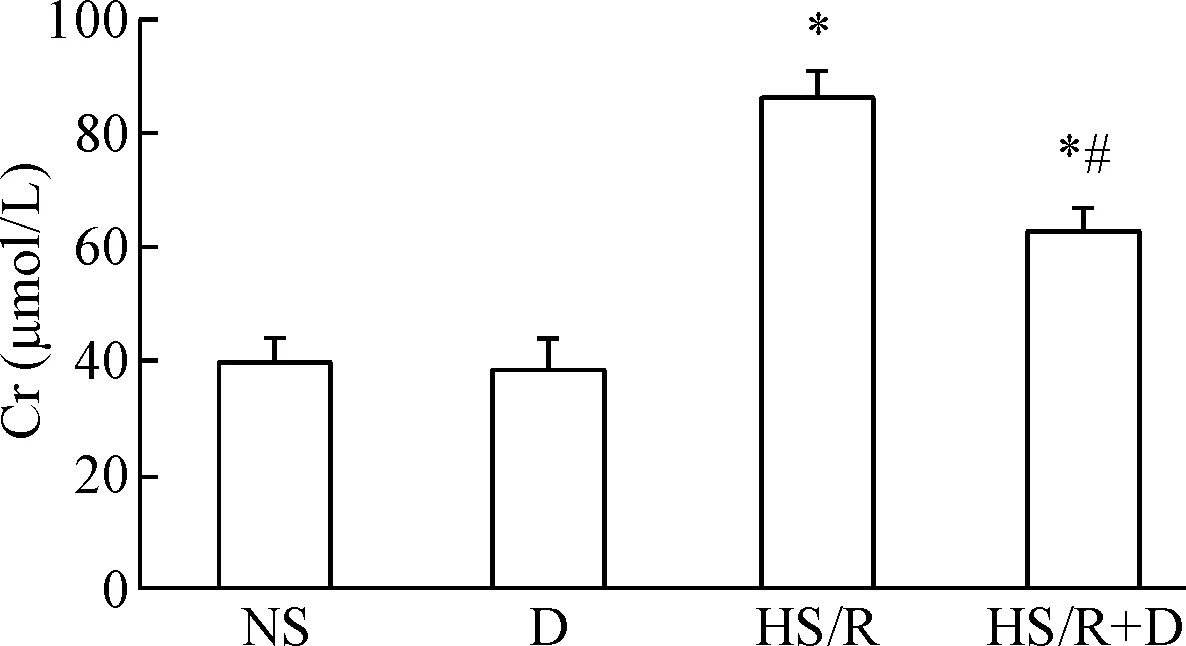
Figure 3. The effects of dexmedetomidine (D) on serum Cr in the rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图3右美托咪定对各组大鼠血清Cr的影响

Figure 4. The effects of dexmedetomidine (D) on TNF-α content in the kidney tissues of rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图4右美托咪定对各组大鼠肾组织TNF-α含量的影响
5 肾组织NF-κB和HO-1表达的变化
与NS组相比,HS/R组的NF-κB表达增加(P<0.05);与HS/R组比较,HS/R+D组的NF-κB表达降低(P<0.05);而D组的变化和NS组类似,见图8。
与NS组比较,HS/R组肾组织的HO-1表达升高(P<0.05);与HS/R组比较,HS/R+D组肾组织的HO-1表达进一步升高(P<0.05),而D组的变化
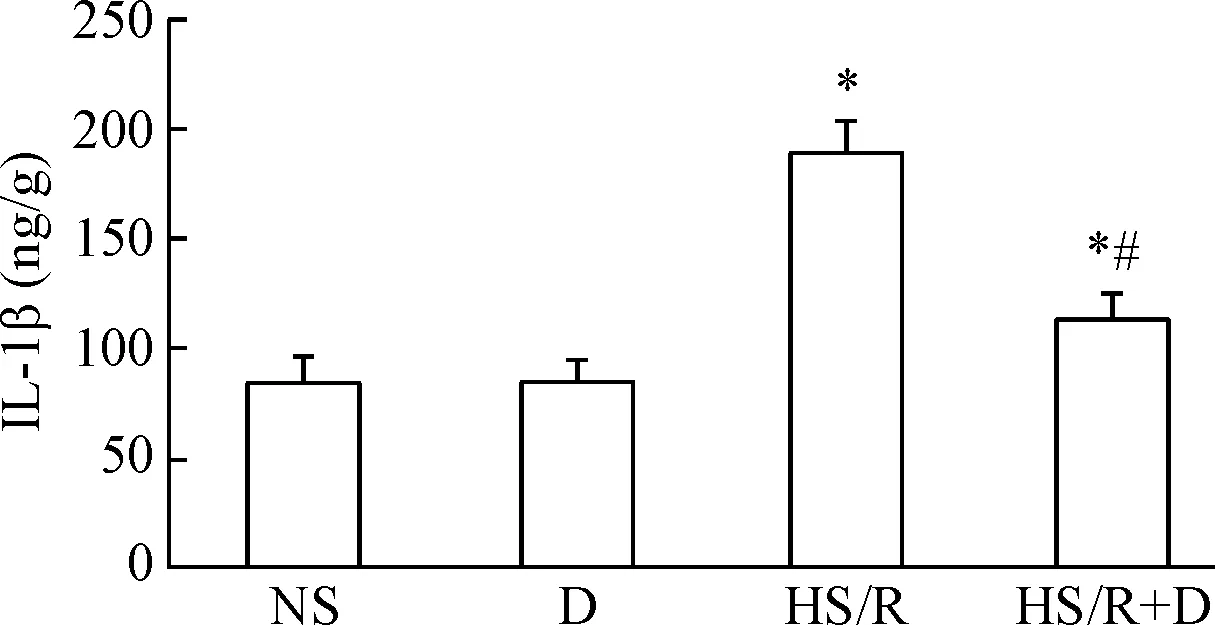
Figure 5. The effects of dexmedetomidine (D) on IL-1β content in the kidney tissues of rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图5右美托咪定对各组大鼠肾组织IL-1β含量的影响

Figure 6. The effects of dexmedetomidine (D) on MDA content in the kidney tissues of rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图6右美托咪定对各组大鼠肾组织MDA含量的影响
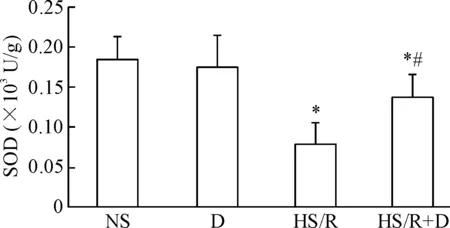
Figure 7. The effects of dexmedetomidine (D) on SOD activity in the kidney tissues of rats induced hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsHS/R group.
图7右美托咪定对各组大鼠肾组织SOD活性的影响
和NS组类似,见图9。
6 肾组织病理学检查
NS组的肾组织结构基本正常;HS/R组的肾小管管腔扩张,近曲小管上皮细胞扁平,核染色边界稍不清,小管间血管充血,核泡变性,可见炎性细胞浸润;HS/L+D组的肾小管管腔稍扩张,小管上皮形态尚保存,血管充血,间质有少许炎性细胞浸润,见图10。
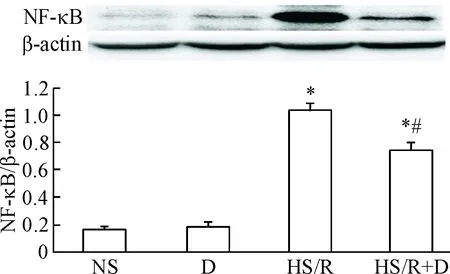
Figure 8. The effect of dexmedetomidine (D) on NF-κB expression in the kidney of the rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=10.*P<0.05vsNS group;#P<0.05vsHS/R group.
图8右美托咪定对各组大鼠肾组织NF-κB表达的影响

Figure 9. The effect of dexmedetomidine (D) on HO-1 expression in the kidney of the rats induced by hemorrhagic shock/resuscitation (HS/R). Mean±SD.n=10.*P<0.05vsNS group;#P<0.05vsHS/R group.
图9右美托咪定对各组大鼠肾组织HO-1表达的影响
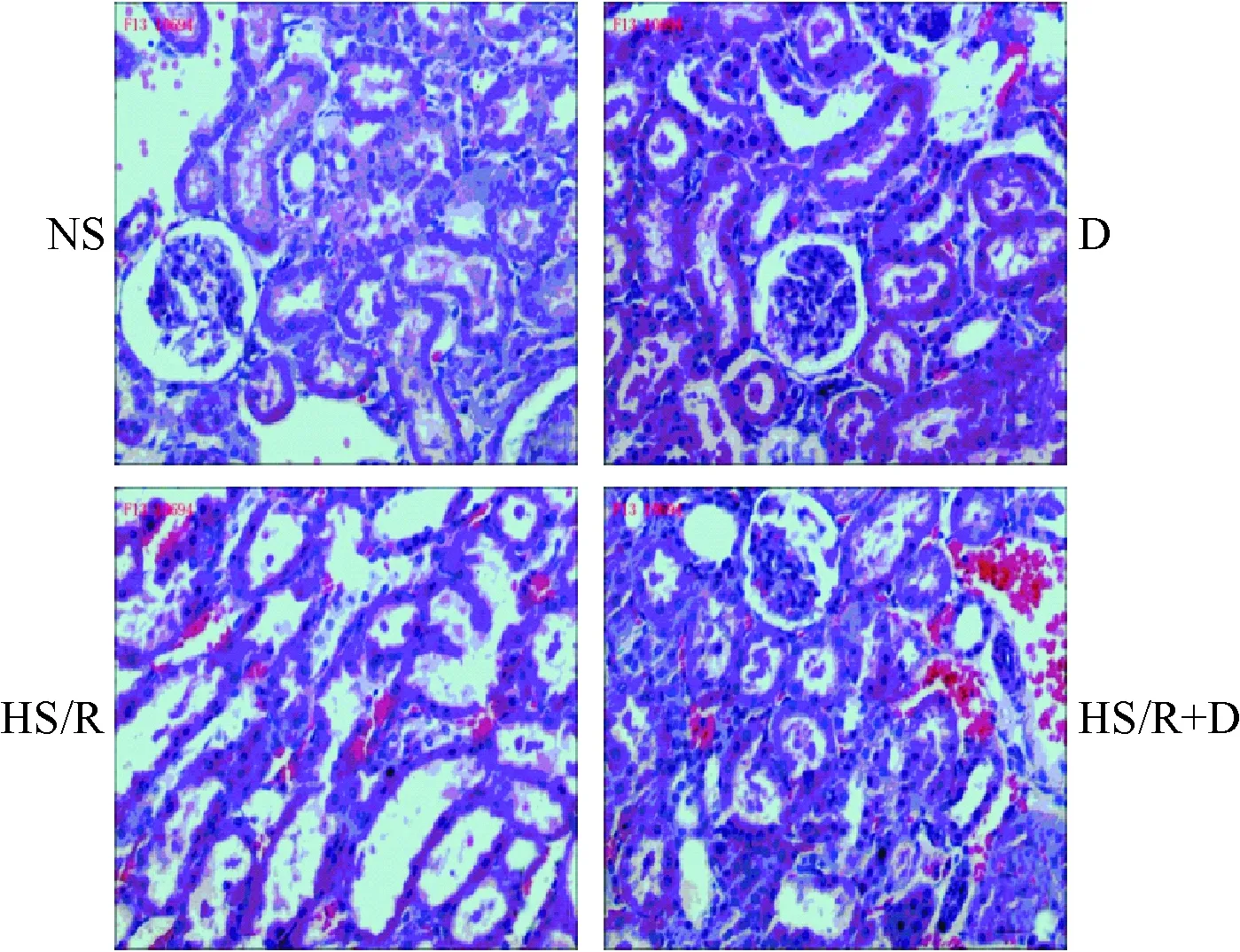
Figure 10. HE staining of kidney tissues from each group (×200).
图10HE染色观察右美托咪定对各组大鼠肾组织病理学改变
讨 论
创伤导致的失血性休克是患者死亡的主要原因。失血性休克及其复苏容易导致重要器官缺血再灌注损伤,肾脏是其损伤的靶器官之一[5]。本实验参照以往的研究建立失血性休克及复苏模型[6]。我们的研究发现,右美托咪定可减轻肾脏炎性反应及氧化反应,改善血流动力学的变化及肾功能。病理检查结果也显示肾损伤明显减轻。我们在实验中也证实,右美托咪定可治疗明显增加HO-1的表达,抑制NF-κB的表达。以上研究表明,右美托咪定可减轻HS/R诱导的AKI, HO-1及NF-κB可能参与了这一病理生理进程。
HS/R诱导氧自由基产生,正常情况下对机体产生保护作用,如果产生过多或清除减少,那么过量产生的氧自由基将导致器官损害。一些研究表明,HS/R诱导了明显的氧化应激反应,而抗氧化治疗减轻器官损害[7]。最近的研究发现,右美托咪定通过抗氧化作用减轻不同致病因素导致的肝、肺和肾损伤[8-9]。MDA作为机体脂质过氧化作用的最终产物,它的浓度反映了组织和细胞的脂质过氧化程度;SOD能够清除过氧化产物,氧自由基等减轻组织器官的损害。我们的研究发现,DEX治疗减少HS/R诱导的肾组织MDA浓度,增加SOD活性,表明右美托咪定可通过减轻HS/R诱导的氧化反应而减轻肾损伤。HO-1是催化血红素的限速酶,广泛存在于各种细胞,也是一种抗氧化酶。最近研究表明,HO-1通过其抗炎和抗氧化作用在减轻急性肾损伤中发挥重要作用[10]。另有研究发现,上调HO-1的表达减轻HS/R诱导的肾损伤[11]。以往的研究发现,右美托咪定通过上调HO-1的表达减轻肺组织炎性反应和氧化应激反应[12]。有研究表明,HS/R本身会明显诱导肾组织HO-1的表达,是机体的一种保护反应[1, 11]。我们的研究表明,与NS组相比,HS/R诱导HO-1的表达升高,而右美托咪定治疗进一步增加HO-1的表达,提示HO-1可能参与了DEX抑制HS/R诱导的炎性反应及氧化应激反应这一病理过程。HO-1正常情况下表达很低,主要受核因子E2相关的因子2(nuclear factor E2-related factor 2,Nrf-2)的调控。Nrf-2是氧化应激的受体,位于各种抗氧化酶的上游,在氧化应激刺激下,Nrf-2能介导HO-1的表达,从而发挥抗氧化作用[13]。研究表明,SOD、GSH-Px和CAT等抗氧化酶的活性也受HO-1的调控,抑制HO-1的活性后,SOD、GSH-Px和CAT表达减少[ 14],提示Nrf-2/HO-1/SOD通路可能是抗氧化的重要机制。本实验中右美托咪定的抗氧化作用是否与这一通路有关,仍须作进一步的研究。
HS/R诱导的氧化反应也导致中性粒细胞的聚集和激活,产生大量的炎性细胞因子,如TNF-α和IL-1β等。研究发现,TNF-α和IL-1β等炎性细胞因子诱发的炎性反应是导致肾损伤的重要机制之一,降低TNF-α和IL-1β的浓度可减轻HS/R诱导的器官损伤[2, 9]。在我们的研究中,HS/R组肾组织TNF-α和IL-1β明显升高,而右美托咪定治疗减轻TNF-α和IL-1β的浓度,表明右美托咪定可通过减轻HS/R诱导的炎性反应而减轻肾损伤。NF-κB是调控TNF-α在内的诸多促炎分子基因表达的重要转录因子[16]。最近研究发现,HS/R后氧化应激反应能激活NF-κB,从而在休克期间诱导大量炎性细胞因子产生[17]。研究表明,右美托咪定可通过抑制NF-κB的表达,减少炎性细胞因子的产生,从而对肾脏具有保护作用[18]。我们的研究中,右美托咪定治疗抑制HS/R诱导的NF-κB表达增加,提示右美托咪减轻HS/R诱导炎性反应可能与抑制NF-κB的表达有关。最新的研究发现,抑制HO-1的活性能增加NF-κB的表达,提示HO-1可通过抑制NF-κB的表达而发挥抗炎作用[19]。本实验中,我们并没有研究右美托咪定的抗炎作用是否与HO-1/NF-κB的表达有关。因此,须进一步做相关实验来进行论证。
本实验中,我们观察到,失血性休克复苏后,血压逐步下降,而右美托咪定治疗能够减轻血压下降的程度,提示右美托咪定对AKI的作用可能与提升MAP有关。HS/R导致缺血再灌注损伤,激活中性粒细胞释放活性氧,诱发应激反应,损害血管内皮细胞。NO是最重要的活性氮物资,NO 可与超氧化物迅速反应生成过氧亚硝基阴离子(ONOOˉ)及过(氧化)亚硝酸盐,启动脂质过氧化反应,最终损害肺泡毛细血管内皮细胞及肺泡上皮肺泡紧密连接,使其通透性增加。研究表明,NO可直接或间接抑制心脏,也可使血管张力降低,导致低血压[20]。我们的研究发现,出血性休克/复苏及随后的内毒素血症导致血液中NO增加,而DEX治疗能降低NO浓度。最近的研究发现,通过HO-1产生的一氧化碳(CO)对HS/R诱导的血管内皮有保护作用[21]。因此,右美托咪定提升血压的作用可能与抑制炎症介质,减轻氧化反应有关。
总之,右美托咪定通过抗炎及抗氧化作用减轻HS/R诱导的AKI,HO-1的表达增加及NF-κB的表达抑制可能参与了这一病理生理进程。
[参考文献]
[1] Zhao B, Fei J, Chen Y, et al. Vitamin C treatment atte-nuates hemorrhagic shock related multi-organ injuries through the induction of heme oxygenase-1[J]. BMC Complement Altern Med, 2014, 14:442.
[2] Tan F, Chen Y, Yuan D, et al. Dexmedetomidine protects against acute kidney injury through downregulating inflammatory reactions in endotoxemia rats[J]. Biomed Rep, 2015, 3(3):365-370.
[3] Lempiäinen J, Finckenberg P, Mervaala EE, et al. Dexmedetomidine preconditioning ameliorates kidney ischemia-reperfusion injury[J]. Pharmacol Res Perspect, 2014, 2(3):e00045.
[4] 项冰倩, 高 慧, 楼国强, 等. 右美托咪定通过抑制内质网应激反应减轻肺缺血/再灌注小鼠肾损伤[J]. 中国病理生理杂志, 2017, 33(7):1288-1294.
[5] Sordi R, Chiazza F, Johnson FL, et al. Inhibition of IκB kinase attenuates the organ injury and dysfunction associa-ted with hemorrhagic shock[J]. Mol Med, 2015, 18(21):563-575.
[6] Chen KB, Lee CY, Lee JJ, et al. Platonin mitigates lung injury in a two-hit model of hemorrhage/resuscitation and endotoxemia in rats[J]. J Trauma Acute Care Surg, 2012, 72 (3):660-670.
[7] Powell RD, Goodenow DA, Mixer HV, et al. Cytochrome c limits oxidative stress and decreases acidosis in a rat model of hemorrhagic shock and reperfusion injury[J]. J Trauma Acute Care Surg, 2017, 82(1):35-41.
[8] Tüfek A, Tokgöz O, Aliosmanoglu I, et al. The protective effects of dexmedetomidine on the liver and remote organs against hepatic ischemia reperfusion injury in rats[J]. Int J Surg, 2013,11(1):96-100.
[9] Fu C, Dai X, Yang Y,et al. Dexmedetomidine attenuates lipopolysaccharide induced acute lung injury by inhibiting oxidative stress, mitochondrial dysfunction and apoptosis in rats[J]. Mol Med Rep, 2017, 15(1):131-138.
[10] Bolisetty S, Zarjou A, Agarwal A, et al. Heme oxygenase 1 as a therapeutic target in acute kidney injury[J]. Am J Kidney Dis, 2017, 69(4):531-545.
[11] Arimori Y, Takahashi T, Nishie H, et al. Role of heme oxygenase-1 in protection of the kidney after hemorrhagic shock[J]. Int J Mol Med, 2010, 26(1):27-32.
[12] Gao S, Wang Y, Zhao J, et al. Effects of dexmedetomidine pretreatment on heme oxygenase-1 expression and oxidative stress during one-lung ventilation[J]. Int J Clin Exp Pathol, 2015, 8(3):3144-3149.
[13] Sun Q, Wu Y, Zhao F, et al. Maresin 1 ameliorates lung ischemia reperfusion injury by suppressing oxidative stress via activation of the Nrf-2 mediated HO-1 signaling pathway[J]. Oxid Med Cell Longev, 2017, 2017:9634803.
[14] Li L, Kong L, Song H. The therapeutic effect of zerumbone on chronic gastritis via antioxidant mechanisms[J]. Exp Ther Med, 2017, 14(3):2505-2510.
[15] Wang Y, Yan J, Xi L, et al. Protective effect of crocetin on hemorrhagic shock-induced acute renal failure in rats[J]. Shock, 2012, 38(1):63-67.
[16] Nie Y, Lu YX, Lv LH. Effect of propofol on generation of inflammatory mediator of monocytes[J]. Asian Pac J Trop Med, 2015, 8(11):964-970.
[17] Wang Y, Yan J, Xi L, et al. Protective effect of crocetin on hemorrhagic shock-induced acute renal failure in rats[J]. Shock, 2012, 38(1):63-67.
[18] Yao H, Chi X, Jin Y, et al. Dexmedetomidine inhibits TLR4/NF-κB activation and reduces acute kidney injury after orthotopic autologous liver transplantation in rats[J]. Sci Rep, 2015, 5:16849
[19] Xiong J, Wang K, Yuan C, et al. Luteolin protects mice from severe acute pancreatitis by exerting HO-1-mediated anti-inflammatory and antioxidant effects[J]. Int J Mol Med, 2017, 39(1):113-125.
[20] 谢子安, 方 强. 一氧化氮与感染性休克关系的实验和临床研究进展[J]. 中国病理生理杂志, 2002, 18(11):1433-1437.
[21] Ibrahim N, Benjamin K, Mark R, et al. Carbon monoxide protects against hemorrhagic shock and resuscitation-induced microcirculatory injury and tissue injury[J]. Shock, 2015, 43(2):166-171.
