黄芪甲苷通过调控PKD1-HDAC5-VEGF通路促进心肌梗死大鼠血管新生*
2018-05-07付卫云王延柯毛秉豫
付卫云, 刘 暖, 王延柯, 赵 威, 李 星, 杨 雷, 毛秉豫
(南阳理工学院, 河南省张仲景方药与免疫调节重点实验室, 河南 南阳 473004)
心肌梗死是由于冠状动脉闭塞造成其供应区域内心肌的严重缺血缺氧而引发的心肌组织坏死,严重危害患者的健康。血管新生指通过促进血管内皮细胞的大量生长、迁移、分化和管腔形成,在现存血管的基础之上形成新生血管的过程[1]。蛋白激酶D1(protein kinase D1, PKD1)又称PKCμ,属于丝氨酸/苏氨酸蛋白激酶家族成员之一,但其结构、酶学和其它调控性能等方面和蛋白激酶C家族成员又有着显著的差异。本项目组前期研究结果证实,PKD1在体内外均有显著的促血管新生作用,而且这一作用和PKD1上调VEGF及其受体KDR的表达密切相关[2]。PKD1直接的下游靶标蛋白是组蛋白脱乙酰酶5(histone deacetylase 5,HDAC5),其在抑制调控基因的表达和诱导染色质的修饰中起到重要作用。PKD1必须和HDAC5结合后才能上调HDAC5控制的基因表达从而调控血管内皮细胞的迁移和增殖[3]。
本项目组的前期研究还证实,黄芪具有调控骨髓源性内皮祖细胞和诱导心肌梗死大鼠心肌组织中新的血管生成而发挥强大的促血管新生作用[4-5]。黄芪甲苷(astragaloside IV,AS-IV)分子式为C41H68O14,为中药黄芪甲苷的最主要成分之一。本研究在以上基础上,拟进一步研究探讨AS-IV是否通过调控PKD1-HDAC5-血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路而发挥促大鼠心肌梗死后心肌组织血管新生的作用,并探讨其可能的作用机制。
材 料 和 方 法
1 实验动物、仪器、药物与试剂
雄性SD大鼠,SPF级,8 周龄,(200±20) g,购自河南省实验动物中心,动物生产许可证号为SCXK(豫)2015-0005,动物质量合格证号为1001297。大鼠采用恒温恒湿的标准方式饲养。
HX-100E小动物呼吸机(成都泰盟科技有限公司);PowerPac HC垂直型电泳仪(BIO-RAD);CUT6062病理切片机和MTMI全密闭自动脱水机(SLEE);TKY-BMB型石蜡包埋机(深圳博大精科技实业有限公司);Bullet Blender Storm组织细胞破碎仪(Next Advance);Tis型荧光显微镜及NIS-Elements Software BR分析系统(Nikon)。
AS-IV(上海宝曼生物科技有限公司,批号84687434,HPLC≥98%);兔抗PKD1多克隆抗体(北京达科为生物技术有限公司,批号70R37566);兔抗HDAC5多克隆抗体(武汉博欧特生物科技有限公司,批号137951);抗VEGF单克隆抗体(北京博迈斯科技发展有限公司,批号A0408100);羊抗兔IgG(洛阳市佰泰科生物技术有限公司,批号OV0303);DAB显色液(北京麦瑞博生物科技有限公司,批号DA10103);PKD1特异阻断剂CID755673(Med-ChemExpress,批号2011756);其它试剂为国产分析纯。
2 方法
2.1模型的建立 SD大鼠用10%水合氯醛(3 mL/kg)腹腔注射麻醉后,取仰卧位固定在预先备有手术铺巾的手术台上,连接入心电监护仪,常规消毒。在颈部正中胸骨上缘1 cm处纵切,行气管插管,待暴露气管后,于胸骨左侧2~3肋间隙正中线旁开5 mm纵向开口,取心尖搏动最明显处钝性分离肌层,深入穿破胸膜,剪开心包膜,用无菌棉签将心尖部向上轻轻推起,在左心耳下缘与肺动脉圆锥连线中点处,左心耳下3 mm处,用7-0型外科缝合线将左冠状动脉前降支连同少量心肌一起结扎,进针深度约1 mm,结扎后肉眼可见结扎下方左心室心尖部颜色变暗,心电图Ⅱ导联ST段明显抬高,QRS波增宽,以此为标准确定心肌梗死模型复制成功。撤去无菌纱布,待左肺充盈复位后,将胸肋挑起,然后进行不连续缝合(闭胸前必须排出胸部空气),从切口处由里至外缝合并关闭胸部。假手术(sham)组大鼠左冠状动脉前降支仅穿线而不结扎。术后连续3 d腹腔注射青霉素80万单位以预防感染。
2.2实验分组 造模后存活达48 h以上的大鼠被随机分为模型(model)组、AS-IV治疗组(40 mg·kg-1·d-1)和AS-IV(40 mg·kg-1·d-1)+CID755673(100 μg/L)组,每组8只。另设假手术组和DMSO组。AS-IV溶于1%DMSO中,CID755673溶于生理盐水中。AS-IV+CID755673组在给予AS-IV后立刻注射CID755673;假手术组和模型组给予等量的生理盐水;DMSO组给予含1%DMSO的等量生理盐水。给药方式均为尾静脉注射,给药4周后处死大鼠。
2.3HE染色 取大鼠心尖部心肌组织,置入10%的多聚甲醛浸泡固定12 h后,制作厚度为3~4 μm的组织切片,去离子水冲洗1~2 min后,苏木精染色50 s,再次用去离子水冲洗1~2 min后,置入无水乙醇(含1% HCl)中固定30 s,伊红染色6~8 s,去离子水冲洗1~2 min后,无水乙醇固定3 min,石蜡包埋,取5个不同视野观察分析。
2.4Masson染色 心肌组织取材同2.3部分。将脱蜡和脱水处理后的切片再用1%的盐酸溶液处理3~5 s后冲洗干净,用温和的碱性品红溶液染色3 min后去离子水冲洗干净,1%的磷钼酸溶液处理1 min,去离子水去除残留的磷钼酸溶液后,2%苯胺蓝溶液染色2 min,95%的乙醇冲洗脱水,干燥后包埋处理。染色后,心肌胶原纤维在光镜下呈蓝绿色,心肌组织呈现红色。
2.5RT-PCR检测心肌细胞中PKD1、HDAC5和VEGF的mRNA表达水平 应用IKA-T25匀浆机将从-80 ℃冰箱取出的大鼠心肌组织制成匀浆,4 ℃、12 000×g离心5 min,Trizol法提取总RNA。查找GenBank中PKD1、HDAC5和VEGF的序列,分别设计其上、下游引物,见表1。根据说明书指导,每组心肌组织取1 μg,首先逆转录合成cDNA,再取2 μg逆转录产物进行PCR,94 ℃ 5 min;95 ℃ 1 min、45 ℃ 1 min、72 ℃ 1 min,30个循环;72 ℃延伸5 min。配制1%琼脂糖凝胶,取2 μg反应产物进行电泳,AlphaView SA软件分析PKD1、HDAC5、VEGF与β-actin的相对灰度比值。
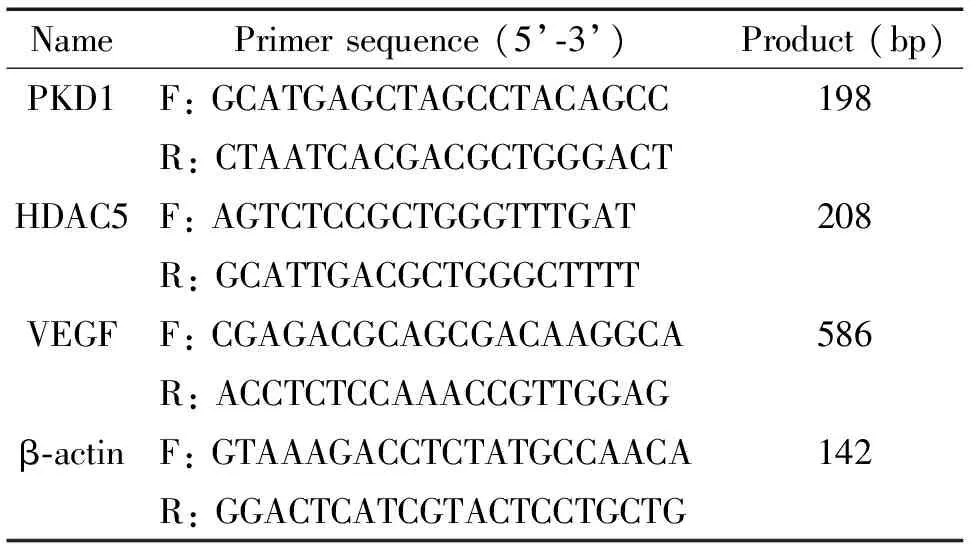
表1 引物序列
F: forward; R: reverse
2.6免疫组织化学染色 心肌组织取材同2.3部分。将脱蜡的组织分别置于二甲苯和无水乙醇溶液中各浸泡3次,每次20 min,95%和85%乙醇中依次浸入1 s,去离子水冲洗3 min,置于PBS液中3 min,再将组织放入容器中,加入沸腾的修复液,盖紧盖子,25 min后取出,PBS液冲洗3次,每次3 min;H2O2祛除组织玻片上的过氧化酶,时间为6 min;PBS液再冲洗3次,每次3 min;加入抗PKD1、HDAC5和VEGF的 I 抗,置入冰箱冷藏12 h;12 h后取出组织,PBS液中重复3次,每次3 min,彻底清除表面杂质和抗体;加入 II 抗,常温孵育15 min;加入DAB显示液孵育3 min,显微镜下观察显色情况;去离子水祛除组织玻片上多余的显色液;再用苏木精染色40 s,分别用95%乙醇和1%HCl浸洗1 s,清水洗5 min,冲洗完毕后放入PBS液3 min,用浓度分别85%和95%的乙醇分别蘸洗,置入二甲苯液,重复3次,封片。光学显微镜下选取5个不重复视野,用NIS-Elements Software BR分析系统计算出各个视野下PKD1、HDAC5和VEGF蛋白的平均吸光度。
2.7Western blot法检测蛋白水平 组织匀浆制作方法同2.5,4 ℃、12 000×g离心5 min,用Bradford法检测提取的总蛋白浓度,配制12%的SDS-PAGE,取20 μg提取的蛋白进行电泳,转入硝酸纤维素膜上,5%的脱脂奶粉封闭2 h后洗膜,标记1∶1 000稀释的抗PKD1、HDAC5和VEGF的 I 抗,4 ℃过夜,洗膜,与辣根过氧化物酶标记的羊抗小鼠IgG(1∶2 000稀释)孵育1 h后TBST洗膜,冲洗后暗室曝光显影。应用AlphaView SA软件分析各样本与β-actin蛋白灰度的比值,记录蛋白相对含量。
3 统计学处理
使用SPSS 16.0统计软件进行数据处理,计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 HE染色观察
假手术和DMSO组大鼠心肌组织完整,分布均匀、排列有序,心肌细胞轮廓清楚,细胞核与细胞质边缘分明(绿色箭头所示),血管完整度好,血管腔内有红细胞;与对照组相比,模型组心肌细胞颜色较浅,心肌组织排列紊乱,部分心肌细胞破碎或者轮廓不清,存在核溶解现象,伴中性粒细胞浸润(红色箭头所示),梗死的心肌组织被胶原纤维取代;和模型组比较,AS-IV治疗组心肌组织排列较为整齐,分布均匀,组织细胞整体颜色加深(绿色箭头所示),成纤维细胞所占比例明显下降,血管管腔完整;AS-IV+CID755673组心肌细胞颜色变浅,部分心肌细胞排列错乱形态不一,有轮廓模糊、核质不清现象出现(红色箭头所示),见图1。
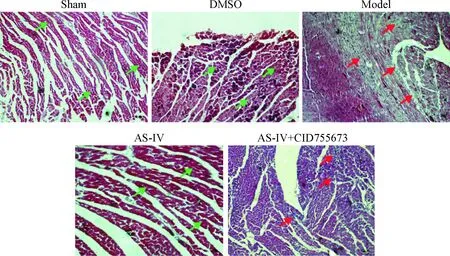
Figure 1. Effect of AS-IV on the pathological changes of myocardial tissues in rats with myocardial infarction (HE staining,×200).
图1AS-IV对心肌梗死大鼠心肌组织病理变化的影响
2 Masson染色观察
假手术和DMSO组大鼠心肌组织外形规整、清晰,整个镜下视野呈现红色(绿色箭头所示),血管清晰,部分血管周围伴有少量的蓝色胶原组织;模型组大鼠红色心肌组织明显减少且排列紊乱,坏死的心肌组织被蓝色的胶原纤维取代(红色箭头所示),坏死的心肌周围伴有排列错乱的肉芽组织,血管有破碎现象,部分管腔狭窄或者闭合;和模型组比较,AS-IV治疗组心肌组织排列规则,红色心肌组织占比较高(绿色箭头所示),蓝色胶原纤维组织数量较模型组显著减少,伴大量新生的肉芽组织(黄色箭头所示);而加入CID755673阻断剂后,心肌组织排列再度趋向紊乱,部分组织断裂,红色心肌组织所占比例明显减少,再次出现较多的蓝色胶原组织(红色箭头所示),血管形态不够完整,层次不清,管腔变窄,伴有较多新生的肉芽组织(黄色箭头所示),见图2。

Figure 2. Effect of AS-IV on the changes of collagen fibres in rats with myocardial infarction (Masson staining,×200).
图2AS-IV对心肌梗死大鼠心肌组织胶原纤维变化的影响
3 AS-IV对大鼠心肌组织中PKD1、HDAC5和VEGF的mRNA表达的影响
与假手术和DMSO组比较,模型组大鼠心肌组织中PKD1、HDAC5和VEGF的mRNA表达均明显降低(P<0.05);与模型组相比,AS-IV治疗组大鼠心肌组织中PKD1、HDAC5和VEGF的mRNA表达水平显著升高(P<0.01);加入CID755673阻断剂后,大鼠心肌组织中PKD1、HDAC5和VEGF的mRNA表达水平较AS-IV组显著降低(P<0.01),但仍明显高于模型组和对照组(P<0.05),见图3。
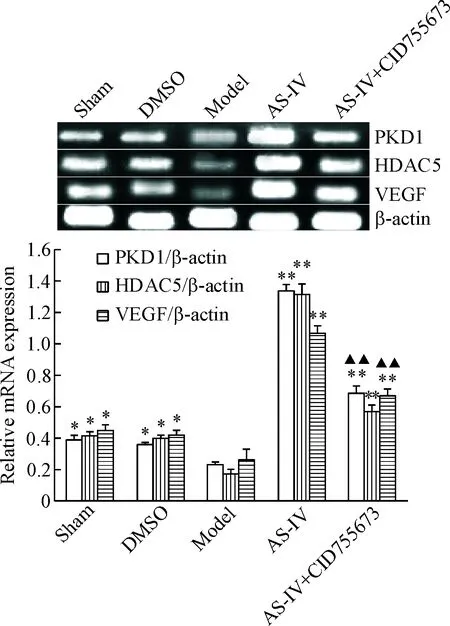
Figure 3. The effect of AS-IV on the mRNA protein expression of PKD1, HDAC5 and VEGF in the rats with myocardial infarction. Mean±SD.n=8.*P<0.05,**P<0.01vsmodel group;▲▲P<0.01vsAS-IV group.
图3AS-IV对大鼠心肌细胞中PKD1、HDAC5和VEGFmRNA表达的影响
4 AS-IV对大鼠心肌组织中PKD1、HDAC5和VEGF蛋白表达的影响
Western blot结果显示,与假手术组和DMSO组相比,模型组大鼠心肌组织中PKD1、HDAC5和VEGF蛋白的表达水平均明显降低(P<0.05);而与模型组相比,AS-IV治疗组大鼠心肌组织中PKD1、HDAC5和VEGF蛋白的表达水平均显著升高(P<0.01);加CID755673阻断剂后,大鼠心肌组织中PKD1、HDAC5和VEGF蛋白的表达水平较AS-IV组显著降低(P<0.01),但明显高于模型组和对照组(P<0.05),见图4。
免疫组化结果表明,心肌细胞胞浆内VEGF表达阳性的细胞呈黄色或棕黄色,而心肌细胞胞核内PKD1和HDAC5表达阳性的在细胞呈黄色或棕褐色。实验结果显示,假手术组和DMSO组大鼠心肌组织胞浆中VEGF表达阳性和胞核中PKD1和HDAC5表达阳性细胞的数量均明显高于模型组;AS-IV治疗组大鼠心肌组织胞浆VEGF和胞核PKD1和HDAC5蛋白表达阳性的细胞显著高于模型组(P<0.01);和AS-IV治疗组相比,AS-IV+CID755673组大鼠心肌组织中PKD1、HDAC5和VEGF蛋白表达阳性细胞显著减少(P<0.01),但仍明显高于模型组和对照组(P<0.05),见图5。
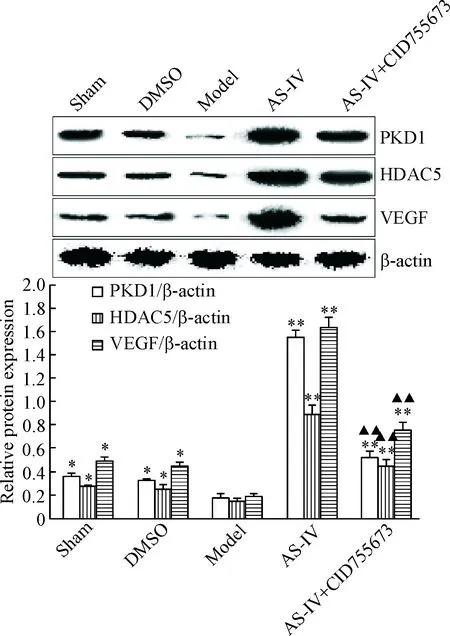
Figure 4. The effect of AS-IV on the protein expression of PKD1, HDAC5 and VEGF in the rats with myocardial infarction. Mean±SD.n=8.*P<0.05,**P<0.01vsmodel group;▲▲P<0.01vsAS-IV group.
图4AS-IV对大鼠心肌组织中PKD1、HDAC5和VEGF蛋白表达的影响
讨 论
心肌细胞属于终末细胞,一旦出现心肌梗死就会造成不可逆的组织缺血坏死,继而诱发机体的一种自我保护反应,生成大量的肉芽组织并转变为胶原纤维使心脏的正常生理功能严重受损[6]。本研究经HE染色和Masson染色结果均证实,心肌梗死模型组大鼠心肌组织破坏严重,有明显的核溶解现象,伴血管大量破损或者丢失,增生的肉芽组织逐渐老化,取而代之以纤维结缔组织,进一步阻碍新生血管的形成。这和之前的研究结果高度一致[7-9]。
黄芪是一种医治心肌梗死的经典中药材之一,其通过补气化瘀改善坏死心肌的阻滞现象,刺激肉芽组织向毛细血管转化继而达到血液再通。有实验证实黄芪在皮肤表面伤口结痂过程中能缩短愈合时间[10-11],并且黄芪有促进大鼠心肌梗死后心肌组织血管新生的作用,继而促进新生血管的发育和成熟[4]。我们之前的研究也证实,黄芪提取物具有促进内皮祖细胞增殖、迁移及生成血管的能力[5]。本研究中,AS-IV治疗组,受损的心肌组织中有大量的肉芽组织生成,同时伴有结构完整的新生毛细血管,红色心肌组织所占比例也较模型组显著升高。这和之前的研究结果相一致[4, 7-8],这表明AS-IV有显著的促受损心肌组织血管新生的作用。
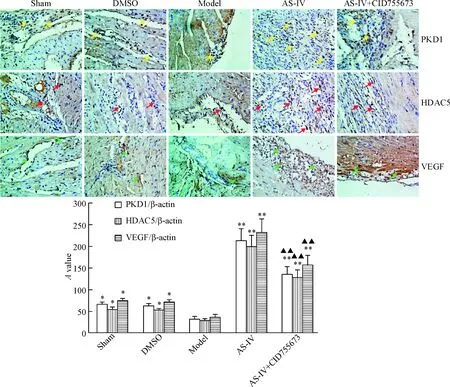
Figure 5. The effect of AS-IV on the protein expression of PKD1, HDAC5 and VEGF in the rats with myocardial infarction (immunohistochemistry, ×400). Mean±SD.n=8.*P<0.05,**P<0.01vsmodel group;▲▲P<0.01vsAS-IV group.
图5AS-IV对大鼠心肌组织中PKD1、HDAC5和VEGF蛋白表达的影响
RT-PCR检测、免疫组化和Western blot结果进一步证实AS-IV有显著上调PKD1、HDAC5和VEGF的mRNA和蛋白表达的作用。之前的文献报道证实PKD1调控内皮细胞参与的血管新生进程[6,12]。PKD1的功能主要是调节内皮细胞的增殖和迁移,促进血管平滑肌细胞的肥大,激活血小板[12]。HDAC5具有诱导染色质的修饰和抑制调控基因表达的作用,是内皮细胞中PKD1直接的下游靶标蛋白[6, 13]。PKD1和HDAC5结合后上调HDAC5控制的基因表达而调控血管内皮细胞的迁移和增殖,介导内皮细胞中的信号转导途径,尤其是参与调节VEGF诱导的血管新生。VEGF刺激内皮细胞中HDAC5区域中丝氨酸259/498残基上依赖PKD1的磷酸化作用[14]。VEGF激活后诱导HDAC5从细胞核向细胞质的易位,进而诱导MEF2的基因表达、迁移及管腔形成,而MEF2家族在血管形成和维持血管完整性的作用方面起着重要作用[15]。
CID755673是PKD1的特异阻断剂。本研究中,加入CID755673处理后,红色的心肌组织所占比例再度降低,并且与AS-IV治疗组比较,PKD1、HDAC5和VEGF的表达均显著下调。这表明CID755673可以阻断AS-IV上调PKD1表达的作用。之前本课题组的研究证实,PKD1能明显促进大鼠EPCs的黏附、迁移和增殖,上调EPCs中VEGF的表达,从而促进内皮细胞的增殖和迁移[1, 6]。PKD1还可以促进心肌组织中VEGF及其受体KDR的上调,诱导生成多种生长因子联合发挥作用,在修复缺血受损心肌中发挥着重要的作用[2]。结合本研究的结果,我们可以推测,AS-IV可以通过调控PKD1-HDAC5-VEGF信号通路而发挥促大鼠心肌梗死后心肌组织血管新生的作用。
我们之前的研究证实,CID755673是可以较为彻底地阻断单一的PKD1的促血管新生作用[2, 15]。但有意思的是,本研究中,CID755673处理后的心肌组织中PKD1、HDAC5和VEGF的表达尽管与AS-IV组相比显著降低,但仍明显高于模型组。这很可能是由于AS-IV具有多靶点效应的结果,也是我们下一步深入探讨的内容。
[参考文献]
[1] Yang L, Mao BY, Liu N. Angiogenesis function of salidroside in myocardium of rats with myocardial ischemia[J].Int J Clin Exp Med, 2017, 10(3):4957-4962.
[2] 杨 雷, 刘 暖, 毛秉豫, 等. 蛋白激酶D1促血管新生的体内外实验分析[J].中国病理生理杂志, 2016, 32(1):146-150, 155.
[3] Ian ME, Ian CZ. Protein kinase D in vascular biology and angiogenesis[J]. Iubmb Life, 2011, 63(4):258-263.
[4] 刘 暖, 杨 雷, 毛秉豫, 等. 黄芪提取物对大鼠心肌梗死后心肌组织血管新生的作用[J]. 中国实验方剂学杂志,2015, 21(19):92-96.
[5] 刘 暖, 毛秉豫, 杨 雷, 等. 黄芪提取物对大鼠骨髓源性内皮祖细胞的作用[J]. 天津医药, 2015, 43(10):1093-1096, 1217.
[6] Luo KQ, Long HB, Xu BC. Reduced apoptosis after acute myocardial infarction by simvastatin[J]. Cell Biochem Biophys, 2014, 71(2):735-740.
[7] 杨 雷, 毛秉豫, 徐国昌, 等. 黄芪和丹参提取物配伍对大鼠心肌梗死后心肌组织病理变化的影响[J]. 中国实验方剂学杂志, 2013, 19(8):175-179.
[8] 杨 雷, 毛秉豫, 徐国昌, 等. 黄芪提取物对大鼠心肌梗死后心肌组织PKD1蛋白表达的影响[J]. 中国药理学通报, 2013, 29(4):512-519.
[9] 杨 雷, 毛秉豫. 芪参益气滴丸对心肌梗死大鼠心肌的保护作用[J]. 中国实验方剂学杂志, 2012, 18(5):206-210.
[10] Wang SG, Xu Y, Chen JD, et al. Astragaloside IV stimulates angiogenesis and increases nitric oxide accumulation via JAK2/STAT3 and ERK1/2 pathway[J]. Molecules, 2013, 18(10):12809-12819.
[11] Chen X, Peng LH, Shen YH, et al. Astrangaloside IV-loaded nanoparticle-enriched htdrogel induces wound hea-ling and anti-scar activity through topical delivery[J]. Int J Pharm, 2013, 447(1-2):171-181.
[12] Evans IM, Bagherzadeh A, Charles M, et al. Characterization of the biological effects of a novel protein kinase D inhibitor in endothelial cells[J]. Biochem J, 2010, 429(3):565-572.
[13] Ha CH, Wang W, Jhun BS, et al. Protein kinase D-dependent phosphorylation and nuclear export of histone deacetylase 5 mediates vascular endothelial growth factor-induced gene expression and angiogenesis[J]. J Biol Chem, 2008, 283(21):14590-14599.
[14] Wang S, Li X, Parra M, et al. Control of endothelial cell proliferation and migration by VEGF signaling to histone deacetylase 7[J]. Proc Natl Acad Sci U S A, 2008, 105(22):7738-7743.
[15] 刘 暖, 杨 雷, 毛秉豫, 等. 蛋白激酶D1在大鼠骨髓源性内皮祖细胞中的促血管新生作用[J]. 中国药理学通报, 2015, 31(9):1259-1263.
