MicroRNA-126-5p在阿霉素所致损伤心肌中的表达及作用*
2018-05-07唐玉婷刘艳娟童中艺李媛彬吕青兰刘炫佑刘梅冬蒋碧梅肖献忠
唐玉婷, 刘艳娟, 童中艺, 李媛彬, 吕青兰, 孙 慧, 刘炫佑, 刘梅冬, 蒋碧梅, 肖献忠
(中南大学湘雅医学院病理生理学系, 湖南 长沙 410008)
阿霉素(adriamycin;又称多柔比星,doxorubicin,DOX)是一种抗肿瘤抗生素,可抑制RNA 和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有抑制作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用[1]。目前已有确切研究结果表明DOX具有时间依赖性和剂量依赖性的心脏毒性[2-3],即随着用药时间的延长和用药剂量的增大,DOX所致的心肌毒性随之增大,一旦出现充血性心力衰竭,病死率可高达30%~50%[4],因此研究阿霉素所致心肌损伤的发生机制具有非常重要的意义。
微小RNA(microRNA)为一类小分子非编码RNA,其长度约为18~22个核苷酸。人们最早发现这类小分子RNA是在1993年,当时这类小分子还未引起足够的重视;2001年,第2个这样的小分子let-7被发现[5],自此,科学家们对microRNA的研究才真正拉开了帷幕。2005年有文献报道人类已经发现了成千种的microRNA[6]。 microRNA可调节许多生物学过程,比如细胞增殖、组织分化、细胞凋亡及肿瘤发生和发展等[7]。 microRNA-126-5p定位于表皮生长因子样结构域7(epidermal growth factor-like domain 7,EGFL7)基因第7号内含子[8]。目前研究发现microRNA-126-5p参与了许多重要的病理生理过程。在乳腺癌中,恢复microRNA-126的功能能抑制肿瘤的生长及细胞的增殖[9];而且microRNA-126能够通过抑制sprouty相关含EVH1域蛋白 1(sprouty-related,EVH1 domain-containing protein 1,Spred1)来调控细胞的增殖以及细胞因子的产生[10];在恶性间皮瘤中,microRNA-126通过调节细胞的代谢来诱导自噬[11]。文献显示,microRNA-126-5p在心血管系统中具有特异性表达,参与血管内皮细胞炎症性损伤与修复过程,进而在血管形成方面起着非常重要的作用,因而与高血压[12]、动脉粥样硬化[13]、冠心病[14]和心力衰竭[15]等心血管疾病的发生发展密切相关。但microRNA-126-5p是否参与了DOX所致心肌损伤,目前尚不清楚。
本科室前期研究工作采用microRNA芯片发现microRNA-126-5p在心肌缺血-再灌注损伤模型中表达有差异[16],提示microRNA-126-5p可能在心肌损伤中发挥某种作用。MicroRNA-126-5p是否在阿霉素所致的心肌损伤中起作用呢?基于以上猜想,本实验采用BABL/c小鼠腹腔注射阿霉素制备心肌损伤模型,提取心肌组织RNA,进而运用real-time PCR检测小鼠中microRNA-126-5p的表达情况,并从细胞水平探讨microRNA-126-5p在阿霉素损伤的心肌细胞中的表达及其作用。
材 料 和 方 法
1 动物和细胞
18~22 g左右的BALB/c雄性小鼠购自于长沙斯莱克景达实验动物有限公司。大鼠心肌细胞株H9c2购自于美国标准生物品收藏中心。
2 主要试剂
MicroRNA引物购于GeneCopoeia;cDNA逆转录试剂盒以及PCR试剂盒购自于TaKaRa;microRNA-126-5p的模拟物(mimic)和抑制物(inhibitor)以及相关的转染试剂HiPerFect Transfection Reagent 购自Qiagen。
3 主要方法
3.1阿霉素所致小鼠心肌损伤模型的构建 实验分为慢性DOX(chronic DOX, C-DOX)组、急性DOX(acute DOX, A-DOX)组、慢性生理盐水(chronic NS, C-NS)组和急性生理盐水(acute NS, A-NS)组。慢性DOX组小鼠按5 mg/kg的剂量每周腹腔注射DOX(溶于生理盐水中)溶液,而慢性生理盐水组则注射相同体积的生理盐水,均连续注射4周(总共剂量为20 mg/kg)。到第5周动物模型制备完成时取材。急性DOX组则从第1天起按4 mg/kg的剂量腹腔每天注射一次DOX溶液,连续注射5次(共 5 d,总剂量为20 mg/kg),同样急性生理盐水组也按此方法每天注射相同体积的生理盐水。到第6天动物模型制备完成时取材。
3.2苏木精-伊红(hematoxylin-eosin staining,HE)染色观察小鼠心肌形态学的改变 将上述心肌组织置于4%的多聚甲醛中固定24 h后脱水,石蜡包埋,切片4 ℃冰箱长期保存。将实验用切片置于60 ℃烤箱中烘烤1 h,之后脱水脱蜡,最后再用苏木素伊红染色,显微镜下观察心肌受损情况。
3.3血清中乳酸脱氢酶(lactate dehydrogenase,LDH)的测定 操作步骤按LDH检测试剂盒说明书操作。
3.4心肌血流动力学指标的测定 小鼠心肌损伤模型制备完成后开始取材,将小鼠按2.5 mL/kg的剂量用5%的水合氯醛麻醉,置于实验台上仰卧固定,行气管插管术,连接小动物呼吸机保证小鼠呼吸通畅。75%乙醇消毒小鼠胸部毛发后沿着第3、4肋间打开小鼠胸腔,露出心尖,将注射器6号针头磨钝后用2.5×105U/L肝素生理溶液排尽针头中的空气,并用此肝素生理溶液充满该针头后与血流动力学分析探头进行连接,排尽空气,避免气泡的出现,以免血液凝固堵塞管道。待一切准备工作完成以后,将磨钝的针头从心尖插入左心室,测量心率等相关指标。之后再通过PowerLab System分析血流动力学的相关指标:左心室等容舒张期压力下降最大速率(-dp/dtmax)和左心室等容收缩期压力上升最大速率(+dp/dtmax)。
3.5Real-time PCR法检测损伤心肌中microRNA-126-5p的表达 从-80 ℃中取出已收集好的心肌组织标本,用Trizol提取组织中RNA。Trizol法提取组织RNA步骤为:将标本从-80 ℃取出后迅速放入液氮中速冻,用经过高温灭酶的研钵研磨至成粉末状后再转移至无酶EP管中。每个标本加入1 mL Trizol裂解组织,室温放置2~5 min。加入0.2 mL的三氯甲烷(按1/5体积),上下倒置混匀15 s,充分混匀后静置10 min,于4 ℃冷室中以12 000 r/min离心15 min。轻轻吸取上清液至另一1.5 mL无酶EP管中,加入同体积的异丙醇,上下倒置混匀15 s,静置10 min,于4 ℃冷室中以12 000 r/min离心10 min。倒掉上清液(注意不要倒掉管壁上的白色絮状沉淀),加入1 mL的75%的乙醇洗涤沉淀(置于4 ℃冷室中以7 500 r/min离心5 min)。加入20 μL无酶水溶解沉淀,必要时可置55 ℃水浴锅中助溶)。
3.6MicroRNA-126-5p mimic与inhibitor的转染 转染按照Qiagen公司的HiPerFect Transfection Reagent使用说明书进行操作,首先往24孔板中接种H9c2细胞,每个孔中加入500 μL的培基,待细胞长至融合度为60%时进行转染。转染前先将0.15 μL microRNA mimic或1.5 μL inhibitor加入100 μL无血清培养基中,混匀后再加入3 μL的HiPerFect Transfection Reagent,充分混匀,室温孵育5~10 min,再逐滴加入孔中,轻轻振荡混匀。最后再将24孔板放入培养箱中培养6~72 h后采用real-time PCR观察转染效果。
3.7Caspase-3 活性的检测 操作步骤按照碧云天的caspase-3活性检测试剂盒的说明书进行。Caspase-3通过催化底物Ac-DEVD-pNA产生黄色的pNA产物,从而测量pNA在405 nm处的吸光度来测定caspase-3的活性(pNA在405 nm左右有强的吸光度)。
4 统计学处理
采用SPSS 19.0 统计软件分析,计量资料用均数±标准差(mean±SD)表示,多组之间比较采用单因素方差分析,两两比较采用SNK法,以P<0.05为差异有统计学意义。
结 果
1 microRNA-126-5p在DOX损伤的小鼠心肌组织中的表达情况
HE染色结果发现急性DOX组小鼠肌纤维排列紊乱,肌原纤维溶解,并且局部伴有炎症细胞浸润,此种情形在慢性DOX组中表现尤为明显,见图1A。收集小鼠的血清,采用LDH试剂盒检测小鼠血清中LDH活性,结果发现与生理盐水组相比,急、慢性DOX组血清LDH水平均明显升高(P<0.05),见图1B。用Powerlab System检测小鼠血流动力学相关指标,结果发现与生理盐水组相比,急、慢性DOX组的-dp/dtmax和+dp/dtmax均明显降低,而急性生理盐水组与慢性生理盐水组相比较差异则无统计学显著性,见图1C。上述结果提示DOX处理可导致心肌受损,心脏功能下降。
用real-time PCR法检测心脏组织中microRNA-126-5p的表达量,结果发现与生理盐水对照组相比,急、慢性DOX组microRNA-126-5p的表达量均明显升高(P<0.05),见图1D。
2 DOX损伤的心肌细胞中microRNA-126-5p的表达
用real-time PCR法检测DOX损伤的H9c2细胞中microRNA-126-5p的表达,结果发现随着DOX浓度的增加及作用时间的延长,microRNA-126-5p的表达均明显上调(P<0.05),与动物整体实验的表达水平相似,见图2。
3 microRNA-126-5p mimic 对DOX所致心肌细胞损伤的影响
为了探讨在心肌细胞损伤模型中,microRNA-126-5p表达上调是伴随现象,还是其它某种作用,我们采用了DOX所致心肌细胞损伤模型,并转染microRNA-126-5p mimic来探讨其作用。结果显示,转染了microRNA-126-5p mimic 24 h后microRNA-126-5p的表达水平明显升高(P<0.05),而mimic阴性对照组与空白组相比差异则无统计学显著性,见图3A。
接着我们将转染了microRNA-126-5p mimic 24 h后的H9c2细胞再用DOX刺激,收集蛋白检测caspase-3的水平,收集细胞培养液检测LDH的释放,结果发现用DOX刺激后细胞培养液中LDH的释放明显增加,caspase-3的活性明显增强(均P<0.05);而microRNA-126-5p mimic +DOX组LDH的释放和caspase-3的活性进一步增加(P<0.05),提示microRNA-126-5p mimic可促进DOX所致心肌细胞损伤,见图3B、C。
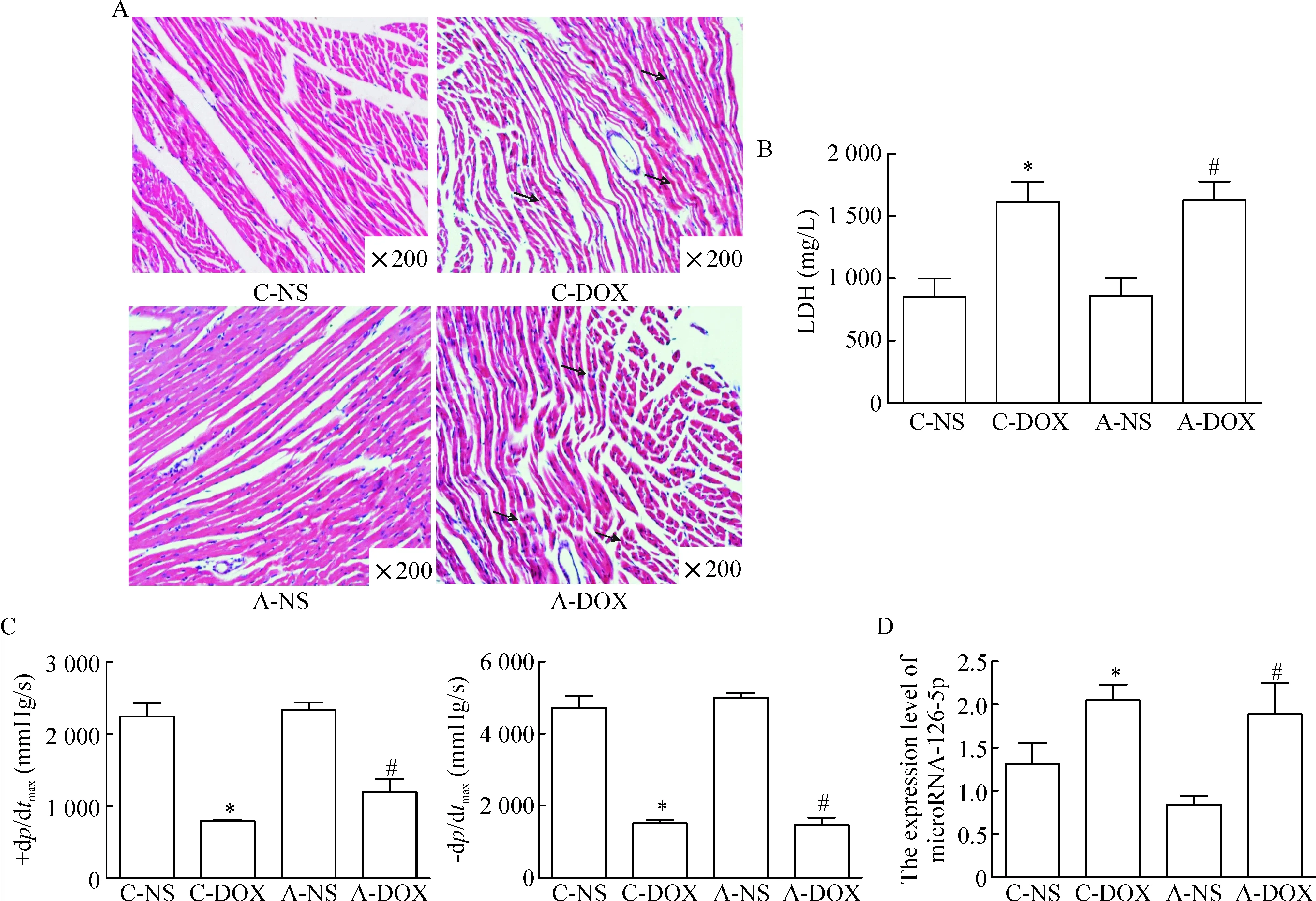
Figure 1. The expression levels of microRNA-126-5p in myocardial tissues injured by DOX. A: HE staining was applied to detect the morphological changes of myocardial tissues; B: the detection of LDH in serum (n=6); C: the effect of DOX on ±dp/dtmax(n=6); D: the expression of microRNA-126-5p (n=5). Mean±SD.*P<0.05vsC-NS group;#P<0.05vsA-NS group.
图1microRNA-126-5p在DOX损伤的心肌组织中的表达水平
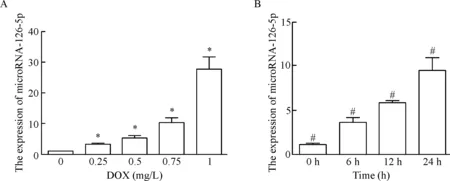
Figure 2. The expression of microRNA-126-5p in the H9c2 cells treated with DOX. A: H9c2 cells were treated with DOX at different concentrations for 24 h; B: H9c2 cells were treated with DOX at 0.5 mg/L for different time. Mean±SD.n=3.*P<0.05vs0 mg/L group;#P<0.05vs0 h group.
图2microRNA-126-5p在DOX损伤的心肌细胞中表达水平的变化
4 microRNA-126-5p inhibitor 对DOX所致心肌细胞损伤的影响
为了进一步探讨microRNA-126-5p在心肌细胞损伤中的作用,我们采用了microRNA-126-5p inhibitor作用于细胞,从所得结果可以发现,转染了microRNA-126-5p inhibitor后,microRNA-126-5p的表达水平明显降低(P<0.05),而inhibitor的阴性对照组与空白组相比差异则无统计学显著性,见图4A。
接着我们将转染microRNA-126-5p inhibitor 24 h后的H9c2细胞再用DOX 刺激,收集细胞培养液检测LDH的释放,收集蛋白检测caspase-3的活性,结果发现用DOX刺激后细胞培养液中LDH的释放明显增加,caspase-3的活性明显增强(均P<0.05);而转染microRNA-126-5p inhibitor可抑制LDH的释放及caspase-3的活性(P<0.05),提示microRNA-126-5p inhibitor可抑制DOX所致心肌细胞损伤,具有心肌细胞保护作用,见图4B、C。
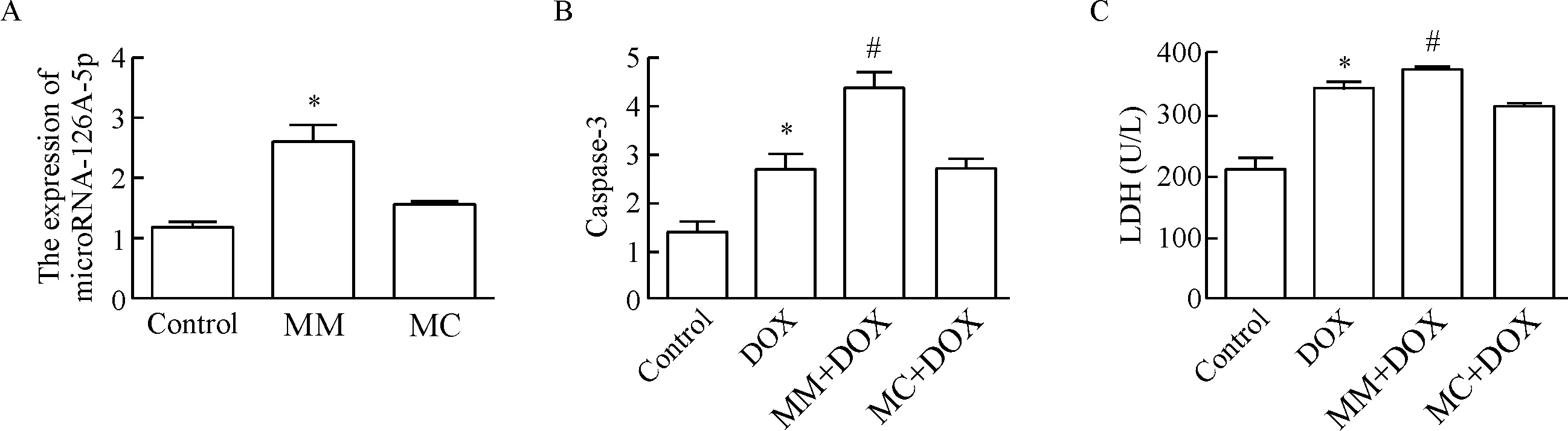
Figure 3. The effect of microRNA-126-5p mimic on myocardial cell injury induced by DOX. A: real-time PCR was applied to detect the expression of microRNA-126-5p in the H9c2 cells transfected with microRNA-126-5p mimic (n=6); B: the effect of microRNA-126-5p mimic on caspase-3 activity in DOX-treated H9c2 cells (n=3); C: the effect of microRNA-126-5p mi-mic on LDH release in DOX-treated H9c2 cells (n=3). MM: microRNA-126-5p mimic; MC: mimic control. Mean±SD.*P<0.05vscontrol group;#P<0.05vsDOX group.
图3microRNA-126-5pmimic在DOX诱导的心肌细胞损伤中的作用
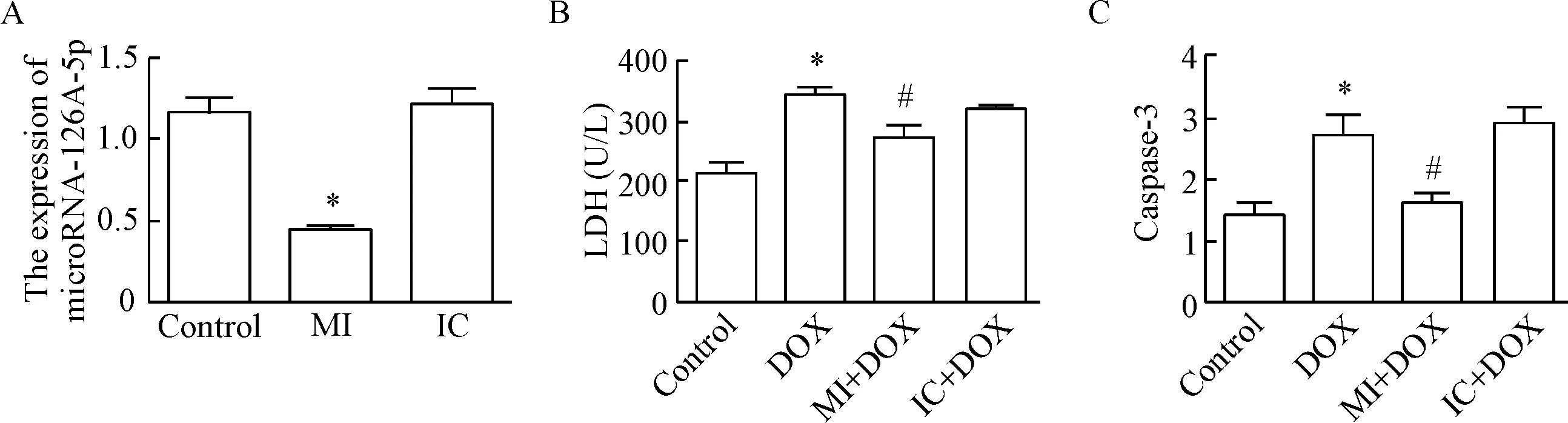
Figure 4. The effect of microRNA-126-5p inhibitor on myocardial cell injury induced by DOX. A: real-time PCR was applied to detect the expression of microRNA-126-5p in the H9c2 cells transfected with microRNA-126-5p inhibitor (n=6); B: the effect of microRNA-126-5p inhibitor on LDH release in DOX-treated H9c2 cells (n=3); C: the effect of microRNA-126-5p inhibitor on caspase-3 activity in DOX-treated H9c2 cells (n=3). MI: microRNA-126-5p inhibitor; IC: inhibitor control. Mean±SD.*P<0.05vscontrol group;#P<0.05vsDOX group.
图4microRNA-126-5pinhibitor在DOX诱导的心肌损伤中的作用
讨 论
DOX是广谱抗肿瘤药,可直接嵌入DNA而抑制核酸的合成,对多种肿瘤具有很好的抑制性。临床上广泛用于治疗急性淋巴细胞白血病和急性粒细胞性白血病等。虽然它在临床上被广泛使用,然而其副作用不容忽视。DOX的急性副反应主要有呕吐、恶心以及心律不齐等。目前已有确切的研究结果表明DOX用于抗肿瘤治疗的同时可引起心脏毒性。长期大量使用DOX后,DOX可在线粒体氧化磷酸化作用下与Fe2+相互作用产生大量活性氧簇,导致心肌损伤,进而造成肌原纤维凋亡[17]。从目前研究结果来看DOX导致的心肌损伤的机制有很多,比如说代谢机制、DNA损伤和氧化应激等,有研究表明DOX能够通过内源性和外源性机制来引起心肌细胞的凋亡,致使caspase-3、6和7被激活,促进心肌细胞的凋亡[18]。
microRNA-126-5p可以抑制蛋白质的翻译或直接降解其靶mRNA来调控蛋白质的表达进而发挥其生物学效应。体内外研究表明,microRNA-126-5p在维持血管完整性和促进血管新生中起重要作用,促血管新生的作用一部分与抑制蛋白Spred-1的表达有关[19]。调查显示,在稳定性心绞痛中,microRNA-126-5p是一个显示冠状动脉性疾病的复杂性与严重性的潜在指标[20]。我们实验室前期研究也发现,缺血-再灌注损伤心肌中microRNA-126-5p表达上调[16],这些结果提示microRNA-126-5p可能在心肌损伤与保护中发挥某种作用。
本实验结果发现腹腔注射DOX后,小鼠心肌出现形态学改变,用PowerLab System检测发现小鼠左室心功能降低,血清酶学检测小鼠血清中LDH释放增加,这一系列指标皆表明DOX确实可以诱导心肌损伤。进一步采用real-time PCR法检测检测发现小鼠心肌中的microRNA-126-5p表达水平在DOX所致心肌损伤模型中明显上升,这表明microRNA-126-5p可能在DOX诱导的心肌损伤中发挥着某种作用。
为了进一步探讨microRNA-126-5p在DOX诱导的心肌损伤中的作用,我们采用DOX诱导心肌细胞损伤模型,结果发现microRNA-126-5p mimic可使心肌细胞中microRNA-126-5p表达升高,促进细胞凋亡,而microRNA-126-5p inhibitor可使心肌细胞中microRNA-126-5p表达下调,抑制心肌细胞凋亡,具有心肌细胞保护作用。但microRNA-126-5p具体是通过何种机制在DOX诱导的心肌损伤中起作用的呢?我们通过生物信息学软件预测了microRNA-126-5p可能调控的靶基因,如Hspb8。但它是否通过调控这些蛋白质的表达而发挥作用,尚需进一步研究。
[参考文献]
[1] 陈奇彪, 詹雄宇, 吕秀秀, 等. 小檗碱增强阿霉素诱导的膀胱癌T24细胞凋亡[J]. 中国病理生理杂志, 2016, 32(5):847-851.
[2] Wu R, Wang HL, Yu HL, et al. Doxorubicin toxicity changes myocardial energy metabolism in rats[J]. Chem Biol Interact, 2016, 244:149-158.
[3] 唐春梅, 张 铭, 胡志琴, 等. MicroRNA-34a靶向SIRT1参与阿霉素诱导的心肌细胞凋亡[J]. 中国病理生理杂志, 2017, 33(3):385-391.
[4] Gu J, Hu W, Zhang DD. Resveratrol, a polyphenol phytoalexin, protects against doxorubicin-induced cardiotoxicity[J]. J Cell Mol Med, 2015, 19(10): 2324-2328.
[5] Almeida MI, Reis RM, Calin GA. MicroRNA history: discovery, recent applications, and next frontiers[J]. Mutation Res, 2011, 717(1-2):1-8.
[6] Bentwich I, Avniel A, Karov Y, et al. Identification of hundreds of conserved and nonconserved human micro-RNAs[J]. Nat Gene, 2005, 37(7): 766-770.
[7] Kontomanolis EN, Koukourakis MI. MicroRNA: the potential regulator of endometrial carcinogenesis[J]. MicroRNA, 2015, 4(1):18-25.
[8] Liu B, Peng XC, Zheng XL, et al. MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo[J]. Lung Cancer, 2009, 66(2):169-175.
[9] Tavazoie SF, Alarcon C, Oskarsson T, et al. Endogenous human microRNAs that suppress breast cancer metastasis[J]. Nature, 2008, 451(7175):147-152.
[10] Ishizaki T, Tamiya T, Taniguchi K, et al. miR126 positively regulates mast cell proliferation and cytokine production through suppressing Spred1[J]. Genes Cells, 2011, 16(7): 803-814.
[11] Tomasetti M, Monaco F, Manzella N, et al. MicroRNA-126 induces autophagy by altering cell metabolism in malignant mesothelioma[J]. Oncotarget, 2016, 7(24): 36338-36352.
[12] Potus F, Malenfant S, Graydon C, et al. Impaired angiogenesis and peripheral muscle microcirculation loss contribute to exercise intolerance in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2014, 190(3):318-328.
[13] Kim JM, Jung KH, Chu K, et al. Atherosclerosis-related circulating microRNAs as a predictor of stroke recurrence[J]. Transl Stroke Res, 2015, 6(3):191-197.
[14] Zhang J, Zhang Z, Zhang DY, et al. microRNA 126 inhibits the transition of endothelial progenitor cells to me-senchymal cells via the PIK3R2-PI3K/Akt signalling pathway[J]. PLoS One, 2013, 8(12):e83294.
[15] Qiang L, Hong L, Ningfu W, et al. Expression of miR-126 and miR-508-5p in endothelial progenitor cells is associated with the prognosis of chronic heart failure patients[J]. Int J Cardiol, 2013, 168(3):2082-2088.
[16] Jiang B, Liu Y, Liang P, et al. MicroRNA-126a-5p enhances myocardial ischemia-reperfusion injury through suppressing Hspb8 expression[J]. Oncotarget, 2017, 8(55):94172-94187.
[17] Bolli R, Becker L, Gross G, et al. Myocardial protection at a crossroads: the need for translation into clinical therapy[J]. Circ Res, 2004, 95(2):125-134.
[18] Gianni M, Studer M, Carpani G, et al. Retinoic acid induces liver/bone/kidney-type alkaline phosphatase gene expression in F9 teratocarcinoma cells[J]. Biochem J, 1991, 274(Pt 3):673-678.
[19] Zhang Q, Kandic I, Kutryk MJ. Dysregulation of angiogenesis-related microRNAs in endothelial progenitor cells from patients with coronary artery disease[J]. Biochem Biophys Res Commun, 2011, 405(1):42-46.
[20] Li HY, Zhao X, Liu YZ, et al. Plasma microRNA-126-5p is associated with the complexity and severity of coronary artery disease in patients with stable angina pectoris[J]. Cell Physiol Biochem, 2016, 39(3):837-846.
