miR-145过表达对宫颈癌细胞辐射敏感性的影响
2018-05-07赵丽君
徐 杨, 赵丽君, 王 春
(济南市第五人民医院妇产科, 山东 济南 250022)
宫颈癌是女性常见的恶性肿瘤之一,严重威胁女性的健康和生命。资料显示,世界上每年有13万宫颈癌新增病例,其发病率和死亡率约占所有女性恶性肿瘤的9%和8%,仅次于乳腺癌[1]。目前宫颈癌的治疗方案有早期根治性子宫切除和晚期局部放射治疗,但是对于晚期宫颈癌的治疗效果仍不理想[2-3]。研究表明50%的晚期宫颈癌患者对放射治疗不敏感,导致预后不良,进而诱发肿瘤转移[4]。因此,放疗抵抗是晚期宫颈癌治疗失败的主要原因之一,目前放疗敏感性降低的机制仍不清楚。
微小RNA(microRNAs,miRNAs,miR)是一类长度为18~22个碱基对组成的非编码RNA,大量研究证实miRNA的异常表达与肿瘤细胞的增殖、分化、凋亡及转移密切相关,具有抑癌(miR-15a、miR-29和miR-214)[5-7]或促癌(miR-21、miR-10b和miR-221)[8-9]功能。研究表明,miRNAs的异常表达能调节肿瘤细胞的辐射敏感性[10-11]。miR-181a通过靶向抑制促凋亡基因PRKCD的表达增强宫颈癌细胞的辐射抵抗效应[12]。早期研究发现,miR-145在多种肿瘤组织中低表达,是一个肿瘤抑制miRNA;研究发现miR-145在宫颈癌组织中低表达,其过表达明显抑制宫颈癌细胞的增殖、转移及侵袭[13-14];最新研究发现辐射抗性的T细胞淋巴中miR-145表达水平显著低于正常细胞[15],提示miR-145表达与肿瘤细胞辐射敏感性有关。miR-145能否调节宫颈癌细胞的放疗敏感性,目前尚无研究报道。本研究运用宫颈癌细胞系C33A、HeLa、SiHa和CaSki为研究对象,比较miR-145在宫颈癌细胞和正常子宫内膜基质细胞(endometrial stromal cells, ESC)中的表达水平,观察miR-145过表达的宫颈癌细胞对辐射敏感性,初步探讨miR-145调节宫颈癌细胞辐射敏感性的分子机制,为以miR-145为靶点开发宫颈癌辐射增敏剂提供理论依据。
材 料 和 方 法
1 细胞系与试剂
宫颈癌细胞系HeLa、CaSki、C33A和SiHa购自ATCC;ESC购自中国科学院上海细胞生物学研究所;高糖型DMEM培养基、胎牛血清(fetal bovine se-rum,FBS)和双抗购自北京鼎国生物技术有限公司;胰蛋白酶、MTT和DMSO购自Sigma;miR-145模拟剂(miR-145-mimic)和阴性对照模拟剂(NC-mimic)购自广州锐博生物科技技术有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京博泰生物技术有限公司;microRNA提取试剂盒和Taqman miRNA试剂盒购自Applied Biosystems;Lipofectamine 2000购自Invitrogen;抗解螺旋酶样转录因子(helicase-like transcription factor,HLTF)抗体购自Cell Signaling Technology;抗磷酸化H2AX蛋白(γH2AX)抗体和抗β-actin抗体购自Abcam;BCA试剂盒购自Thermo;其它试剂均为国产分析纯。
2 方法
2.1细胞培养 HeLa、CaSki、C33A、SiHa和ESC细胞培养在DMEM完全培养基中(含10% FBS、1%青霉素和1%链霉素),置于37 ℃、5% CO2培养箱中培养,当细胞密度为80%~90%时进行细胞传代。
2.2miR-145表达水平的检测 收集正常培养的HeLa、CaSki、C33A、SiHa和ESC细胞,按照mir Vana miRNA分离试剂盒提取各细胞miRNA,运用Taqman miRNA检测试剂盒检测miR-145的表达水平;运用Trizol提取mRNA,采用SYBR GreenⅡ荧光染料法和IQ5TMReal-Time PCR Detection System(Bio-rad)进行real-time PCR数据分析,miR-145结果经U6 snRNA内参校正,HLTF结果经β-actin校正,miR-145和HLTF mRNA的相对表达量用2-ΔΔCt表示,进行3次独立重复实验。
2.3细胞转染 将处于指数生长期的HeLa、CaSki、C33A和SiHa细胞经0.25%胰蛋白酶消化,计数后以细胞密度为每孔2.0×104个接种于6 cm细胞培养皿中,培养至细胞密度为60%左右时按照Lipofectamine 2000说明书将miR-145-mimic和NC-mimic转染细胞。培养4 h后换成DMEM完全培养基;置于37 ℃、5% CO2培养箱中培养用于后续实验。
2.4电离辐射及MTT实验 按照X-射线生物辐照仪说明说进行操作,辐射剂量率为0.5 Gy/min,运用0.5 mm铝过滤器对X射线进行过滤;将转染的细胞经5 Gy电离辐射照射后,分别于0 h、24 h、48 h、72 h和96 h进行MTT实验,以未辐照细胞为实验对照组;每孔加入20 μL 5 g/L MTT,37 ℃培养4 h,弃除培养液,每孔加入150 μL DMSO,置于摇床上室温振荡5 min,用酶标仪测定570 nm处的吸光度(A)值,按以下公式计算细胞活力抑制率:细胞活力抑制率(%)=(1-实验组A值/对照组A值)×100%
2.5流式细胞术检测细胞凋亡 转染的4种宫颈癌细胞经10 Gy电离辐射照射,培养72 h后按照Annexin-V/PI试剂盒说明书操作;弃掉培养基,用预冷的PBS洗涤3次,细胞用无EDTA的胰蛋白酶消化,离心收集细胞,加入200 μL PBS制成细胞悬液;先加入500 μL的Binding Buffer重悬细胞,再加入5 μL FITC标记的Annexin-V和5 μL PI混匀,室温下避光孵育10 min,流式细胞术检测细胞凋亡。
2.6免疫荧光观察 转染的4种宫颈癌细胞经10 Gy电离辐射照射,分别于0 h、1 h和6 h进行免疫荧光;经细胞爬片,4%多聚甲醛固定室温固定15 min,PBS洗涤后经0.1% Triton X-100透化10 min,2% BSA封闭,孵育 I 抗γH2AX(1∶100)、II 抗AF488及DAPI核染色,共聚焦显微镜拍照。
2.7Western blot检测蛋白水平 转染的4种宫颈癌细胞经胰蛋白酶消化,离心收集细胞,加入200 μL RIPA细胞裂解液(50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,1% NP-40,0.5%脱氧胆酸钠,0.1% SDS)重悬细胞,超声破碎、12 000 r/min,4 ℃离心10 min,按照BCA试剂盒说明书测定蛋白浓度。取40 μg蛋白进行SDS-PAGE,将蛋白转移到PVDF膜上,10%脱脂奶粉室温封闭2 h,孵育 I 抗HLTF(1∶1 000),以β-actin为内参照,4 ℃孵育过夜。第2天用TBST洗膜3次、孵育 II 抗(HRP标记),室温孵育1 h。化学发光法显影,蛋白相对表达量经β-actin校正后用ImageJ软件计算灰度值。
3 统计学处理
运用SPSS 17.0统计软件进行统计学分析,结果用均数±标准差(mean±SD)表示,组间比较采用独立样本t检验,多组间多组间的比较采用单因素方差分析(one-way ANOVA),每个实验进行3次独立重复试验。以P<0.05为差异有统计学意义。
结 果
1 miR-145在宫劲癌细胞系中的表达水平
Real-time PCR结果示,miR-145在HeLa、CaSki、C33A和SiHa细胞中的表达水平均显著低于ESC(P<0.01)。当4株宫颈癌细胞转染miR-145-mimic 48 h后miR-145表达水平显著升高,与阴性对照组比较差异具有统计学意义(P<0.01),见图1。
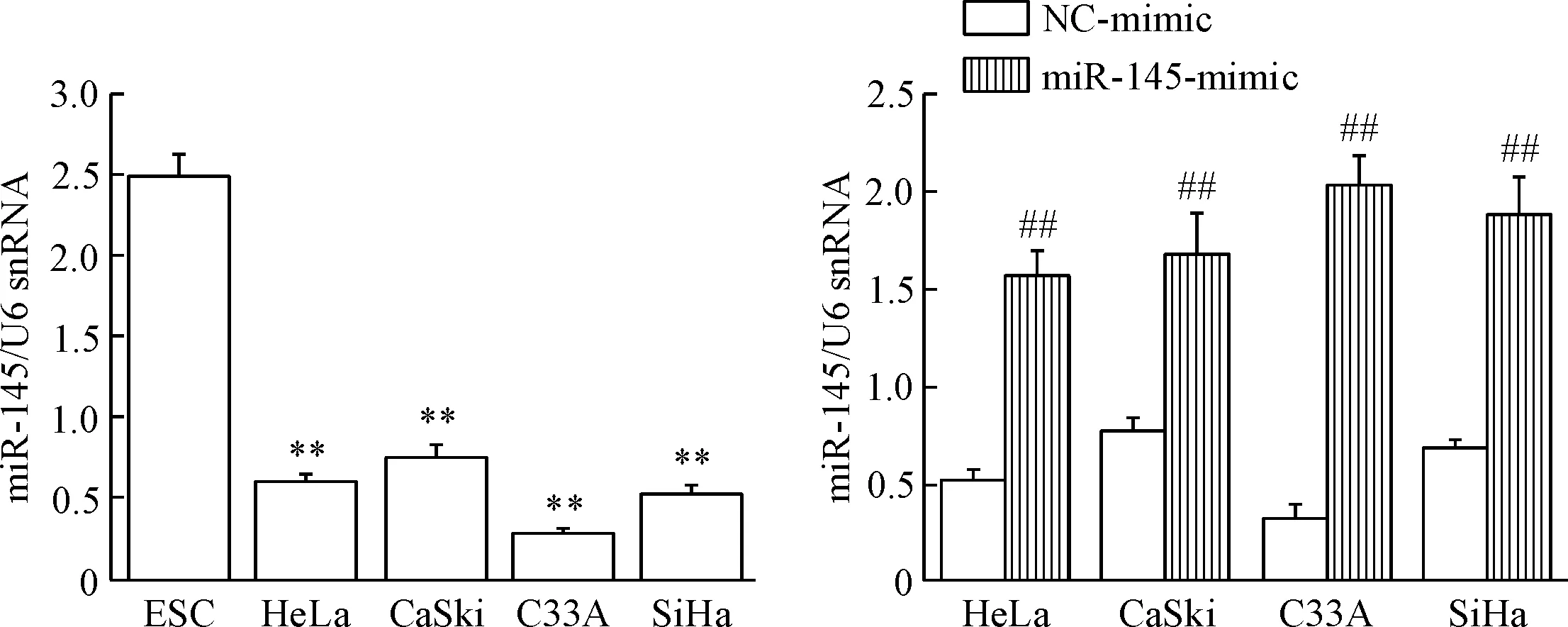
Figure 1. The expression level of miR-145 in the cervical cancer cells detected by real-time PCR. Mean±SD.n=3.**P<0.01vsESC;##P<0.01vsNC-mimic group.
图1Real-timePCR检测宫颈癌细胞中miR-145的表达水平
2 miR-145过表达对宫颈癌细胞辐射敏感性的影响
MTT结果示,NC-mimic和miR-145-mimic转染的宫颈癌细胞经电离辐射照射后,随着时间的延长,细胞活性均逐渐降低。NC-mimic细胞经电离辐射后,培养48 h的细胞活性与未辐照组比较差异具有统计学意义(P<0.05);miR-145-mimic转染的细胞经电离辐射照射后24 h之后细胞活性显著低于未辐照组细胞(P<0.05);同时,与NC-mimic细胞比较,电离辐射照射后相同条件下,miR-145过表达细胞活性显著降低,差异具有统计学意义(P<0.05),见图2。这说明miR-145过表达能增强宫颈癌细胞的辐射敏感性。
3 miR-145过表达对电离辐射诱导的宫颈癌细胞凋亡的影响
流式细胞术结果示,电离辐射诱导NC-mimic和miR-145-mimic转染的宫颈癌细胞凋亡,相同条件下,miR-145过表达的宫颈癌细胞凋亡率显著增高,与NC-mimic细胞比较差异具有统计学意义(P<0.05),见图3。这一结果说明miR-145过表达能增强电离辐射诱导宫颈癌细胞的凋亡。
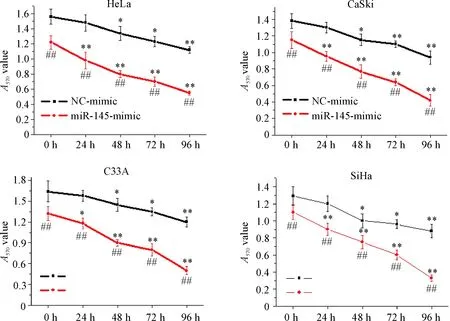
Figure 2. The effects of miR-145 over-expression on the radiosensitivity of cervical cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 h;##P<0.01vsNC-mimic group.
图2miR-145过表达对宫颈癌细胞辐射敏感性的影响

Figure 3. The effects of miR-45 over-expression on the apoptosis of the cervical cancer cells induced by ionizing radiation. Mean±SD.n=3.**P<0.01vsNC-mimic group.
图3miR-45过表达对电离辐射诱导的宫颈癌细胞凋亡的影响
4 miR-145过表达对电离辐射诱导的宫颈癌细胞DNA损伤修复的影响
免疫荧光观察结果显示,转染的4种宫颈癌细胞经电离辐射照射后1 h和6 h,DNA双链断裂(DNA double-strand break,DSB)标志物γH2AX的表达水平显著增加,提示电离辐射诱导宫颈癌细胞DNA损伤,随着时间的延长,γH2AX水平逐渐降低,提示部分DSB被修复;相同条件下,miR-145过表达的宫颈癌细胞中γH2AX的荧光强度显著高于NC-mimic细胞,两两比较差异具有统计学意义(P<0.05),提示miR-145过表达促进电离辐射诱导DNA损伤,增强细胞辐射敏感性,见图4。
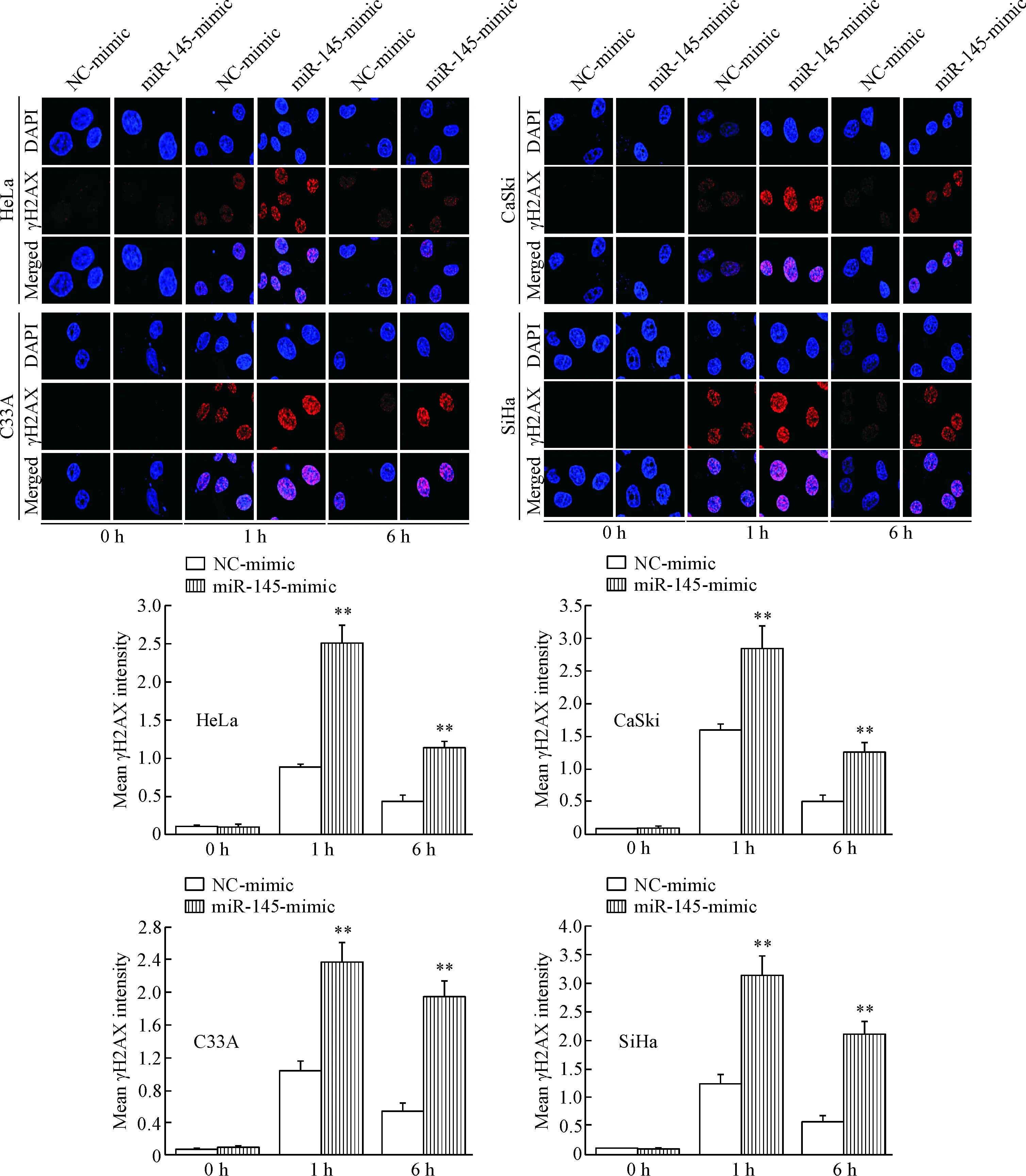
Figure 4. The effect of miR-145 over-expression on repair of DNA damage induced by ionizing radiation (×100). Mean±SD.n=3.**P<0.01vsNC-mimic group.
图4miR-145过表达对电离辐射诱导的DNA损伤修复的影响
5 miR-145过表达对HLTF表达水平的影响
Real-time PCR结果显示,HLTF的mRNA在4种宫颈癌细胞中高表达,Western blot结果进一步证实HLTF蛋白水平在宫颈癌细胞中高表达;而miR-145过表达显著抑制HLTF的mRNA和蛋白表达水平,见图5。HLTF高表达与宫颈癌放疗敏感性相关,HLTF通过促进DNA损伤修复诱导宫颈癌的放疗抵抗。本研究结果提示miR-145可能通过抑制HLTF的表达抑制DNA损伤修复,从而增强宫颈癌细胞的辐射敏感性。

Figure 5. The effects of miR-145 over-expression on the expression of HLTF at mRNA (A) and protein (B) levels in the cervical cancer cells. Mean±SD.n=3.**P<0.01vsNC-mimic group.
图5miR-145过表达对HLTFmRNA和蛋白表达水平的影响
讨 论
目前,根治性手术切除是早期宫颈癌的主要治疗方案,对于晚期和化疗耐受的患者首选放射治疗,放疗作为传统的治疗手段,能够消灭周亚临床病灶,在控制复发率和肿瘤转移中发挥重要作用。但是,放射治疗对于晚期转移性宫颈癌的治疗效果并不理想,5年生存率仅为20%~50%;资料显示,大多数晚期宫颈癌患者对放疗产生抵抗导致肿瘤复发和转移[16-17]。因此寻找和研发宫颈癌放疗增敏剂迫在眉睫。
miRNA的发现和认识为开发宫颈癌增敏剂的小分子药物提供了崭新的思路。大量研究发现miRNA的异常表达与调控细胞的增殖、凋亡、分化以及衰老,其作为肿瘤抑制因子或肿瘤促进因子参与肿瘤的发生和发展[5-9]。研究发现miR-145在多种肿瘤组织如前列腺癌、肝癌、乳腺癌及胃癌中低表达,进一步研究发现miR-145过表达通过抑制CDH2、RTKN、HDACs和HIF-2α的表达进而抑制肿瘤细胞增殖、侵袭和转移[18-22],认为miR-145是一个肿瘤抑制因子,在肿瘤发生发展中扮演重要作用。本研究结果显示,miR-145在4株宫颈癌细胞中低表达,而在正常子宫内膜细胞ESC中高表达,表明miR-145的下调表达与宫颈癌的发生发展密切相关,与文献报道[13-14]类似。为了进一步研究miR-145在宫颈癌细胞恶性表型中的作用,我们运用miR-145模拟剂实现miR-145在4株宫颈癌细胞中过表达,结果显示,miR-145过表达显著抑制宫颈癌细胞的增殖和凋亡,辐射照射后,miR-145过表达明显抑制细胞活性以及增强辐射诱导细胞凋亡率,表明miR-145过表达增强宫颈癌细胞的辐射敏感性。有研究发现在辐射诱导致癌模型的肿瘤组织以及辐射诱导的癌细胞中,miR-145的表达水平出现异常,提示miR-145的异常表达与电离辐射后细胞的应激反应有关。
目前,宫颈癌放疗抵抗的分子机制仍不清楚。以往研究发现,外界应激如紫外线、电离辐射,活性氧自由基等刺激细胞引起DNA损伤时,p53表达增高,通过激活下游靶基因p21的转录活性,使细胞周期阻滞,促进DNA损伤修复,无法修复的细胞通过细胞凋亡途径被清除。近期研究发现,DNA损伤激活p53表达进而促进肿瘤抑制型miRNA的转录如miR-16-1、miR-143和miR-145[14]。γH2AX是DNA双链断裂(DSB)的标志物,电离辐射杀死肿瘤细胞是通过诱导细胞DNA断裂,引起无法修复的DNA损伤最终诱导细胞死亡[23]。本研究结果显示,miR-145过表达的宫颈癌细胞中γH2AX表达水平显著高于对照组细胞,提示miR-145过表达DNA损伤加剧或DNA损伤修复功能被抑制。流式细胞术检测结果显示miR-145过表达明显促进电离辐射诱导细胞凋亡,提示miR-145过表达导致细胞中发生DNA损伤的积累,机体为了清除有害的细胞,部分损伤的细胞通过细胞凋亡途径得以清除。目前关于miR-145调控DNA损伤的机制是不清楚的。有研究表明DNA损伤发生时,H2AX在DSB位点被一些蛋白激酶如ATM、ATR、DNA-PK等PI3K家族激酶磷酸化(γH2AX),形成肉眼可见的荧光焦点。本研究结果显示miR-145过表达促进电离辐射诱导的γH2AX激活,其机制是否通过影响ATM、ATR、DNA-PK等的激酶活性进而影响γH2AX的水平,需要进一步研究。此外,有研究证实HLTF具有促进DNA损伤修复的功能,HLTF过表达增强宫颈癌细胞的辐射抗性[24]。本研究发现,miR-145过表达显著抑制HLTF的转录和和翻译,HLTF mRNA和蛋白水平显著低于对照组细胞,提示miR-145通过抑制HLTF的表达增强宫颈癌的放疗敏感性,但miR-145可否直接靶向HLTF还有待进一步研究。本研究为以miR-145为靶点研发宫颈癌小分子放疗增敏剂提供了理论依据。
[参考文献]
[1] Ferlay J, Forman D, Mathers CD, et al. Breast and cervical cancer in 187 countries between 1980 and 2010[J]. Lancet, 2012, 379(9824):1390-1391.
[2] Querleu D, Cibula D, Abu-Rustum NR. 2017 update on the Querleu-Morrow classification of radical hysterectomy[J]. Ann Surg Oncol, 2017, 24(11):3406-3412.
[3] Katsaros D, Gribaudo S. The proper use of multimodality treatment in locally advanced cervical cancer[J]. Gynecol Oncol, 2011, 121(2):422-423.
[4] Arvizo C, Mahdi H. Disparities in cervical cancer in African American women: what primary care physicians can do?[J]. Cleve Clin J Med, 2017, 84(10):788-794.
[5] Guo S, Guo X, Wang S, et al. Role of miR-29 as marker of risk of acute rejection after heart transplant[J]. Br J Biomed Sci, 2017, 74(4):187-192.
[6] Shu P, Fu H, Zhao X, et al. MicroRNA-214 modulates neural progenitor cell differentiation by targeting quaking during cerebral cortex development[J]. Sci Rep, 2017, 7:8014.
[7] Wu Y, Song Y, Xiong Y, et al. MicroRNA-21 (miR-21) promotes cell growth and invasion by repressing tumor suppressor PTEN in colorectal cancer[J]. Cell Physiol Biochem, 2017, 43(3):945-958.
[8] Tian Y, Luo A, Cai Y, et al. MicroRNA-10b promotes migration and invasion through KLF4 in human esophageal cancer cell lines[J]. Journal of biological chemistry, 2010, 285(11):7986-7994.
[9] Chun-zhi Z, Lei H, An-ling Z, et al. MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC cancer, 2010, 10:367.
[10] Metheetrairut C, Slack FJ. MicroRNAs in the ionizing radiation response and in radiotherapy[J]. Curr Opinion Genetics Dev, 2013, 23(1):12-19.
[11] Lee JH, Park SJ, Kim SW, et al. c-Fos-dependent miR-22 targets MDC1 and regulates DNA repair in terminally differentiated cells[J]. Oncotarget, 2017, 8(29):48204-48221.
[12] Ke G, Liang L, Yang JM, et al. MiR-181a confers resistance of cervical cancer to radiation therapy through targeting the pro-apoptotic PRKCD gene[J]. Oncogene, 2013, 32(25):3019-3027.
[13] Sharma S, Hussain S, Soni K, et al. Novel microRNA signatures in HPV-mediated cervical carcinogenesis in Indian women[J]. Tumour Biol, 2016, 37(4):4585-4595.
[14] Shi M, Du L, Liu D, et al. Glucocorticoid regulation of a novel HPV-E6-p53-miR-145 pathway modulates invasion and therapy resistance of cervical cancercells[J]. J Pathol, 2012, 228(2):148-157.
[15] 刘 聪. MicroRNA在辐射致癌中的作用及其辐射生物学效应研究[D]. 上海: 第二军医大学, 2010.
[16] 吴少雄. 子宫颈癌放射治疗的几个热点问题[J]. 广东医学, 2004, 25(2):120-121.
[17] Misra-Hebert AD. Cervical cancer in African American women: optimizing prevention to reduce disparities[J]. Cleve Clin J Med, 2017, 84(10):795-796.
[18] Gong P, Zhang T, He D, et al. MicroRNA-145 modulates tumor sensitivity to radiation in prostate cancer[J]. Radiat Res, 2015, 184(6):630-638.
[19] Gao P, Xing AY, Zhou GY, et al. The molecular mechanism of microRNA-145 to suppress invasion-metastasis cascade in gastric cancer[J]. Oncogene, 2013, 32(4):491-501.
[20] Ding Y, Zhang C, Zhang J, et al. miR-145 inhibits proliferation and migration of breast cancer cells by directly or indirectly regulating TGF-β1 expression[J]. Int J Oncol, 2017, 50(5):1701-1710.
[21] Noh JH, Chang YG, Kim MG, et al. MiR-145 functions as a tumor suppressor by directly targeting histone deacetylase 2 in liver cancer[J]. Cancer Lett, 2013, 335(2):455-462.
[22] Zhang H, PuJ, Qi T, et al. MicroRNA-145 inhibits the growth, invasion, metastasis and angiogenesis of neuroblastoma cells through targeting hypoxia-inducible factor 2 alpha[J]. Oncogene, 2014, 16, 33(3):387-397.
[23] Hopp N, Hagen J, Aggeler B, et al. Express γ-H2AX Immunocytochemical Detection of DNA Damage[J]. Methods Mol Biol, 2017, 1644(1):123-128.
[24] Cho SH, Cinghu S, Yu JR, et al. Helicase-like transcription factor confers radiation resistance in cervical cancer through enhancing the DNA damage repair capacity[J]. J Cancer Res Clin Oncol, 2011, 137(4):629-637.
