CTLA-4基因多态性与膀胱癌的易感性研究
2018-05-05刘贵喜李家兵
刘贵喜,李家兵,2
(1.西南医科大学临床医学院,四川泸州 646000;2.绵阳市第三人民医院,四川绵阳 621000)
膀胱癌(bladder cancer,BC)是常见的泌尿系统恶性肿瘤之一,具有高复发率、死亡率,近年来世界范围内确诊病例数提高了1.5倍,死亡率上升了1.3倍[1];在我国膀胱癌发病率逐年增加[2]。环境因素和遗传因素等多种因素参与了膀胱癌的发生和发展。研究发现T细胞的功能与机体抗肿瘤免疫联系密切,而细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)主要在人类活化的T细胞表面发挥生物学作用[3]。CTLA-4基因位于染色体2q33上,表达产物为白细胞表面抗原CD152,其与CD28竞争结合配体B7-1/B7-2,负向调节T细胞增殖与活化,降低机体抗肿瘤免疫反应,从而增加肿瘤的易感性[4]。研究发现,CTLA-4单核苷酸多态性(single nucleotide polymerphisms,SNPs)可从不同表达环节影响CTLA-4基因的表达,与肝癌、胃癌、乳腺癌等肿瘤的遗传易感性存在密切联系[5];同时也有极少数国外研究显示与膀胱癌存在相关性[6];关于CTLA-4基因多态性与四川东北部地区汉族人群膀胱癌的相关研究尚未见报道。本研究旨在分析CTLA-4 CT60G/A、-1661A/G基因多态位点在膀胱癌的分布,探讨CTLA-4基因多态性与膀胱癌之间的关联强度。
1 对象与方法
1.1研究对象采集2015年5月至2017年6月绵阳市第三人民医院、四川省人民医院、川北医学院附属医院等医院收治入院且病理确诊的初发膀胱癌患者241例,排除有血液性或其它自身免疫性疾病和肿瘤疾病病史患者。随机选取326例同期各医院健康体检者为对照组,均无肉眼血尿、镜下血尿,排除恶性肿瘤、血液或其他自身免疫性疾病史患者。两组研究对象均属于长期居住在四川东北部地区的汉族人群,在民族、性别、年龄、居住地相匹配。本研究获西南医科大学伦理委员会批准,临床资料及标本采集均获所有研究对象均知情同意。两组基线资料比较,两组间性别、年龄分布无统计学差异(P>0.05);吸烟、饮酒分布有统计学差异(P<0.001,表1、表2)。
年龄采用Student’s t test;性别、吸烟情况、饮酒情况采用卡方检验。
1.2研究方法
1.2.1外周血DNA提取 采集每位研究对象约4 mL空腹静脉血到放入含有乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的抗凝管中,采集血液后立即上下轻轻颠倒抗凝管8次以摇匀。用全血基因组小量抽提试剂盒(北京百泰克生物技术有限公司)提取全血DNA,操作步骤按照试剂盒说明书进行,分类标记置于-80 ℃冰箱冻存备用。

表2 病例组膀胱癌分期分级及转移情况 [例(%)]
注:低级别组:由尿路上皮乳头状癌低级别和低度恶性潜能尿路上皮乳头状瘤组成;NMIBC:非肌层浸润性膀肌癌(pTa-pTl);MIBC:肌层浸润性膀肌癌(pT2-pT4)。
1.2.2检测提取DNA的浓度与纯度 采用微量紫外分光光度计进行DNA的浓度和纯度的鉴定,读取并记录DNA在260 nm和280 nm波长处的吸光值与A值,提取的DNA在260 nm和280 nm波长处吸光值的比值于1.7~2.1之间,纯度合格。
1.2.3聚合酶链反应 根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的SNP数据库CTLA-4 CT60G/A、-1661A/G位点的序列(分别为rs3087243,rs4553808),并采用Premier5.0结合相关文献设计引物。PCR引物序列由上海生工生物有限公司合成,引物序列为CT60G/A:正向为5′-TGG TCG TTT TCC GGA GTT GTC-3′,反向为5′-GGT TGC CAA CAT TGG GGT TG-3′,-1661A/G:正向为5′-CTA AGA GCA TCC GCT TGC ACC T-3′,反向为5′-TTG GTG TGA TGC ACA GAA GCC TTT T-3′。扩增反应总体系为10 μL,反应条件为:94 ℃预变性3 min,然后进行30个循环:94 ℃变性30 s,以58 ℃退火30 s,72 ℃延伸1 min,最后72 ℃延伸5 min。扩增的DNA片段长度分别为394 bp和486 bp。产物通过120 mV、2.0%琼脂糖凝胶下进行电泳,以DNA分子量标准(DNA Marker)为参照观察,判断扩增产物分子量、有无特异性扩增。
1.2.4限制性片段长度多态性聚合酶链反应(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法检测CTLA-4 CT60G/A、-1661A/G位点的基因型 扩增产物分别采用限制性内切酶HpyCH4 IV(CT60G/A)、内切酶Msel(-1661A/G)进行酶切,水浴2 h,取酶切产物5 μL上样,并以DNA Marker作为标准参照,于2%琼脂糖120 V恒压,40 min电泳分离,紫外光凝胶成像系统观察DNA条带。
1.2.5PCR-RFLP产物测序验证 从标本库中分别随机选取CTLA-4 CT60G/A、-1661A/G两个位点3种不同的PCR-RFLP分型结果的标本各20例,将PCR产物标注好相应信息后送上海生工公司进行DNA测序确认,其测序结果与PCR-RFLP分型结果一致。
1.3统计学方法采用SPSS 22.0统计学软件进行数据分析,用χ2检验进行Hardy-Weinberg遗传平衡检验,各组之间的基因型差异以χ2检验进行比较,以非条件logistic回归分析统计不同遗传模型与膀胱癌易感性及临床特征的关系,结果以比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)表示,均以P<0.05为差异有统计学意义。
2 结 果
2.1基因检测结果及PCT-RFLP酶切电泳图片图1~图4。

图1CTLA-4CT60G/A多态位点PCT-RFLP酶切电泳图
1、2、4、6:GG型(244 bp+150 bp);3:AG型(394 bp+244 bp+150 bp);5:AA型(394 bp)。
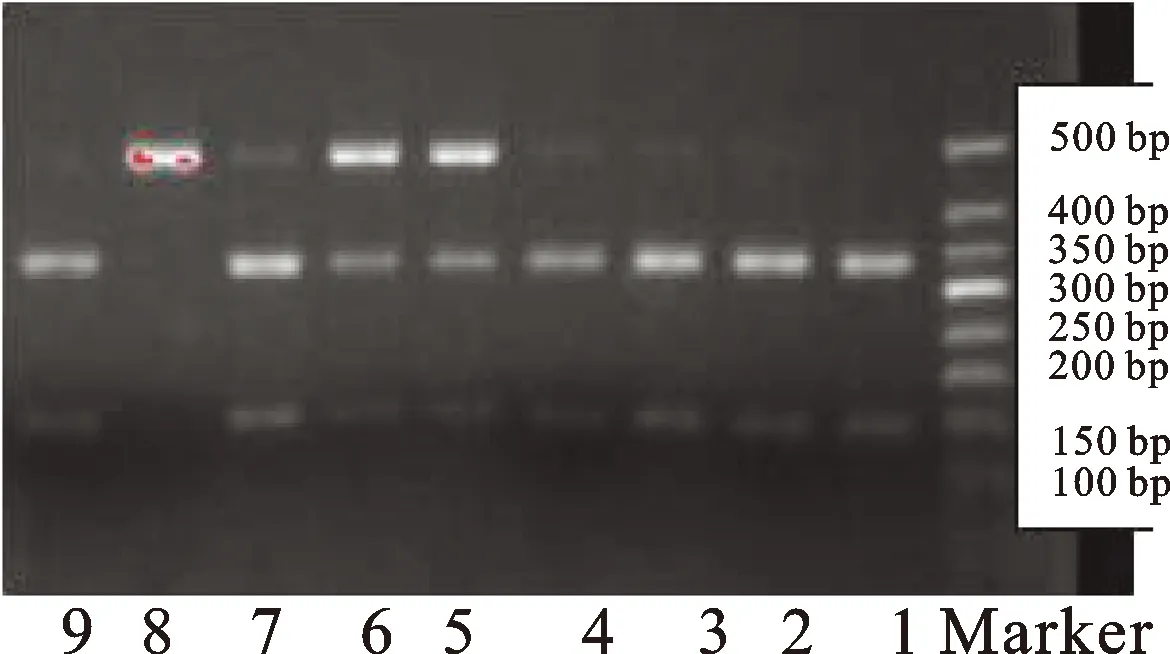
图2CTLA-4-1661A/G多态位点PCT-RFLP酶切电泳图
1、2、3、4、7、9:AA型(347 bp+139 bp);5、6:AG型(486 bp+347 bp+139 bp);8:GG型(486 bp)。

图3 CTLA-4 CT60G/A 的3种基因型

图4 CTLA-4-1661A/G 的3种基因型
2.2遗传平衡检验对照组采用拟合度χ2检验行Hardy-Weinberg遗传平衡检验,P>0.05,对照组人群符合Hardy-Weinberg遗传平衡,具有人群代表性。
2.3CTLA-4CT60G/A、-1661A/G基因型分布CT60G/A位点基因型频率在两组的分布差异有统计学意义(χ2=8.74,P=0.013),等位基因频率在两组的分布差异无统计学意义(χ2=2.783,P=0.095)。-1661A/G位点基因型频率在两组的分布差异有统计学意义(χ2=7.689,P=0.021),等位基因频率在两组的分布差异有统计学意义(χ2=7.360,P=0.007,表3)。
2.4CT60G/A、-1661A/G基因模型下logistic回归分析CT60G/A基因位点:在对照组与病例组中进行不同基因模型下的logistic回归分析结果显示(表4):通过合并杂合子与突变型纯合子,组成显性基因模型,CT60G/A GG可使膀胱癌的患病风险增加1.239倍,OR(95%CI)为1.239(1.039,1.478),P=0.017,校正混杂因素(如性别、年龄、饮酒以及吸烟等)后OR(95%CI)为1.289(1.065,1.559),P=0.009。
-1661A/G基因位点:在对照组与病例组中进行不同基因模型下的logistic回归分析结果显示(表5):-1661A/G AG+GG可使膀胱癌的患病风险增加1.549倍,OR(95%CI)1.549(1.093~2.195),P=0.014;校正混杂因素(如性别、年龄、饮酒以及吸烟等因素)后OR(95%CI)为1.696(1.162~2.474),P=0.006。等位基因模型中,G等位基因与A等位基因相比可显著增加膀胱癌的发病风险,OR(95%CI)为1.506(1.119~2.027),P=0.007。
2.5CT60G/A、-1661A/G基因多态性与膀胱癌临床特征的关系按照膀胱癌的分级、分期、转移情况进行分组~采用非条件Logistic回归分析,通过校正吸烟、饮酒、性别、年龄等因素。在CT60G/A基因位点病例组中,各个基因模型与膀胱癌临床分级、分期、转移之间无相关性,P值均无统计学意义。在-1661A/G基因位点病例组中显性模型AG/GG基因型分别与膀胱癌分期、转移相关,OR、95%CI、P值分别为0.514(0.294~0.899)、P=0.02;0.415(0.212~0.812)、P=0.01,具有统计学意义。其余各基因模型与膀胱癌临床分级、分期、转移之间无相关性,P值均无统计学意义(表6)。

表3 病例组与对照组等位基因频率及基因型分布的比较 [例(%)]
表4CT60G/A病例组与对照组不同基因模型下的Logistic回归分析

基因模型基因型病例组[n(%)]对照组[n(%)]OR(95%CI)P值校正OR(95%CI)Pa值共显性模型GG167(69.29)194(59.51)11AA61(25.31)120(36.81)0.591(0.407~0.856)0.0050.510(0.340~0.765)0.001AG13(5.39)12(3.68)1.258(0.559~2.833)0.5791.761(0.743~4.175)0.199显性模型AG+AA74(30.71)132(40.49)11GG167(69.29)194(59.51)1.239(1.039~1.478)0.0171.289(1.065~1.559)0.009隐性模型AA13(5.39)12(3.68)11GG+AG228(94.61)314(96.32)0.67(0.300~1.496)0.3290.464(0.198~1.089)0.078等位基因模型G395(81.95)508(77.91)11A87(18.05)144(22.09)1.287(0.9561.732)0.096
Pa值为校正混杂因素(性别、年龄、吸烟、饮酒)后的基因模型下的Logistic回归分析。
表5-1661A/G病例组与对照组不同基因模型下的Logistic回归分析

基因模型基因型病例组[n(%)]对照组[n(%)]OR(95%CI)P值校正OR(95%CI)Pa值共显性模型GG12(4.98)7(2.15)11AA143(59.34)226(69.32)0.369(0.142~0.960)0.0410.326(0.118~0.905)0.031AG86(35.68)93(28.53)0.539(0.203~1.433)0.2160.519(0.183~1.476)0.219显性模型AA143(59.34)226(69.33)11AG+GG98(59.34)100(59.34)1.549(1.093~2.195)0.0141.696(1.162~2.474)0.006隐性模型AA+AG229(40.66)319(97.85)11GG12(4.98)7(2.15)1.545(0.962~2.482)0.0721.621(0.978~2.687)0.061等位基因模型A372(77.18)545(83.59)11G110(22.82)107(16.41)1.506(1.119~2.027)0.007
Pa值为校正混杂因素(性别、年龄、吸烟、饮酒)后的基因模型下的Logistic回归分析。
表6分层分析-1661A/G基因多态性与膀胱癌的相关性

基因模型基因型低级别组/高级别组OR(95%CI)P值NMIBC/MIBCOR(95%CI)P值无转移/转移OR(95%CI)P值共显性模型GG111AA0.8(0.242~2.649)0.7153.512(0.742~16.617)0.1131.206(0.311~4.679)0.787AG0.641(0.186~2.202)0.481.935(0.395~9.488)0.4160.44(0.103~1.879)0.268显性模型AA111AG+GG0.848(0.493~1.460)0.5530.514(0.294~0.899)0.020.415(0.212~812)0.01隐性模型AA+AG111GG1.165(0.646~2.100)0.6130.593(0.274~1.282)0.1841.065(0.544~2.084)0.858
NMIBC:非肌层浸润性膀肌癌(pTa-pTl);MIBC:肌层浸润性膀肌癌(pT2-pT4);低级别组由尿路上皮乳头状癌低级别和低度恶性潜能尿路上皮乳头状瘤组成。
3 讨 论
膀胱癌发生发展与环境因素和遗传因素密切相关。其中,肿瘤微环境中的免疫系统针对宿主对肿瘤细胞的免疫效应产生抑制,肿瘤细胞控制的抑制机制和宿主控制的免疫机制平衡被打破,从而导致癌症的发生或发展。肿瘤细胞通过调节多种肿瘤相关因子而实现抗肿瘤免疫效应,如调节T细胞活性[7]。
研究表明通过T细胞表面CTLA-4异常聚集将导致T细胞抗肿瘤功能减低,其主要通过阻碍MHC与T细胞受体结合过程发挥作用[8]。CTLA-4分泌白细胞介素-10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)两种细胞因子,可分别通过降低CD8+细胞毒性T细胞和CD4+Th细胞生物学功能,直接抑制抗肿瘤免疫反应[9]。CTLA-4通过介导不依赖Fas途径的T细胞凋亡、抑制T细胞分化、降低白细胞介素-2(interleukin-2,IL-2)转录等方式抑制T细胞增殖、细胞因子的产生及相关免疫反应[10],同时CTLA-4可调节T细胞活化周期停滞于G1或G0期,不向S期进展,对T细胞活化周期的抑制直接导致T细胞活化功能显著降低[11],导致机体最终发生肿瘤或免疫性疾病。
CTLA-4负性调节T细胞功能与肿瘤关系密切,目前诸多研究显示CTLA-4基因存在多个基因多态性位点,包括:CTLA-4+49G/A、-1661A/G、CT60 G/A、-318 T/C等多态性位点,其中CTLA-4 CT60 G/A、-1661A/G与多种肿瘤易感性相关。CTLA-4 CT60G/A位于CTLA-4基因3′UTR,其基因多态性导致CTLA-4蛋白表达过程中mRNA表达水平的差异。通常认为sCTLA-4发挥抑制作用需通过与膜表面蛋白结合的形式与B7-mCTLA4竞争性结合配体实现。sCTLA-4的水平降低,相对加强了B7-mCTLA4的作用,抑制T细胞活化,完成诱导了T细胞无能过程[12]。研究发现CT60 G/A位点G等位基因与可溶性CTLA-4(sCTLA-4)联系密切,通过决定剪接作用效率和sCTLA-4 mRNA产量,调控sCTLA-4相对于全长CTLA-4的量。GG基因型个体较AA基因型个体,sCTLA-4产量明显减少。
本研究通过对CT60G/A不同基因模型下的Logistic回归分析显示:GG可使膀胱癌的患病风险增加1.239倍[OR(95%CI)为1.239(1.039,1.478)],在等位基因模型中P=0.096,无统计学意义,这与JAISWAL等[6]的实验结果存在差异,这可能与实验对象的种族、数量、环境等有关,未来需进一步多中心、大样本的研究进行验证;CTLA-4基因-1661A/G 病例组携带G等位基因较A等位基因显著增加膀胱癌的发病风险[OR(95%CI)为1.506(1.119,2.027)]。显性模型中AG+GG可使膀胱癌的患病风险增加1.696倍OR(95%CI)为1.696(1.162,2.474)。CTLA-4-1661A/G位于CTLA-4基因启动子区,其等位基因的变异可能改变功能性DNA结合位点的碱基序列,从而影响相关转录因子的亲和力,这对转录和选择性剪接的调节非常重要[13]。JIANG等[14]认为-1661A/G G位点通过改变有关CTLA-4转录结合位点上具有转录功能的结构区域,导致CTLA-4的表达异常,从而导致肿瘤的产生。
我们的结果提示-1661 A/G位点与四川东北部地区汉族人群的膀胱癌易感性相关,CTLA-4 CT60G/A位点中,显性模型下GG基因型增加罹患膀胱癌的风险;在-1661 A/G位点的显性模型下AG/GG基因型与膀胱癌的临床分期、转移相关,P值均<0.05,表明单核苷酸基因多态性不仅与肿瘤的遗传易感性相关,同时也可能与肿瘤的临床特征(分期、分级、转移)相关,这一特点未来可能成为肿瘤的发生、发展甚至预后的关键标志指标;同时,也进一步证明了膀胱癌的发生、发展与基因遗传因素密切相关。本研究仍存在一定的局限性,所采集的研究对象均来自长期居住在四川东北部地区的汉族人群,缺乏单核苷酸基因多态性与膀胱癌关系的具体作用机制,且国内外研究中关于CTLA-4单核苷酸基因多态性与膀胱癌关系的具体作用机制不明确,故在遗传因素与疾病的关系中,是否存在相互改变或先因后果的联系,仍有待进一步验证,未来需要更大样本量、多种族、多中心的临床研究来进行验证,同时改进实验方法,更深入的探索遗传因素与膀胱癌的具体作用机制,人类在诸多疾病与遗传因素的研究中仍然任重而道远。
参考文献:
[1] DY GW,GORE JL,FOROUZANFAR MH,et al.Global burden of urologic cancers,1990-2013[J].Eur Urol,2017,71 (3):437-446.
[2] 韩苏军,田张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J],癌症进展,2013,11(1):89-95.
[3] PEGGS KS,QUEZADA SA,ALLISON JP,et al.Cell intrinsic mechanisms of T cell inhi-bition and application tocancer therapy[J].Immunol Rev,2008,224(8):141-165.
[4] DE PALMA M.The role of the immune system in cancer:from mechanisms to clinical applications[J].Biochim Biophys Acta,2016,1865(1):1-2.
[5] LI D,ZHANG Q,XU F,et al.Association of CTLA-4 gene polymorphisms with sporadic breast cancer risk and clinical features in Han women of northeast China[J].Mol Cell Biochem,2012,364(1-1):283-290.
[6] JAISWAL PK,SINGH V,MITTAL RD,et al.Cytotoxic T lymphocyte antigen 4 (CTLA4) gene polymorphism with bladder cancer risk in North Indian population[J].Mol Biol Rep,2014,41(2):799-807.
[7] MISKA J,BAS E,DEVARAJAN P,et al.Autoimmunity-mediated antitumor immunity:tumor as an immunoprivileged self[J].Eur J Immunol,2012,42(10):2584-2596.
[8] NIRSCHL CJ,DRAKE CG.Molecular pathways:co-experssion of immune checpoint molecules:signaling pathways and implications for cancer immunotherapy[J].Clin Cancer Res,2013,19(18),4917-4924.
[9] STEINMAN L.Conflicting consequences of immunity to cancer versus autonnmum-ty to nenrons:insights from paraneoplastic disease[J].Eur J Immunol,2014,44(11):3201-3205.
[10] HOU TZ,QURESHI OS,WANG CJ,et al.A transendocytosis model of CTLA-4 func-tion predicts its suppressive behaviour on regula-tory T cells[J].J Immunol,2015,194(5):2148-2159.
[11] PERAINO JS,ZHANG H,LI G,et al.Molecular basis of crossspecies reactivities of human versus porcine CTLA-4[J].Hum Immunol,2013,74(7):842-848.
[12] DAROSZEWSKI J,PAWLAK E,KARABON L,et al.Soluble CTLA-4 receptor an immunologi-cal marker of Graves’ disease and severity of ophthalmopathy is associated with CTLA-4 Jo31 and CT60 gene polymorphisms[J].Eur J Endocrinol,2009,161(5):787-793.
[13] LI D,ZHANG Q,XU F,et al.Association of CTLA-4 gene polymorphisms with sporadic breast cancer risk and clinical features in Han women of northeast China[J].Mol Cell Biochem,2012,364(1-2):283-290.
[14] JIANG T,GE LQ,CHEN ZT,et al.Effect of cytotoxic T lymphocyte-associated molecule 4 1661 gene polymorphism on its expression and transcription in ulcerative colitis[J].J Digest Dis 2010,11(6):369-375.
