乳腺硬化性腺病的影像表现及病理分析
2018-05-04李艳翠梁雯彭峰河王海丽王晓艳彭如臣
李艳翠,梁雯,彭峰河,王海丽,王晓艳,彭如臣*
乳腺硬化性腺病(sclerosing adenosis,SA)是乳腺腺病的一种特殊类型,是腺病发生的晚期阶段。病理主要以间质成分增生为主,伴小叶内末梢导管上皮、腺泡上皮、肌上皮细胞增生,病理和影像学表现与恶性肿瘤类似,术前诊断困难,临床易误诊为乳腺癌[1]。为减少术前误诊率,本研究回顾分析41例(43个病灶)经病理证实为SA的病例,探讨其影像特征及与病理的关系,为临床诊断提供参考。
1 材料与方法
1.1 一般资料
收集2015年3月-2017年5月经我院病理证实为SA或SA为主,且术前行X线摄片、超声或乳腺磁共振成像(magnetic resonance imaging,MRI)检查的41例(43个病灶)患者影像、病理资料,患者均为女性,年龄36~67岁,平均48.7岁。41例患者中,20例患者自述与月经周期无关的局部或双乳胀痛、压痛,5例乳头溢液,5例发现乳房肿块,11例体检发现超声异常或钼靶微钙化。触诊:5例患者触及边界欠清肿块,20例触及腺体局部增厚,16例无明显体征。
1.2 检查方法
39例行乳腺X线摄影,38例行乳腺超声,29例行乳腺MRI检查。(1)乳腺X线摄影:采用Planmed Nuance数字化乳腺成像系统,常规头尾位及侧斜位,双侧对比,必要时采取特殊体位或局部加压放大摄片。(2)超声检查:采用日本日立Hitachi超声诊断仪,探头中心频率:13~5 MHz。(3)MRI检查:采用德国Siemens Magnetom Skyra 3.0 T超导型MR扫描仪,8通道相控阵乳腺表面线圈。检查前,患者手背静脉或者肘静脉放置留置针,俯卧位,双乳腺自然垂悬于线圈洞穴内,平扫序列包括:T2横断面反转恢复序列:TR 4000 ms,TE 54 ms,反转角230°,层厚4 mm,间隔0.8 mm;T1横断面非脂肪抑制三维扰相梯度回波序列:TR 6.0 ms,TE 2.46 ms,反转角15°,层厚1.2 mm;扩散加权成像(diffusion weighted imaging,DWI)采用横断面平面回波成像序列:TR 5100 ms,TE 49 ms,反转角180°,层厚5 mm,层间距1 mm,b=50、800 s/mm2。动态增强MRI(dynamic contrastenhanced MR imaging,DCE-MRI)扫描采用T1WI横断面脂肪抑制3D扰相梯度回波序列,TR 4.49 ms,TE 1.68 ms,反转角10°,FOV 340 mm×340 mm,层厚1.2 mm,第一次扫描为不注射对比剂的蒙片扫描,之后用高压注射器以2 ml/s流率注射对比剂Gd-DTPA 0.2 mmol/kg,继续以相同流率注射10 ml生理盐水冲管,然后无间隔扫描7个时相,每个时相采集约1 min。
将原始图像传至Syngo.Via影像后处理工作站,感兴趣区(region of interest,ROI)选在病变强化最明显区域,避开囊变坏死及病灶边缘,绘制增强时间信号强度曲线(time intensity curve,TIC);采用三维MIP软件,用相对显著强化峰值的时相(第3期)图像与平扫图像(蒙片)进行减影,行MIP重组获得三维重组图像。
1.3 图像分析
X线摄影和MRI图像由2名从事乳腺诊断8年以上的放射科医师共同阅片,达成一致意见。超声图像由1名8年以上从事乳腺超声诊断的超声科医师阅片。征象描述参照美国放射学会推荐的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)记录BI-RADS分类,BIRADS分类1~3认为是良性病变;4A为可疑低度恶性病变;4B~5为恶性病变;0为不完全诊断,需进一步行其他检查。BI-RADS分类≥4B认为是恶性,依此计算误诊率及准确率。
2 结果
2.1 病变部位
43个病灶中,两例为双侧病灶,余均为单侧发病。左乳外上象限16个(37.2%),左内上3个(7.0%),右外上19个(44.2%),外下2个(4.7%),右内上3个(7.0%)。
2.2 X线表现
钼靶检查39例患者,其中单纯结节状稍高密度影9例(23.1%),其中3例边界清晰,6例边界模糊;不对称致密8例(20.5%)(图1);腺体结构扭曲8例(20.5%),其中6例中心见“黑星”,1例见“白星”;结节伴钙化8例(20.5%),其中3例伴粗糙不均质钙化(图2),5例伴弥漫小点状钙化;单纯区域分布小点状、沙粒样钙化3例;3例未见异常。
2.3 超声表现
38例SA患者行超声检查,其中35例见结节(图3),其超声特征见表1,3例未见异常。76.3%(29/38)的病灶边界清晰,55.3%(21/38)的形状规则,71.1%的回声不均匀(27/38),92.1%(35/38)的无或少量点线状血流信号,92.1%(35/38)的低回声。
2.4 MRI表现
29例SA患者乳腺MRI特征见表2。29例乳腺MRI检查患者,16例病灶DWI序列轻度扩散受限,呈稍高信号(图4A、4B),13例未见明显扩散受限,所有病灶均强化;肿块样强化18例,其中12例病灶边缘不清,腺体结构紊乱,呈星芒状改变,另3例边缘不规则,3例边界清晰。12例病灶强化不均匀,内见小点状未强化低信号(图4C~4E),4例见线状低信号分隔,2例肿块样病灶均匀强化。11例呈非肿块样强化病灶中,6例多发局灶性强化,3例段样强化,2例导管样强化。所有病例皮肤、乳头及腋下淋巴结未见明确异常。

图1 女,42岁,硬化性腺病,右乳上象限不对称致密 图2 女,47岁,硬化性腺病。A:左乳上象限结节伴钙化;B:结节伴钙化局部加压,可见粗糙不均质钙化 图3 女,52岁,超声不规则肿块,边缘清楚,无后方声影,无血流 图4 女,45岁,右乳外上硬化性腺病。A:病灶DWI为不均匀高信号;B:ADC图像信号未见明显减低,ADC值约1.374×10-3 mm2/s;C:增强病灶强化,内见线样低信号无强化;D、E:TIC为流出型 图5 病理见硬化性腺病(HE染色,×100)Fig.1 Female, 42 years old, sclerosing adenosis, asymmetric density in the right breast. Fig.2 Female, 47 years old, sclerosing adenosis. A: Mass combining with calcifications in the left breast; B: Local pressurization, coarse granular calcification is finded. Fig.3 Female, 52 years old, ultrasound showed irregular shape lumps, clear edge, no posterior shadow, no blood fl ow. Fig.4 Female, 45 years old, SA in the right upper breast. A: DWI showed slightly higher signal; B: ADC 1.374×10-3 mm2/s; C: The lesions were enhanced, with low signal intensity and no enhancement; D, E: TIC is Ⅲ.Fig.5 SA of the breast proved by histopathology (HE staining, ×100).
2.5 病理结果
43例SA患者中,29例单纯SA(图5),5例伴大汗腺化生,4例伴导管内乳头状瘤,4例伴纤维腺瘤,1例伴灶状钙化。
2.6 SA患者不同影像检查BI-RADS分类结果
乳腺X线摄影、超声及MRI诊断SA的误诊率分别为19.4%(10/39)、17.1%(6/35)和17.2%(5/29)。超声诊断≥4B的6例患者中,X线摄影诊断BIRADS 3类者2例,4A类者2例,MRI诊断3类者2例;X线诊断≥4B的10例中,超声诊断3类者4例,4A类者2例,MRI诊断3类者4例,4A类者1例;MRI诊断≥4B的5例患者中,超声诊断3类者1例,4A类者2例,钼靶诊断3类者1例,4A类者1例;3种检查结合,诊断SA准确率为93.1%(27/29)。见表3。
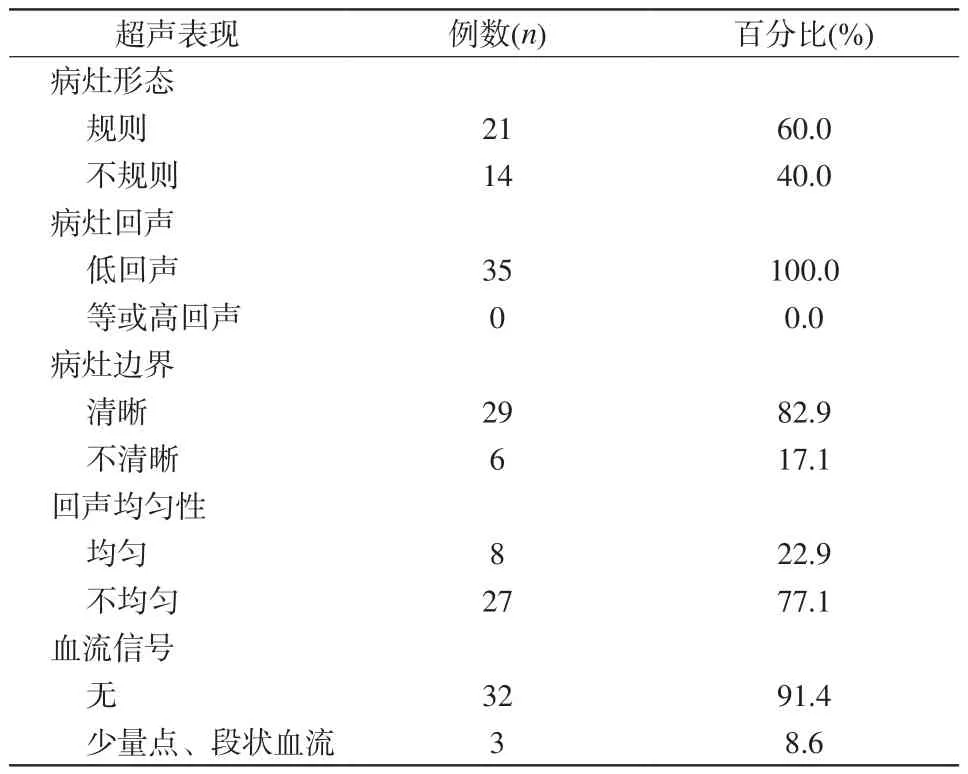
表1 超声发现异常的35例SA患者特征Tab.1 Characteristics of SA in 35 patients detected by ultrasound

表2 29个SA病灶的MRI特征Tab.2 MRI features of 29 SA lesions

表3 不同检查方法对SA的BI-RADS分类Tab.3 BI-RADS grading of SA by different examination methods
3 讨论
3.1 临床及病理学特点
SA常发生于围绝经期妇女(45~55岁),绝经后萎缩。本组病例年龄36~67岁,平均48.7岁,与文献相符[2]。大多学者认为本病与雌激素水平升高有关[3]。它以小叶为中心,腺泡、肌上皮及结缔组织增生、排列紊乱,小叶间疏松间质被增生、透明变性的胶原化纤维组织取代。高倍镜下增生的腺管受压变形,腺腔变窄闭塞,甚至呈单排梭形细胞,与硬癌、小管癌及小叶癌易混淆。SA常与其他病变共存,本组病例中有32.5%(14/43)伴有其他病变,与文献叙述基本一致[2]。
3.2 影像学表现
3.2.1 X线表现
SA的X线表现多样,可为形态不规则肿块、钙化、腺体不对称致密、结构扭曲(见条索状影及星状影)等[2]。本研究中17个(43.6%)病灶表现为中等密度肿块(肿块9例,肿块伴钙化8例),与乳腺癌高密度肿块略有不同;11个(28.2%)病灶出现微钙化,其中小点状钙化5个,粗糙不均质钙化3个,多形性钙化3个,与乳腺癌相比,本病钙化灶形状较规则、分布较松散。11个出现微钙化的病灶中,3例病理为单纯SA,3例合并大汗腺化生,3例合并纤维腺瘤,2例合并导管内乳头状瘤,伴发其他病变者钙化检出率高于单纯SA。结构扭曲8例病灶中,6例表现为“黑星”,即中心为稍低密度,病理基础为被包绕的脂肪组织,1例为“白星”,即病变中心为稍高密度,考虑与伴随乳头状瘤有关。由于只是腺小叶及间质纤维增生,不形成肿瘤,病灶常只在一个投照体位显示,或者2个体位形态相差较远,本组有9例属于此种情况。
3.2.2 超声表现
本病的超声表现多样,部分与恶性病变有重叠之处[4-5]。本组病例显示,SA患者超声多表现为形状规则(54.5%)、回声不均匀(69.7%)、无或少量点线状血流信号(90.9%)的低回声结节。5例病灶后方见声影衰减,可能与SA病灶富含纤维组织成分有关。超声检查能更清楚地显示小病灶的形态特征及内部特征,还可进一步评价其血流动力学特征,超声检出血流的3个病灶中1例伴发纤维腺瘤,2例伴发导管内乳头状瘤,伴发其他病变者血流检出率高。
3.2.3 乳腺MRI表现
乳腺MR检查具有较高的软组织分辨率,优势明显[6]。本组病例显示,乳腺SA在T1WI序列多为低信号,T2WI序列多为不均匀高信号,考虑为显著增生的纤维间质与其内散在密集增生的腺泡细胞含水量不同导致。增强后62.1%(18/29)病灶呈肿块样强化,其中8例病灶边界不清,腺体结构紊乱,呈星芒状肿块样改变,镜下观察病灶中心主要为弹性纤维组织及扭曲增生的导管和小叶,星芒状毛刺主要由纤维组织构成,并可见少量炎性细胞浸润,所以这种星芒表现为比较纤细、柔软、长短较均匀的毛刺。
动态增强MRI可反映病变的血液动力学特征,29个病灶中,27个(93.1%)病灶TIC呈Ⅰ型或Ⅱ型;另外,本组病例中16个病灶DWI序列轻度扩散受限,13个未见明显扩散受限,表观扩散系数(apparent diffusion coefficient,ADC)肿块为(1.43±0.15) mm2/s,乳房腺体为(1.71±0.16) mm2/s,和乳腺癌ADC值明显减低有鉴别意义[6-8]。有关单纯SA病变与伴发其他病变的SA病灶的MRI表现差异需要进一步积累病例进行观察。
本组病例中,乳腺X线摄影、超声及MRI诊断SA的误诊率(BI-RADS分类≥4B)分别为19.4%(10/39)、17.1%(6/35)和17.2%(5/29)。3种检查结合,SA的诊断准确率为93.1%(27/29)。影像检查易高估病灶分类,其原因与该病病理复杂多样,且多伴有其他病变、影像表现缺乏特异性有关,而且也与检查者对该病征象认识不足有关。
3.3 与乳腺癌鉴别诊断
本病主要需与乳腺癌相鉴别[9],病理鉴别要点为本病可见肌上皮细胞,且细胞无异型及坏死[10]。X线检查中SA多表现为中等密度肿块,病灶中心为“黑星”,2个投照体位病变形态变化较大;乳腺癌一般表现较高密度肿块,中心为“白星”,2个体位形态变化不大;SA常伴扩散、区域或小簇状分布比较松散的小点状钙化,而乳腺癌常伴团簇状、段样、线样分布的针尖样、分枝状、多形性钙化,分布比较密集。本病超声声像图上表现为无或少血流信号的低回声结节灶,乳腺癌一般血流信号比较明显。MRI检查本病T2WI序列多信号不均匀,毛刺柔软、细而长;而乳腺癌多为分叶状T2WI高信号肿块,毛刺根粗、尖细;此外,病灶时间信号曲线多为Ⅰ或Ⅱ型,DWI序列一般轻度或无明显受限,乳腺癌时间信号曲线多为Ⅱ型或Ⅲ型,DWI序列多数明显扩散受限。另外,SA一般无腋窝淋巴结、皮肤、乳头或乳腺后脂肪间隙的异常发现。
综上所述,SA属于良性病变,当X线摄影显示不规则结节或稍松散钙化,超声为回声不均匀的无或少血流信号的低回声结节,MRI检查T2WI序列信号不均匀,增强扫描呈星芒状小肿块,DWI图像轻度或无扩散受限,ADC值减低不明显时应考虑该病。乳腺钼靶、超声及MRI检查联合应用,有利于提高该病的诊断准确率。但是,由于该病影像表现特异性不高,易误诊为恶性病变,所以全面、细致地认识该病影像表现并继续探究该病特异影像特征很有必要,其中MRI检查可提供更多、更有价值的评价指标[11-12],有望成为诊断SA的重要手段。
利益冲突声明:
本研究过程和结果均未受到相关设备、材料、药品企业的影响。
参考文献 [References]
[1]Visscher DW, Nassar A, Degnim AC, et al. Sclerosing adenosis and risk of breast cancer. Breast Cancer Res Treat, 2014, 144(1): 205-212.
[2]Gunhan-Bilgen I, Memis A, Ustun EE, et al. Sclerosing adenosis:Mammographic and ultrasonographic findings with clinical and histopathological correlation. Eur J Radiol, 2002, 44(3): 232-238.
[3]Wang JC, Yang Y, Miao CM, et al. The analysis of clinical X-ray manifestations for breast sclerosing adenosis. J Med Imaging, 2016,17(6): 515-516.王金昌, 杨越, 缪春梅, 等. 乳腺硬化性腺病临床X线征象分析. 实用医学影像杂志, 2016, 17(6): 515-516.
[4]Cho SH, Park SH. Mimickers of breast malignancy on breast sonography. J Ultrasound Med, 2013, 32(11): 2029-2036.
[5]Zheng L, Lü XM, Hang FG. Ultrasonographic of sclerosing adenosis and diagnostic values of ultrasonography. Chin J Ultrasonogr, 2016,25(3): 263-264.郑磊, 吕夕明, 黄福光. 乳腺硬化性腺病的超声诊断价值. 中华超声影像学杂志, 2016, 25(3): 263-264.
[6]Min P, Peng H, Jiang GB. Meta-analysis of the value of diffusion weighted imaging differential diagnosis for be-nign and malignant breast tumors. Modern Oncology, 2015, 23(22): 3316-3319.闵朋, 彭虹, 江广斌. 磁共振扩散加权成像鉴别诊断良恶性乳腺肿瘤价值的 Meta 分析. 现代肿瘤医学, 2015, 23(22): 3316-3319.
[7]Yang Y, Xu W, Rong DD, et al. General non-enhancedment MRI combined with DWI in screening of breast cancer initial trial at 3.0 T.J Pract Radiol, 2012, 28(12): 1895-1901.杨英, 许卫, 戎冬冬, 等. 3.0 T MRI普通平扫联合DWI对乳腺癌筛查的初步探讨. 实用放射学, 2012, 28(12): 1895-1901.
[8]Zhang XM, Lin J, Ye F, et al. Value of diffusion-weighted imaging with different b values in the diagnosis of breast lesions at 3.0 T MRI. Chin Comput Med Imag, 2012, 18(3): 219-223.张雪梅, 林江, 叶芳, 等. 乳腺良恶性病变的3.0 T磁共振扩散加权成像鉴别诊断及b值优化. 中国医学计算机成像杂志, 2012, 18(3):219-223.
[9]Oztekin PS, Tuncbilek I, Kosar P, et al. Nodular sclerosing adenosis mimicking malignancy in the breast: magnetic resonance imaging findings. Breast J, 2011, 17(1): 95-97.
[10]Yao GY, Yao WQ, Zhang L. Xray diagnosis and clinically pathological analysis with sclerosing adenosis of the breast. J Pract Radiol, 2014, 30(10): 1650-1652.姚国燕, 姚文青, 张璘. 乳腺硬化性腺病的X线诊断及临床病理分析. 实用放射学, 2014, 30(10): 1650-1652.
[11]Chen WJ, Wang QS, Zeng B, et al. Comparative study of dynamic MRI, mammography, and ultrasonic in the diagnosis of breast lesions. Chin J Magn Reson Imaging, 2012, 3(2): 125-128.陈文静, 汪青山, 曾斌, 等. 乳腺病变动态增强MRI、乳腺摄影片、超声、病理对照研究.磁共振成像, 2012, 3(2):125-128.
[12]Gity M, Arabkheradmand A, Taheri E, et al. Magnetic resonance imaging features of adenosis in the breast. J Breast Cancer, 2015,18(2): 187-194.
