离子共存问题的解题研究
2018-05-04朱彦芳
朱彦芳
(韩山师范学院化学与环境工程学院,广东 潮州 521041)
溶液中的离子共存问题是高中学习的重点也是难点,主要是因为这类题型具有一定的综合性,同时又因存在隐含条件,故学生很容易在这道失分,因此对这一类题进行梳理总结,形成知识体系,有利于学生掌握这类题。
1 离子共存与离子反应
离子不能大量共存的原因是离子间发生了反应,离子反应通常有以下四种类型。
(1)复分解反应
1离子之间反应,生成了难溶物沉淀。如CO32-与Ca2+,SO42-与Ba2+、Pb2+,具体查溶解性表。
2离子结合,形成了会挥发性气体。如H+与CO32-、HCO3-、S2-、HS-、HSO3-,OH-与NH4+。
3离子结合,形成了更难电离的物质,如H+与ClO-、F-等。
(2)互相促进的完全双水解反应
主要有:Al3+与S2-、CO32-、AlO2-、SiO32-,Fe3+与CO32-、SiO32-。
(3)络合反应
如:Fe3+与SCN-
(4)氧化还原反应
主要有:Fe3+与I-,NO3-(H+)与Fe2+,MnO4-(H+)与Br-等。
2 题干中的常见陷阱

表 题干中的常见陷阱
3 例题分析讲解考点
例1.常温下,下列各组离子在指定溶液中一定能大量共存的是()。
A.1.0mol·L—1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3C00-、Br-
D.与铝反应产生大量H2溶液:Na+、K+、CO32-、NO3-
[解析]选C。A项,KNO3中的NO3-与H+在一起,相当于硝酸,能将Fe2+氧化为Fe3+,A项不能大量共存;B项,甲基橙呈红色说明溶液中含大量的H+,H+能与AlO2-反应,故不能大量共存;C项,pH=12的溶液含有大量的OH-,OH-与K+、Na+、CH3C00-、Br-都不反应,能大量共存;D项,与铝反应产生氢气的溶液,可能是酸性溶液,或是碱性溶液,H+能与CO32-反应,所以D项不一定能够大量共存。
例2.下列离子或者分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是()。
A.Na+、K+、NO3-、SiO32-
B.K+、Al3+、SO42-、S2-
C.Ag+、Na+、NH3·H2O、NO3-
D.Fe2+、Cu2+、SO42-、Cl-
[解析]选D。A项,通入NO2溶液显酸性,生成H2SiO3沉淀,A项不符合题意;B项,Al3+水解显酸性,S2-水解显碱性,二者不能大量共存;C项,NH3·H2O与Ag+不能大量共存,不符合题意;D项通入NO2溶液中含有强氧化性的硝酸,Fe2+被氧化,且不会生成沉淀,符合题意。
4 小结
根据两大道例题,我们可以发现考查的离子都是我们熟悉的,所以只要掌握了各个离子的性质,挖掘题干中信息,认真审题,我们就可以选出正确的答案,因此,我们要总结归纳常见离子的性质。
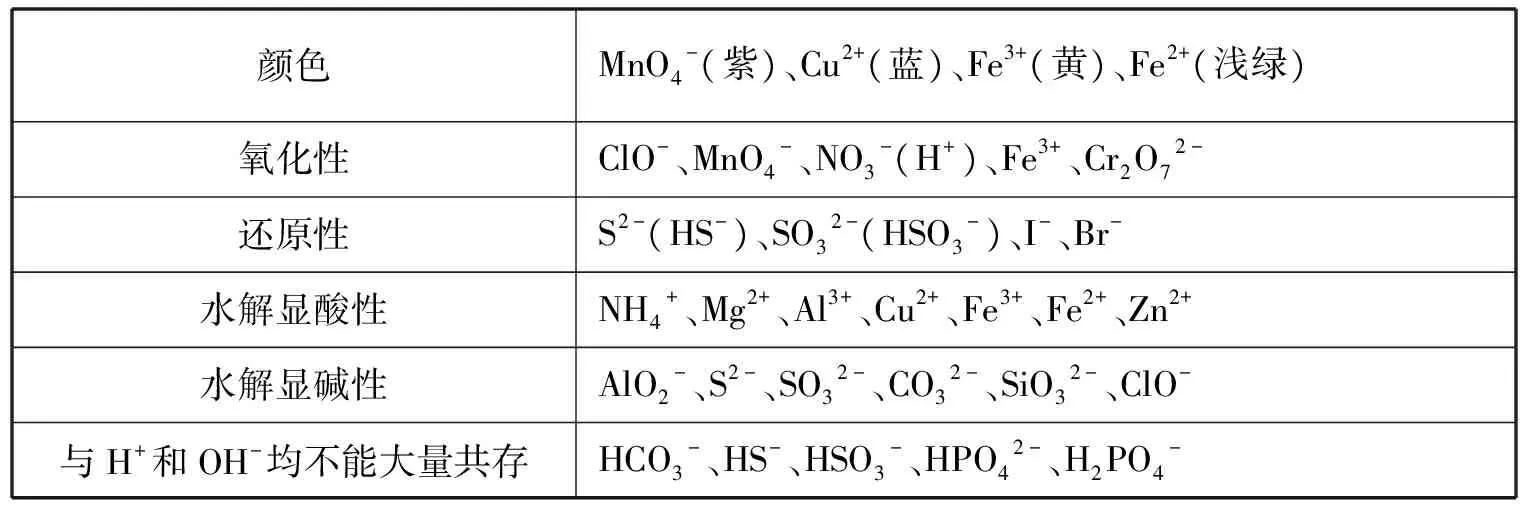
表 常见离子的性质
[1]王后雄,陈国庆.清华大学出版社.《高考化学核心考点解读》.2015.
